下调lncRNA-H19表达对H2O2诱导的HUVEC炎性损伤的影响
宋姗姗,杨 洋,陈 阳,何 静*
(1西安医学院第一附属医院产科,西安 710077;2西安市人民医院,西安市第四医院生殖医学中心;*通讯作者,E-mail:drhej@126.com)
子痫前期(preeclampsia,PE)在孕妇中发病率约为4%~6%,是导致母胎死亡的重要因素之一[1]。目前PE发病机制尚不明确,相关研究提示PE为多种因素共同导致的疾病[2]。其中,螺旋动脉重铸不足而导致的胎盘功能障碍是该疾病的主要病因学说;胎盘源性因素作用于全身系统,引发的包括血管内皮功能障碍、炎性反应激活等一系列病理表现可能为PE发生的潜在机制[3]。相关研究表明,非编码RNA(non-coding RNA,ncRNA)包括lncRNA、miRNA等在PE患者胎盘组织中差异性表达[4-6],这些ncRNA能够通过交互调控,影响下游靶基因,在调节细胞炎性损伤性死亡、内皮细胞及滋养细胞功能等过程中发挥重要作用。
lncRNA-H19被发现在肿瘤发生、生殖系统功能调节等领域中发挥重要作用[7]。其中,lncRNA-H19在胎儿生长受限患者的胎盘组织中低表达,并能够间接调控滋养细胞的增殖、侵袭和自噬,从而与胎儿生长受限发病相关[8]。提示lncRNA-H19能够参与胎盘功能的建立过程。在血管内皮细胞模型中,lncRNA-H19能够通过发挥内源性竞争性RNA(competing endogenous RNA,ceRNA)作用,参与了腹主动脉瘤的形成[9];而lncRNA-H19的沉默能够加重细胞焦亡,导致动脉粥样硬化发生[10]。但lncRNA-H19与PE的相关性,及其参与PE疾病的初步机制目前尚不明确。本研究通过观察lncRNA-H19与PE相关性,及其是否能够参与HUVEC的炎性损伤调节过程,进一步探讨lncRNA-H19更多的相关生物学功能,及其参与PE的部分机制。
1 材料和方法
1.1 临床样本
收集2021年1月至2021年8月在西安医学院第一附属医院产科住院行剖宫产分娩的15例PE晚孕患者(PE组),诊断标准严格依据第九版《妇产科学》[11],该组患者除PE外无其他妊娠期合并症,孕周(38.3±1.2)周,年龄(30.1±4.2)岁,体质量指数(body mass index,BMI)(26±1.9)kg/m2。同时收集同期住院分娩的正常孕妇15例作为对照组,该组患者无妊娠期合并症,孕周(38.6±1.2)周,年龄(29.4±4.9)岁,BMI(26.1±2.3)kg/m2。两组孕妇均为单胎初产妇,入院前均未接受任何治疗,既往无遗传性、传染性疾病及代谢性疾病病史;无慢性病药物使用、放射线及毒物接触史,无家族性遗传病史。两组孕妇孕周、年龄、BMI差异无统计学意义(P>0.05)。本研究经医院伦理委员同意并批准(批准文号:XYFY2021LSK-018),所有患者均签署知情同意书。
1.2 主要细胞、试剂和材料
HUVEC细胞购自ATCC中国细胞库。RPMI-1640培养基、胎牛血清(FBS)、青霉素-链霉素(美国Gibco公司);H2O2(美国Sigma公司);F12K培养基、磷酸缓冲盐溶液(PBS)(中国武汉普诺赛科技有限公司);PrimeScript RT reagent kit、SYBR Premix Extaq RT-PCR kit(日本TaKaRa公司);Lipofectamine2000(美国ThermoFisher公司);siRNA-H19质粒(即lncRNA-H19抑制剂)及其阴性对照物(siRNA-H19 NC)(中国广州吉赛生物科技股份有限公司);TRIzol(美国Invitrogen公司);PCR引物序列(中国北京擎科生物有限公司);RIPA裂解液、BCA蛋白浓度测定试剂盒、IL-18、IL-1β ELISA检测试剂盒(中国上海碧云天公司);p-ERK、p-JNK、p-p38、β-actin单克隆抗体、HRP标记二抗(中国武汉博士德生物工程有限公司);PVDF膜(美国Millipore公司);ECL底物液(中国北京普利莱基因技术有限公司);Annexin Ⅴ-FITC/PI双染试剂盒(美国BD公司)。
1.3 方法
1.3.1 血清及胎盘标本收集 入院后在接受药物及手术治疗前,分次采集、收集纳入的两组患者晨起空腹肘静脉血共计5 ml。所有血浆样本均在采集后置促凝管中,4 ℃静置过夜后2 000 r/min离心5 min,吸取上层血清至EP管中,-80 ℃冰箱保存备用。
于胎盘娩出后迅速收集两组患者胎盘组织标本,取1 cm3大小组织若干块,PBS液中迅速漂洗后,置入液氮中保存备用。
1.3.2 细胞培养及转染 将HUVEC细胞取出后解冻,接种于含10%FBS、1%青霉素-链霉素的RPMI-1640培养基中,37 ℃、5% CO2饱和湿度条件下培养。取对数生长期的HUVEC细胞,用RPMI-1640培养基制成单细胞悬液,按每孔2×105个细胞量,均匀地接种于6孔板中,37 ℃、5%CO2饱和湿度条件培养过夜;待细胞生长密度至80%左右时按照Lipofectamine 2000说明书要求转染siRNA-H19及其对照物(siRNA-H19 NC),转染后6 h于荧光显微镜下观察转染效率(羧基荧光素酶FAM标记对照)。转染后进行H2O2培养液干预,根据文献[12]报道,干预浓度为300 μmol/L。实验分组:NC组(阴性对照)、H2O2组(H2O2干预培养)、H2O2+H19抑制对照组(siRNA-H19阴性对照物转染细胞+H2O2干预培养)、H2O2+H19抑制组(siRNA-H19转染细胞+H2O2干预培养)。
1.3.3 qRT-PCR检测lncRNA-H19 mRNA水平表达 Trizol法分别提取血清标本、胎盘组织中以及HUVEC细胞中总RNA;检测RNA质量后,按照PrimeScript RT reagent kit、SYBR Premix Extaq RT-PCR kit说明书步骤进行qRT-PCR反应,引物序列见表1。反应条件:95 ℃ 10 min,95 ℃ 15 s,60 ℃ 30 s,95 ℃ 15 s,40个循环。以U6为内参,进行PCR反应。每次检测设定3个复孔,每个样本重复3次。根据PCR扩增曲线,使用2-ΔΔCt法计算目的基因lncRNA-H19 mRNA水平的表达情况。

表1 目的基因引物序列
1.3.4 IL-1β、IL-18、p-ERK、p-JNK、p-p38表达水平的检测 转染48 h后,按照ELISA试剂盒说明书步骤,检测4组HUVEC细胞培养上清液中IL-1β、IL-18表达量,记录酶标仪测量的OD450值进行统计学分析。
转染48 h后,使用RIPA裂解液分别提取4组HUVEC细胞中总蛋白。检测蛋白浓度后,Western blot检测p-ERK、p-JNK、p-p38蛋白水平表达:配胶后十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE);将目的条带电转至PVDF膜;一抗4 ℃孵育过夜(抗体浓度:p-ERK 1 ∶1 000、p-JNK 1 ∶1 500、p-p38 1 ∶1 000、β-actin内参1 ∶500);HRP标记二抗(1 ∶10 000)室温孵育2 h;ECL显影、定影,BandScan分析胶片灰度值。
1.3.5 HUVEC细胞成管能力检测 转染48 h后,取对数生长期的HUVEC细胞,用F12K培养基制成单细胞悬液,按每孔2×105个细胞量,接种到6孔板中,37 ℃、5%CO2饱和湿度条件培养过夜;实验分组同1.3.2中细胞分组。培养48 h后,使用0.25%胰酶消化HUVEC,用无血清培养基制成单细胞悬液,按照每孔1×105/个细胞,均匀接种到预铺有基质胶的24孔板中,37 ℃、5%CO2过夜培养;培养8~12 h后拍照观察,检测量化指标为总分支长度及管腔数,使用ImageJ软件进行数据分析,后续行统计学分析。
1.3.6 流式细胞术检测HUVEC细胞凋亡 实验分组同1.3.2中细胞分组,将HUVEC细胞消化后,使用PBS液重悬成为单细胞悬液,无水乙醇固定细胞后,按照Annexin Ⅴ-FITC/PI双染试剂盒说明书步骤,给每组细胞样本中加入5 μl Annexin Ⅴ-FITC及5 μl PI,混匀后避光,反应15 min后上样至流式细胞仪进行检测。使用Expo32 ADC Analysis系统统计分析细胞凋亡检测结果;应用凋亡指数B2+B4作为量化指标进行统计学分析。
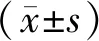
2 结果
2.1 HUVEC细胞转染效率检测
转染后6 h于荧光显微镜下观察HUVEC细胞转染效率,细胞转染效率超过90%(见图1)。
图1 HUVEC细胞转染效率 (×200,FMA标记)Figure 1 Transfection efficiency of HUVEC cells (×200, FMA mark)
2.2 血清标本、胎盘组织及HUVEC细胞中lncRNA-H19表达情况
qRT-PCR结果显示,与正常组相比,PE组孕妇血清及胎盘组织中lncRNA-H19的表达降低,差异均具有统计学意义(P<0.01,见表2)。
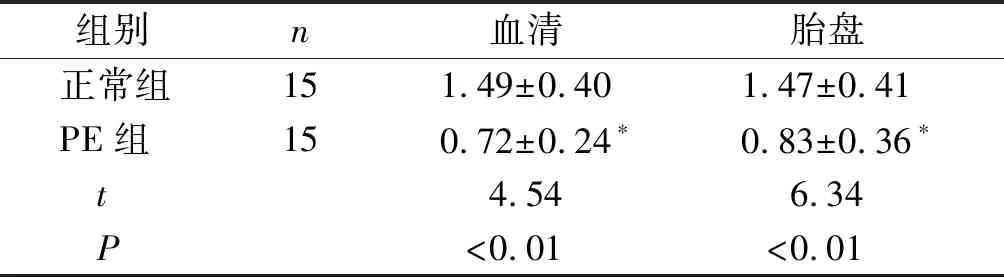
表2 血清、胎盘组织中lncRNA-H19表达水平

表3 lncRNA-H19在HUVEC中mRNA水平表达情况
2.3 各组上清液中IL-1β、IL-18及细胞中p-ERK、p-JNK、p-p38的表达情况
ELISA结果显示:H2O2组、H2O2+H19抑制对照组、H2O2+H19抑制组HUVEC上清液中IL-1β、IL-18水平均高于NC组(P<0.05,见表4);与H2O2组、H2O2+H19抑制对照组相比,H2O2+H19抑制组上清液中IL-1β、IL-18表达水平均进一步增高(P<0.05,见表4)。
Western blot结果显示:H2O2组、H2O2+H19抑制对照组、H2O2+H19抑制组HUVEC细胞中p-ERK、p-JNK、p-p38蛋白水平表达均高于NC组(见表4,图2);与H2O2组和H2O2+H19抑制对照组相比,H2O2+H19抑制组HUVEC细胞中p-ERK、p-JNK、p-p38表达水平均增高(见表4,见图2)。

表4 HUVEC上清液中IL-1β、IL-18表达水平(n=3,pg/ml)
2.4 各组HUVEC细胞管样形成总分支长度及管腔数情况
管样形成实验结果显示,与NC组相比,H2O2组、H2O2+H19抑制对照组、H2O2+H19抑制组HUVEC细胞的总分支长度及管腔数均降低(P<0.05,见图3,表5);与H2O2组、H2O2+H19抑制对照组相比,H2O2+H19抑制组HUVEC细胞的总分支长度及管腔数均进一步降低(P<0.05,见图3,表5)。
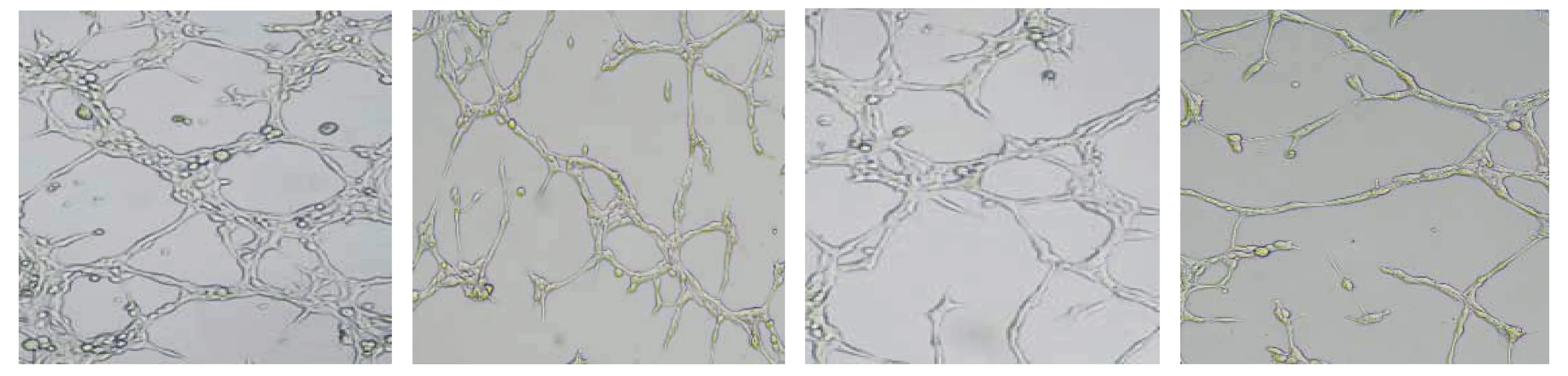
NC组 H2O2组 H2O2+H19抑制对照组 H2O2+H19抑制组图3 各组HUVEC血管形成情况 (×200)Figure 3 Angiogenesis ability of HUVECs in each group (×200)

表5 各组HUVEC管样形成情况 (n=3)
2.5 流式细胞术检测各组HUVEC凋亡情况
流式细胞术结果显示,与NC组相比,H2O2组、H2O2+H19抑制对照组、H2O2+H19抑制组HUVEC细胞的凋亡率均增高(P<0.05,见图4);与H2O2组、H2O2+H19抑制对照组相比,H2O2+H19抑制组HUVEC的凋亡率增高(P<0.05,见图4)。
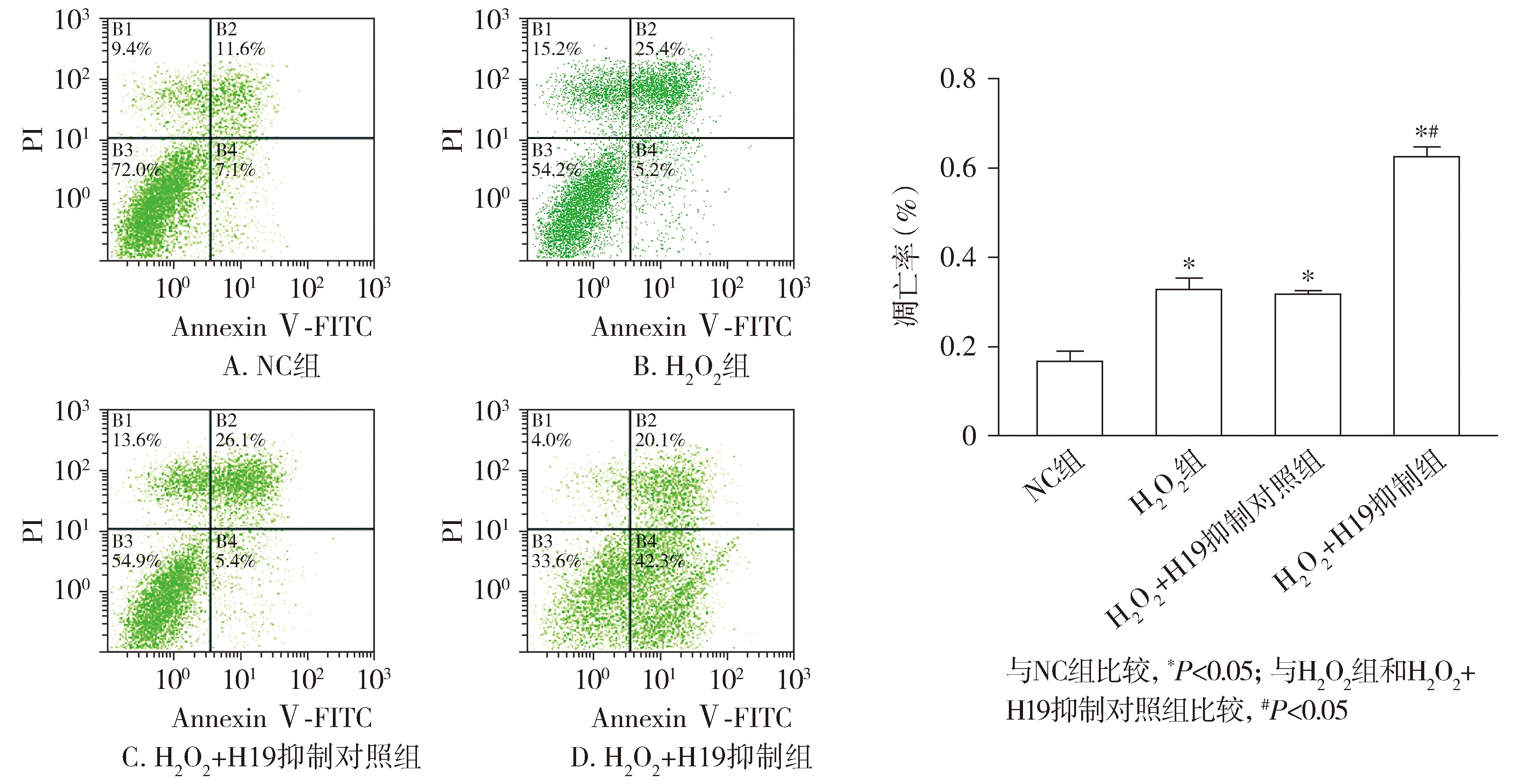
图4 各组HUVEC细胞凋亡率Figure 4 Apoptosis rate of HUVECs in each group
3 讨论
PE是以高血压、蛋白尿等多系统器官功能紊乱为主要表现的全身性疾病,是妊娠期导致孕产妇及胎儿不良结局的常见疾病[1]。众所周知,胎盘功能异常与PE发病具有直接相关性[13];PE时,由于胎盘浅着床,导致胎盘血流灌注异常,诱发氧化-抗氧化过程失调,出现母胎界面的氧化应激损伤[14];伴随着胎盘的分泌效应,始于胎盘的炎症性改变也导致了PE患者从“局部”到“全身”的广泛的全身性内皮功能障碍,进而出现多系统临床症状。
正常的血管内皮细胞功能在胎盘建立以妊娠维系等过程中起到至关重要的作用,如出现内皮细胞功能障碍、炎症性反应、内皮细胞氧化应激发生等,不仅会成为复发性流产、PE等疾病的直接诱因[15],也会导致PE中后期母体全身多系统并发症的出现。而lncRNA-miRNA构成的网路系统能够参与上述病理生理过程,并且已经在PE病因学研究中得到了明确[16,17]。本研究中,我们发现与正常孕妇相比,lncRNA-H19在PE患者血清及胎盘组织中均表达降低,提示从局部胎盘组织到母体全身循环系统,lncRNA-H19均存在差异性表达,lncRNA-H19可能与胎盘功能障碍、血管内皮损伤等PE相关的病理过程存在相关性。我们在PE胎盘中发现的lncRNA-H19表达趋势与张嫘等[8]在胎儿生长受限胎盘组织中检测到的表达趋势一致。
虽然lncRNA能够在转录水平以及表观遗传层面均发挥生理作用,但却无法直接编码功能性蛋白,其大多通过发挥ceRNA等作用方式调控miRNA从而实现其功用[18]。在人微血管内皮细胞中,抑制lncRNA-H19表达条件下,导致miR-181a高表达,而miR-181a则进一步通过降低丝裂原活化蛋白激酶(mitogen-activated protein kinases, MAPKs)信号通路和c-Jun氨基末端激酶(c-Jun N-terminal kinase, JNK)通路激活,减少血管内VEGF合成,进而影响细胞成管能力[9],提示lncRNA-H19能够对炎性通路产生影响。因H2O2能够通过其强氧化作用诱发细胞炎性死亡,故本研究中,我们构建了H2O2诱导的HUVEC细胞氧化应激模型,验证了H2O2干预后HUVEC中p-ERK、p-JNK、p-p38及上清液中IL-1β、IL-18表达均增高;而在该细胞模型中抑制lncRNA-H19表达后,HUVEC中p-ERK、p-JNK、p-p38在蛋白水平进一步增高,而培养上清中IL-1β、IL-18表达也呈相同趋势;细胞功能验证发现H2O2+H19抑制时,HUVEC管腔形成能力下降,凋亡率增高;综上提示降调节lncRNA-H19表达能够影响炎症通路从而增强H2O2对HUVEC的炎性损伤。
炎性因素为PE病因之一,母胎界面促炎-抗炎免疫失衡、子宫灌注压降低以及多种炎性通路涉及其中;作为炎性通路之一的MAPKs由细胞外信号调节激酶(extracellular regulated kinases, ERK)、P38丝裂原激活蛋白激酶(P38 mitogen-activated protein kinases, P38 MAPK)以及JNK组成;ERK通过磷酸化(phosphorylated)过程,成为活化的p-ERK,并由细胞质转位到核内,进而介导P38、JNK的转录活化,参与细胞增殖与分化、形态维持、凋亡等多种生物学过程[9]。而核因子-κB(nuclear factor kappa B,NF-κB)为另外一条重要的炎性通路,该通路激活能够促进核苷酸结合寡聚化结构域样受体家族含pyrin结构域蛋白3(NOD-like receptor family, pyrin domain containing protein3,NLRP3)炎症小体分泌炎性因子IL-1β及IL-18;而在A549细胞中,ERK的级联磷酸化过程也能够激活NF-κB通路[19]。ERK的磷酸化使得MAPKs/NF-κB通路具有部分共同路径参与体内炎症过程。而多种lncRNA在循环系统细胞中通过调节MAPKs/NF-κB通路参与细胞炎症性损伤已得到了验证[20],其中lncRNA-H19被发现能够抑制氧化低密度脂蛋白(ox-LDL)诱导的NF-κB激活[10]。结合本研究结果,提示:PE时,低表达的lncRNA-H19可能通过对下游miRNA发挥ceRNA样作用,进一步影响MAPKs通路磷酸水平及NF-κB下游炎性因子的产生,诱发HUVEC细胞功能异常、凋亡增加,一方面参与了胎盘形成异常,另一方面,母体血液中低表达的lncRNA-H19也可能加重了PE时母体血管内皮损伤及全身炎症反应的进展。既往研究[21]多集中于滋养细胞炎症性损伤参与PE发病,而关于内皮细胞层面的相关研究尚少;但是,本研究仅进行了初步的现象型研究,lncRNA-H19调控炎性通路参与PE发病的具体机制仍需进一步探索。
综上,lncRNA-H19在PE患者胎盘组织、血清中具有一致的低表达趋势,明确了其与PE的相关性;lncRNA-H19可能通过调节炎症通路激活,影响了如HUVEC等内皮细胞的炎性损伤过程;而PE时,在lncRNA-H19低表达的情况下,进一步增强了炎症通路的激活,参与了从胎盘界面到母体循环的炎性反应产生过程。通过本研究,为进一步探讨lncRNA在PE发病过程中的具体作用方式,以及其能否具有成为PE疾病标志物的潜力等方面提供了一定理论依据。

