藤茶总黄酮通过TGF-β/Smad通路对肝纤维化小鼠的作用机制研究*
王利兵,李 雯,李木松
(1.唐山市工人医院,河北 唐山 063000;2.保定市人民医院,河北 保定 071000)
肝纤维化是由各种致病因素导致肝脏中大量细胞外基质沉积,纤维性瘢痕组织形成的一个病理过程,其长期恶化会发展成肝硬化、肝癌等。肝纤维化早期是一个可逆的过程,因此早期治疗对于预防肝硬化和肝癌至关重要。研究发现,藤茶总黄酮(Tengcha flavonoids,TF)具有多种药理学作用,可通过激活细胞凋亡信号通路,达到抗肝癌作用[1],而且TF能干预糖尿病大鼠糖脂代谢及氧化应激损伤,改善胰腺和肝脏的病理学变化[2]。此外,TF可改善四氯化碳(carbon tetrachloride,CCl4)造成的肝损伤[3]。已有多项研究表明,转化生长因子β(transforming growth factor beta,TGF-β)/Smad信号通路在调节组织纤维化中具有重要作用[4-5],本研究旨在探讨TF是否能通过调节TGF-β/Smad信号通路减轻CCl4诱导的肝纤维化。
1 材 料
1.1 实验动物健康8周龄SPF级雄性昆明小鼠50只,体质量(35±3)g,购自北京维通利华实验动物技术有限公司,动物生产许可证号:SCXK(京)2016-0011,饲养温度20~25℃,相对湿度45~55℃,光照12 h明暗交替,自由饮食饮水,适应性饲养3 d用于实验。该实验经唐山市工人医院实验动物伦理委员会批准,伦理审批号:TSGRYY20190421。
1.2 药物与试剂藤茶总黄酮(宝鸡晨光生物科技有限公司,批号:20190503);转化生长因子β1(transforming growth factorβ1,TGF-β1)(批号:ab215715)、p-Smad2(批号:ab188334)、Smad7(批号:ab216428)、胶原Ⅰ(CollagenⅠ,ColⅠ)(批号:ab34710)均购自美国Abcam公司;天门冬氨酸氨基转移酶(aspartate aminotransferase,AST)试剂盒(批号:010-2-1)、丙氨酸氨基转移酶(alanine aminotransferase,ALT)试剂盒(批号:C009-2-1)均购自南京建成生物工程研究所。
1.3 主要仪器CKX53型倒置显微镜(日本OLYMPUS公司);SpectraMax M5型多功能酶标仪(美国MD公司);164-5052型电泳仪(美国Bio-Rad公司);ASP200S型脱水机和EG1150型自动包埋机(德国Leica公司)。
1.4 分组与造模50只小鼠按照随机数字表法分为对照组、模型组、藤茶总黄酮组、激动剂组和藤茶总黄酮+激动剂组,每组10只。除对照组外,其余各组小鼠背部皮下注射25%四氯化碳(CCl4)花生油溶液,2 mL/kg,每3 d注射1次,连续10周,制备小鼠肝纤维化模型[6]。对照组小鼠背部皮下注射等量100%花生油溶液,每3 d注射1次,连续10周。小鼠若出现精神萎靡、反应迟钝,毛色干燥粗糙,血清AST和ALT水平明显升高,病理结果显示肝组织损伤,炎症细胞浸润并有大量胶原沉积则说明模型制备成功[7]。
1.5 实验给药造模同时给药,藤茶总黄酮组和藤茶总黄酮+激动剂组小鼠灌胃藤茶总黄酮溶液,100 mg/kg,1次/d,连续10周[8];对照组、模型组和激动剂组小鼠灌胃等体积蒸馏水;激动剂组和藤茶总黄酮+激动剂组小鼠同时腹腔注射rhTGF-β1,1 μg/kg,1次/d,连续10周;对照组、模型组和藤茶总黄酮组小鼠同时腹腔注射等量生理盐水。
1.6 观察指标
1.6.1 血清ALT、AST活性测定 第10周末,给药结束后2 h,称取各组小鼠体质量。戊巴比妥钠麻醉小鼠,收集腹主动脉血液于EP管中,室温静置30 min后,3 000 r/min离心15 min,离心半径8 cm,收集上清液,全自动生化分析仪检测血清中ALT和AST活性。
1.6.2 肝指数测定 腹主动脉采血完成后,颈椎脱臼法处死小鼠,打开腹腔,剥离肝脏,置于冰PBS中清洗,吸水纸吸干多余水分,称取肝脏质量,计算肝指数。肝指数=肝脏质量(mg)/体质量(g)×100%。
1.6.3 HE染色观察肝脏病理学变化 取部分肝脏,置于10%甲醛溶液中固定24 h,脱水、透明、石蜡包埋切片,切片厚度为4 μm,经二甲苯透明,梯度乙醇脱水后,进行苏木精和伊红染色,中性树胶封片,光学显微镜下观察肝组织病理改变。
1.6.4 Masson染色观察肝脏纤维化 取“1.6.3”项下病理切片,二甲苯透明、梯度乙醇脱水、苏木精染色5 min,酸性乙醇分化,品红染液染色5 min,磷钼酸溶液孵育15 min,苯胺蓝染液染色10 min,酸性乙醇分化。常规脱水、透明,中性树胶封片。光学显微镜下观察肝脏纤维化情况。每张切片随机选取5个视野,并计算每个视野蓝染面积。胶原面积百分比(%)=蓝染面积/肝脏组织总面积×100%。
1.6.5 蛋白印迹法检测肝脏组织中ColⅠ、TGF-β1、p-Smad2、Smad7蛋白表达 取部分肝脏组织,液氮研磨,加入RIPA裂解液室温静置30 min,4℃12 000 r/min离心10 min,离心半径10 cm,收集上清液于EP管中,参照BCA试剂盒说明书测定蛋白浓度,制备蛋白样品。配制凝胶,每孔20 μL蛋白样品,恒压120 V电泳1.5 h,停止电泳。恒流0.3 A湿转2 h,室温封闭1 h,4℃ColⅠ、α-SMA、TGF-β1、p-Smad2、Smad7一抗(1∶1 000)孵育过夜,二抗(1∶5 000)孵育2 h,ECL法显色。Image J软件计算蛋白条带灰度值,目的蛋白条带灰度值与GAPDH条带灰度值的比值为目的蛋白相对表达量。
1.7 统计学方法采用SPSS 21.0统计学软件进行分析,计量资料以“均数±标准差”(±s)表示,经正态性检验和方差齐性检验,多组比较用单因素方差分析,进一步两两比较采用LSD-t检验。P〈0.05为差异有统计学意义。
2 结 果
2.1 各组小鼠血清ALT、AST活性比较模型组小鼠血清ALT、AST活性均明显高于对照组(P〈0.05);藤茶总黄酮组小鼠血清ALT、AST活性均明显低于模型组(P〈0.05),而激动剂组小鼠血清ALT、AST活性均明显高于模型组(P〈0.05);藤茶总黄酮+激动剂组小鼠血清ALT、AST活性均明显高于藤茶总黄酮组,而低于激动剂组(P〈0.05)。(见表1)
表1 各组小鼠血清ALT、AST活性比较(±s)
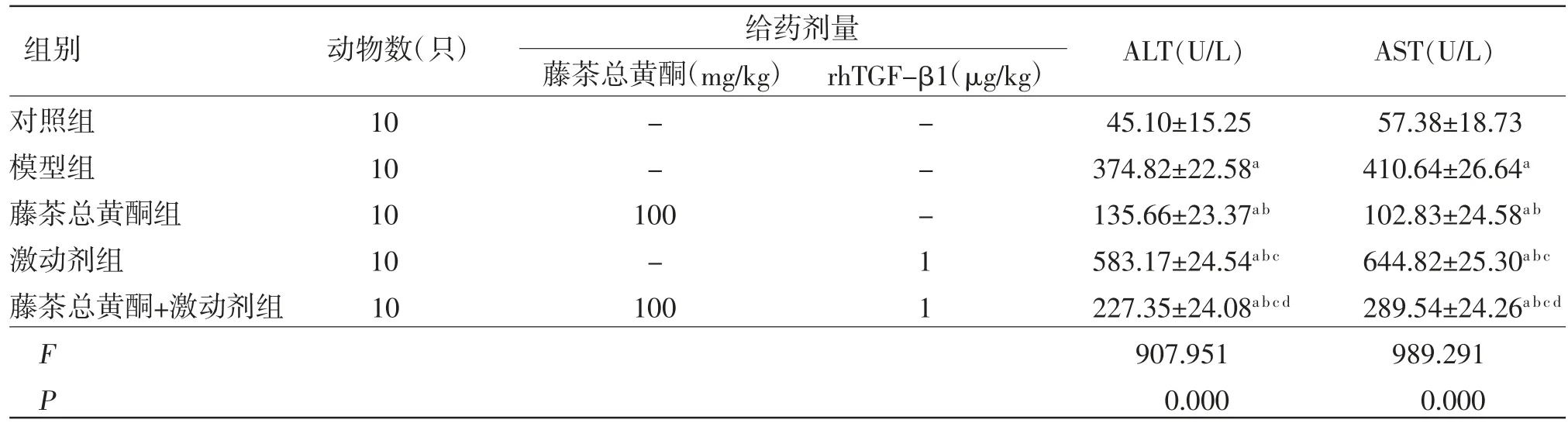
表1 各组小鼠血清ALT、AST活性比较(±s)
注:与对照组比较,aP〈0.05;与模型组比较,bP〈0.05;与藤茶总黄酮组比较,cP〈0.05;与激动剂组比较,dP〈0.05
给药剂量藤茶总黄酮(mg/kg)rhTGF-β1(μg/kg)对照组 10 - - 45.10±15.25 57.38±18.73模型组 10 - - 374.82±22.58a 410.64±26.64a藤茶总黄酮组 10 100 - 135.66±23.37a b 102.83±24.58a b激动剂组 10 - 1 583.17±24.54a b c 644.82±25.30a b c藤茶总黄酮+激动剂组 10 100 1 227.35±24.08a b c d 289.54±24.26a b c d F 907.951 989.291 P 0.000 0.000组别 动物数(只) ALT(U/L) AST(U/L)
2.2 各组小鼠肝指数比较模型组小鼠肝指数明显高于对照组(P〈0.05);藤茶总黄酮组小鼠肝指数明显低于模型组(P〈0.05),而激动剂组小鼠肝指数明显高于模型组(P〈0.05);藤茶总黄酮+激动剂组小鼠肝指数明显高于藤茶总黄酮组,而低于激动剂组(P〈0.05)。(见表2)
表2 各组小鼠肝指数比较(±s)
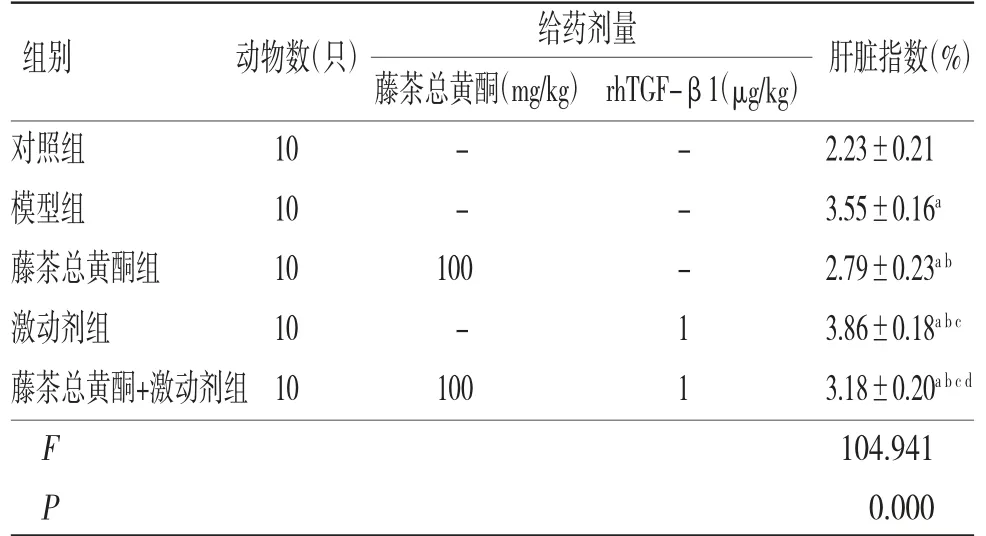
表2 各组小鼠肝指数比较(±s)
注:与对照组比较,aP〈0.05;与模型组比较,bP〈0.05;与藤茶总黄酮组比较,cP〈0.05;与激动剂组比较,dP〈0.05
给药剂量藤茶总黄酮(mg/kg)rhTGF-β1(μg/kg)对照组 10 - - 2.23±0.21模型组 10 - - 3.55±0.16a藤茶总黄酮组 10 100 - 2.79±0.23a b激动剂组 10 - 1 3.86±0.18a b c藤茶总黄酮+激动剂组10 100 1 3.18±0.20a b c d F 104.941 P 0.000组别 动物数(只)肝脏指数(%)
2.3 各组小鼠肝组织病理学变化对照组小鼠肝小叶结构清晰可见,肝索排列整齐,肝细胞大小均匀,未见变性坏死;模型组小鼠肝小叶结构受损,模糊不清,肝细胞发生脂肪变性水肿,部分细胞出现坏死,肝索结构紊乱,炎症细胞浸润;藤茶总黄酮组小鼠肝细胞脂肪变性和坏死减少,炎症细胞浸润减轻;激动剂组小鼠肝细胞发生脂肪变性,可见肝细胞坏死和炎症细胞浸润;藤茶总黄酮+激动剂组小鼠肝组织结构稍正常,炎症细胞浸润减轻。(见图1)
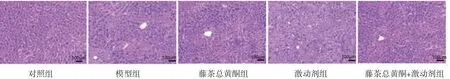
图1 各组小鼠肝组织病理学变化情况(HE,×200)
2.4 各组小鼠肝脏组织胶原面积百分比比较对照组小鼠肝小叶结构正常,肝索排列整齐,仅有少量胶原沉积;模型组小鼠肝脏组织胶原纤维增生,成条索状,导致肝小叶正常结构被破坏;藤茶总黄酮组小鼠肝细胞排列稍整齐,胶原沉积减轻;激动剂组小鼠肝脏组织胶原沉积增多,形成纤维间隔,肝小叶遭到破坏;藤茶总黄酮+激动剂组小鼠肝脏组织胶原沉积减少,病理损伤减轻。(见图2)
模型组小鼠肝脏组织胶原面积百分比明显高于对照组(P〈0.05);藤茶总黄酮组小鼠肝脏组织胶原面积百分比明显低于模型组(P〈0.05),激动剂组小鼠肝脏组织胶原面积百分比明显高于模型组(P〈0.05);藤茶总黄酮+激动剂组小鼠肝脏组织胶原面积百分比明显高于藤茶总黄酮组,而低于激动剂组(P〈0.05)。(见表3、图2)。
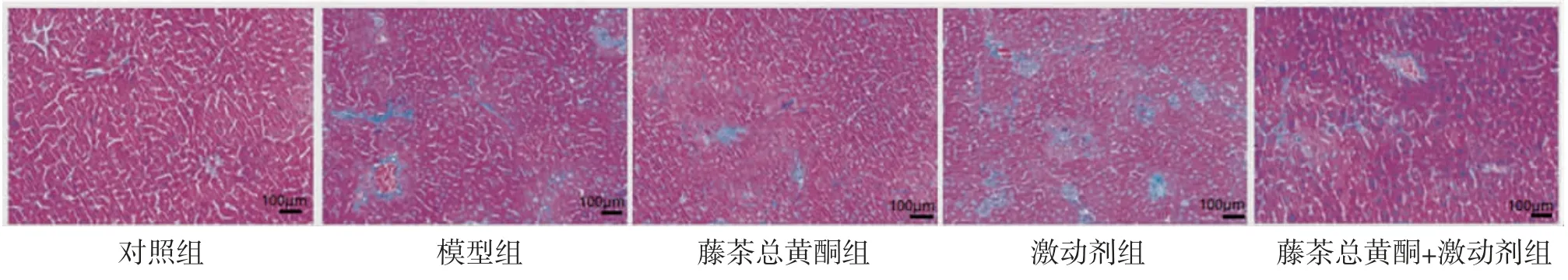
图2 各组小鼠肝脏组织Masson染色图(×200)
表3 各组小鼠肝脏组织胶原面积百分比比较(±s)
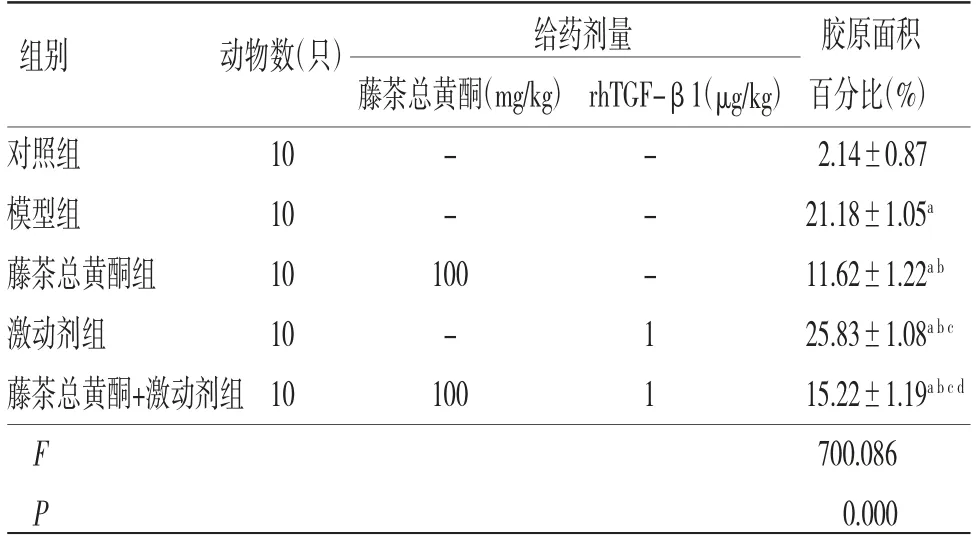
表3 各组小鼠肝脏组织胶原面积百分比比较(±s)
注:与对照组比较,aP〈0.05;与模型组比较,bP〈0.05;与藤茶总黄酮组比较,cP〈0.05;与激动剂组比较,dP〈0.05
给药剂量 胶原面积藤茶总黄酮(mg/kg)rhTGF-β1(μg/kg)百分比(%)对照组 10 - - 2.14±0.87模型组 10 - - 21.18±1.05a藤茶总黄酮组 10 100 - 11.62±1.22a b激动剂组 10 - 1 25.83±1.08a b c藤茶总黄酮+激动剂组10 100 1 15.22±1.19a b c d F 700.086 P 0.000组别 动物数(只)
2.5 各组小鼠肝脏组织中ColⅠ、TGF-β1、p-Smad2、Smad7蛋白相对表达量比较模型组小鼠肝脏组织中ColⅠ、TGF-β1和p-Smad2蛋白相对表达量均明显高于对照组(P〈0.05),Smad7蛋白相对表达量明显低于对照组(P〈0.05);藤茶总黄酮组小鼠肝脏组织中ColⅠ、TGF-β1和p-Smad2蛋白相对表达量均明显低于模型组(P〈0.05),Smad7蛋白相对表达量明显高于模型组(P〈0.05);激动剂组小鼠肝脏组织中ColⅠ、TGF-β1和p-Smad2蛋白相对表达量均明显高于模型组(P〈0.05),Smad7蛋白相对表达量明显低于模型组(P〈0.05);藤茶总黄酮+激动剂组小鼠肝脏组织中ColⅠ、TGF-β1和p-Smad2蛋白相对表达量明显高于藤茶总黄酮组(P〈0.05),而低于激动剂组(P〈0.05),藤茶总黄酮+激动剂组Smad7蛋白相对表达量明显低于藤茶总黄酮组(P〈0.05),而高于激动剂组(P〈0.05)。(见表4、图3)
表4 各组小鼠肝脏组织中ColⅠ、TGF-β1、p-Smad2、Smad7蛋白相对表达量比较(±s)
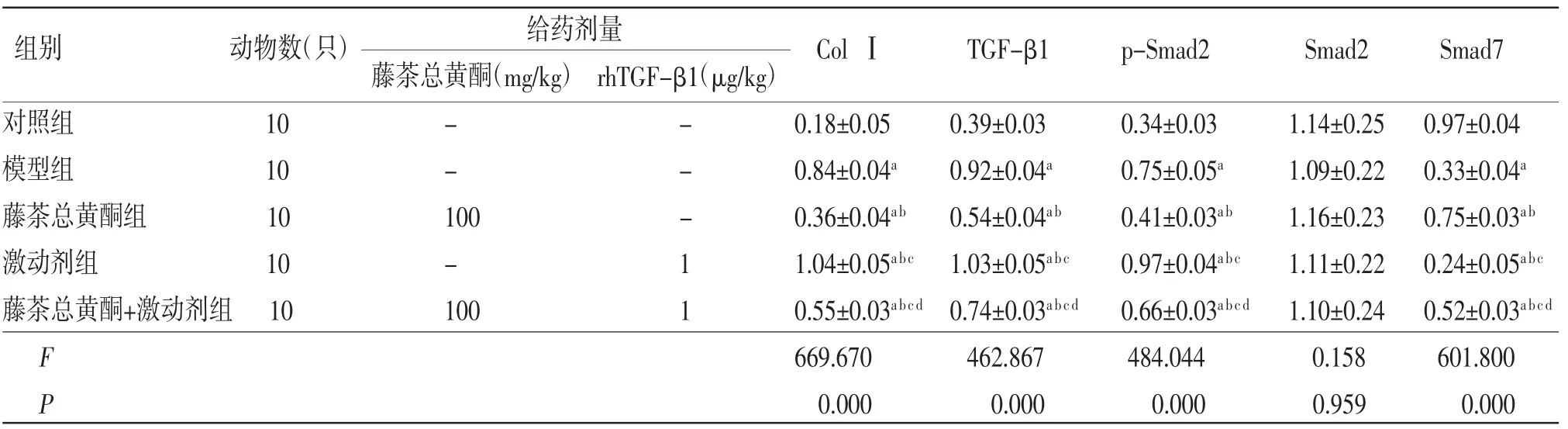
表4 各组小鼠肝脏组织中ColⅠ、TGF-β1、p-Smad2、Smad7蛋白相对表达量比较(±s)
注:与对照组比较,aP〈0.05;与模型组比较,bP〈0.05;与藤茶总黄酮组比较,cP〈0.05;与激动剂组比较,dP〈0.05
给药剂量藤茶总黄酮(mg/kg)rhTGF-β1(μg/kg)对照组 10 - - 0.18±0.05 0.39±0.03 0.34±0.03 1.14±0.25 0.97±0.04模型组 10 - - 0.84±0.04a 0.92±0.04a 0.75±0.05a 1.09±0.22 0.33±0.04a藤茶总黄酮组 10 100 - 0.36±0.04ab 0.54±0.04ab 0.41±0.03ab 1.16±0.23 0.75±0.03ab激动剂组 10 - 1 1.04±0.05abc 1.03±0.05abc 0.97±0.04abc 1.11±0.22 0.24±0.05abc藤茶总黄酮+激动剂组10 100 1 0.55±0.03abcd 0.74±0.03abcd 0.66±0.03abcd 1.10±0.24 0.52±0.03abcd F 669.670 462.867 484.044 0.158 601.800 P 0.000 0.000 0.000 0.959 0.000组别 动物数(只)ColⅠ TGF-β1 p-Smad2 Smad2 Smad7

图3 各组小鼠肝脏组织中ColⅠ、TGF-β1、p-Smad2、Smad7蛋白表达Western blotting图
3 讨 论
肝纤维化是由各种慢性肝脏疾病导致的肝损伤病理修复过程,主要病理学变化为细胞外基质过度沉积。肝纤维化时,炎症细胞浸润、过度增生等病理改变可导致肝功能紊乱。藤茶总黄酮的主要活性成分二氢杨梅素已被报道具有多种药理学活性。如二氢杨梅素能抑制高糖诱导的人视网膜上皮色素细胞氧化应激和凋亡,降低氧化应激损伤改善糖尿病小鼠内皮细胞功能障碍,抑制胆管癌细胞增殖、迁移和侵袭,促进凋亡[9-11]。藤茶总黄酮提取物可通过抗炎、调节糖脂代谢及肠道菌群等方式,干预糖尿病的发生发展[12]。但是,藤茶总黄酮是否能够改善肝纤维化须进一步探讨。
本研究通过皮下注射CCl4建立肝纤维化小鼠模型,探讨藤茶总黄酮对肝纤维化的影响。二氢杨梅素能够促进细胞自噬、减轻肾脏纤维化,从而有效改善糖尿病肾病的发生发展[13];二氢杨梅素还能改善非酒精性脂肪性肝炎的脂肪变性、炎症和纤维化[14];此外,二氢杨梅素能通过改变脂质代谢、促进乙醇代谢发挥肝脏保护作用[15]。本实验HE和Masson染色结果显示,藤茶总黄酮可改善肝纤维化小鼠肝脏病理学变化,减轻纤维化程度,rhTGF-β1能加重肝脏病理学变化和纤维化程度;肝脏指数结果表明,藤茶总黄酮可降低肝纤维化小鼠肝指数,而rhTGF-β1可增加肝指数。ALT和AST是临床上用于评估肝脏损伤的常用指标[16]。本研究结果显示,模型组小鼠血清ALT、AST活性均明显高于对照组,藤茶总黄酮治疗后ALT、AST活性均明显降低,rhTGF-β1激活TGF-β/Smad信号通路后,ALT、AST活性高于模型组,藤茶总黄酮+激动剂组小鼠血清ALT、AST活性均低于激动剂组,提示藤茶总黄酮具有改善肝纤维化小鼠肝脏病理学变化、减轻纤维化程度、改善肝损伤的作用。
TGF-β1是一种重要的促纤维化因子,是TGF-β家族中的一员,广泛存在于肝脏组织。研究发现,二甲双胍可抑制TGF-β1信号通路减轻腺嘌呤诱导的肾脏纤维化,TGF-β1可上调血管生成素样蛋白2,加重退行性髓核细胞的炎症和纤维化[17-18]。当细胞处于某种外界刺激时,TGF-β1被激活,具有活性的TGF-β1与Ⅰ型和Ⅱ型TGF-β1受体结合,从而激活TGF-β/Smad信号通路。Smad2和Smad3作为该信号通路的下游受体蛋白被激活而发生磷酸化,磷酸化后的Smad2和Smad3蛋白与Smad4蛋白结合形成复合物。该复合物转移入细胞核,与特异性DNA连接蛋白结合,从而启动靶基因转录。Smad7是一种纤维化抑制因子,可通过结合活化的TGF-β1阻断TGF-β1与其受体结合,从而阻断该过程的信号转导[19]。研究表明,褪黑素可通过抑制TGF-β/Smad3信号通路减轻糖尿病小鼠肾脏纤维化[20]。酸浆苷D可通过阻断TGF-β/Smad信号通路降低肝星状细胞激活和肝纤维化[21]。本研究为了进一步探讨藤茶总黄酮发挥肝脏保护作用是否是通过调控TGF-β/Smad信号通路,采用rhTGF-β1激活TGF-β/Smad信号通路,并采用Western blotting法检测ColⅠ、TGF-β1、p-Smad2、Smad7蛋白表达。结果显示TGF-β/Smad信号通路被激活后,ColⅠ、TGF-β1、p-Smad2蛋白相对表达量明显升高,而Smad7蛋白相对表达量明显降低;TGF-β治疗后,ColⅠ、TGF-β1、p-Smad2蛋白相对表达量明显降低,而Smad7蛋白相对表达量明显升高,表明藤茶总黄酮能抑制TGF-β/Smad信号通路。
综上所述,藤茶总黄酮能减轻肝纤维化小鼠肝脏损伤、改善肝功能,可能作用机制为抑制TGF-β/Smad信号通路。本研究结果为临床藤茶总黄酮相关药物的研发及应用于肝纤维化早期治疗提供了实验依据。

