苏格木勒-4精油多成分-多靶点-多途径抗失眠作用机制研究*
杨 蕊,果佳霖,孙利东,白东浩,马丽杰,靳尚武
(1.内蒙古医科大学,内蒙古 呼和浩特 010000;2.鄂尔多斯市中心医院,内蒙古 鄂尔多斯 017000;3.鄂尔多斯市第四人民医院,内蒙古 鄂尔多斯 017000)
失眠,是由于多方面的因素造成心神失养或心神不安,从而导致经常不能获得正常睡眠的一种病症[1]。如果不给予适当的治疗措施,失眠会给患者带来长期的痛苦,甚至引起患者对安眠药物的依赖。为了降低西药治疗失眠的一系列副作用,有多层次、多环节、多靶点药理学作用特点的蒙药成为重要选择之一。蒙药苏格木勒-3汤为蒙医临床常用主治失眠的方剂,始载于《四部医典》[2]。本研究使用的药物是经过蒙医查干夫教授改良后的配方,名为苏格木勒-4。在原方(白豆蔻15 g,白苣胜10 g,荜菝5 g)的基础上,添加了辅助药物炒酸枣仁15 g[3]。炒酸枣仁味甘、性平,可帮助其他药材相互中和,更加协调地发挥作用,使苏格木勒-4可以作为治疗失眠、安神的良药[4-5]。本研究应用GC-MS分离鉴定苏格木勒-4精油主要化学成分,结合网络药理学的方法建立成分-靶点-失眠交互作用网络,同时通过动物实验验证苏格木勒-4对失眠相关神经递质的影响,阐明苏格木勒-4精油抗失眠有效成分和多成分、多途径、多靶点的作用机制,旨在为使用蒙药治疗失眠提供更为广泛的思路。
1 材 料
1.1 药物白豆蔻为姜科植物白豆蔻Amomum kravanh Pierre ex Gagnep和爪哇白豆蔻Amomum compactum Soland.ex Maton的果实,批号:20160801;白苣胜为菊科植物莴苣Lactuca sativa L.的种子,批号:20160401;荜茇为胡椒科(Piperaceae)胡椒属(Piper)植物荜茇Piper longum L.的干燥近成熟或成熟果穗,批号:20170101;以上3种药材均购自安徽和济堂中药饮片有限公司。酸枣仁是鼠李科植物酸枣Ziziphus jujuba Mill.var.spinosa(Bunge)Hu ex H.F.Chow的干燥成熟种子(批号:20110103,安国市广济堂药业有限责任公司);安神补脑口服液(批号:1611232,吉林敖东延边药业股份有限公司);对氯苯丙氨酸(PCPA)(批号:SHBH7873,美国Sigma-Aldrich公司)。
1.2 仪器与试剂30目标准检验筛(绍兴市上虞华丰五金仪器有限公司);DT-200电子天平、DZKW-S-8电热恒温水浴锅、FZ102微型植物试样粉碎机、DZTW型500ml调温电热套、DZF-2B真空干燥(北京市永光明医疗仪器有限公司);GCMSQP2010UItra型气相色谱质谱联用仪(日本岛津);R-215型旋转蒸发仪(瑞士Buchi公司);二氯甲烷(分析纯,国药集团化学试剂有限公司);无水硫酸钠(天津市北联精细化学品开发有限公司)。
5-羟色胺对照品(5-HT)(批号:SLBP9361V)、γ-氨基丁酸对照品(GABA)(批号:BCBN3020V)、多巴胺对照品(DA)(批号:BCBV2562)和内标3,4-二羟基苯甲酸(DHBA)(批号:MKBS7646V)均购自美国Sigma-Aldrich公司。
1.3 数据库与软件中药药理学平台TCMSP数据库(http://tcmspw.com/tcmsp.php);Uniprot数据库(https://www.uniprot.org);GeneCards数据库(https://www.genecards.org);Venny 2.1作图平台;Cytoscape软件;STRING平台(https://string-db.org);R语言;PDB数据库(https://www.rcsb.org);PubChem数据库(https://pubchem.ncbi.nlm.nih.gov);PyMOL软件、ChemBio3D及AutoDock vina软件。
1.4 实验动物SPF级健康雄性ICR小鼠40只,体质量18~22 g,由斯贝福(北京)生物技术有限公司提供,动物生产许可证号:SCXK(京)2016-0002。小鼠饲养在室内温度(22±2)℃、相对湿度(50±10)%的动物实验室内,自然光照,昼夜交替,自由摄食饮水,实验结束后脱颈处死全部小鼠。动物实验经内蒙古医科大学伦理委员会批准,该实验所有动物操作均符合动物实验伦理要求。
2 方 法
2.1 样品的制备
2.1.1 苏格木勒-4精油的提取 将4种药物分别用粉碎机粉碎,过30目筛,备用。称取1剂苏格木勒-4(白豆蔻15 g,白苣胜10 g,荜茇5 g,炒酸枣仁15 g),加入360 mL去离子水,置于圆底烧瓶中,浸泡1 h。连接同时蒸馏萃取装置,使用电热套加热使料液持续沸腾,另一个烧瓶中加入50 mL二氯甲烷保持在45℃,连续萃取1.5 h,收集挥发油部分,缓慢加入适量无水硫酸钠,-20℃冷冻干燥过夜的溶液。
2.1.2 苏格木勒-4灌胃液的配制 称取10剂苏格木勒-4共450 g,加水4 500 mL,浸泡1 h后煮沸30 min,用纱布滤过,药渣再加水2 250 mL煮沸20 min后滤过,将两次滤液合并,用旋转蒸发仪、减压干燥器浓缩至浸膏状,得浸膏58 g。使用时用蒸馏水稀释成相应生药浓度的溶液。
2.1.3 PCPA溶液的配制 称取PCPA粉末6 g溶于生理盐水100 mL,加入两滴2%聚山梨酯-80助溶,配制成质量浓度为0.06 g/mL的混悬液。
2.2 网络药理学预测
2.2.1 精油GC-MS分析条件HP-5毛细管柱(30 mm×0.25 mm,0.25μm),载气使用氦气,样品进入毛细柱管口的温度为300℃,气体流量为1 mL/min;升温程序设置为在60℃下停留3min,依次设置5℃/min升温速度升温至120℃,10℃/min的速度升温至200℃,10℃/min升温速度至280℃,停留3 min,按照10∶1的分流比、1 μL的进样数量、1 mL/min的进样流速使样品分流进入。
在EI的电离方式下,设置200℃的离子源进行电离,以及1 482 V的倍增电压和34.6 μA发射电流,出口温度为300℃,在35~550 m/z的范围下扫描,通过NIST谱库进行检索。
2.2.2 构建蛋白相互作用关系(PPI)网络图 通过GC-MS技术获得苏格木勒-4精油成分的名称,在中药系统药理学分析平台(TCMSP)数据库依次检索,将精油中没有靶点的成分去除,得到有靶点信息的有效成分及其全部靶点名称。使用Uniprot数据库,矫正已知靶点名称。借助GeneCards数据库搜索“失眠”有关的基因和靶点蛋白。在Venny 2.1作图平台上分别输入苏格木勒-4和已知的失眠靶点,绘制韦恩图,获得药物有效成分和失眠靶点的交集。
借助Cytoscape 3.7.1软件及Network Analyzer功能,构建出有效成分、疾病、靶点之间的联系,绘制网络关系图,对苏格木勒-4精油中已知的主要成分进行系统分析。
2.2.3 构建蛋白相关作用关系(PPI)网络图 在STRING数据库中搜索药物与失眠之间共同存在靶点,以置信度分数〉0.4作为限制条件进行筛选,绘制蛋白相互作用的PPI网络,并以蛋白间的关联度排列顺序。
2.2.4 通路富集分析 在R软件中,安装运行Bioconductor软件包“org.Hs.eg.db”,将药物和失眠的共同靶点转换成entrezID形式,在R软件中安装clusterProfiler安装包,将转换后的entrezID形式输入,以P〈0.05,Q〈0.05进行基因本体论(GO)和基因百科全书(KEGG)功能的分析,将所得到的结果以条形统计图的形式输出。
2.2.5 分子对接 选取核心靶点GABRA2和度值较高的6种成分进行分子对接检验,利用PDB蛋白质数据库(http://www.pdb.org/)下载这6种蛋白质对应的晶体结构,在Autodock 4.2.6软件中进行验证分析,进行活性化合物成分与核心靶点的分子对接。
2.3 动物神经递质检测实验
2.3.1 分组、造模与给药40只ICR雄性小鼠适应性喂养7 d,将小鼠按体质量随机分为正常组、模型组、安神补脑口服液组及苏格木勒-4组,每组10只。除正常组外,其余组小鼠每天08:00:00腹腔注射PCPA混悬液,1 mL/100 g,1次/d,连续2 d,正常组小鼠腹腔注射等体积生理盐水。小鼠出现自发性活动减少,唇部黏膜发白,被毛干枯毛躁,精神不振且处于高度紧张状态,易受到外界环境的惊吓,饮水量增加伴随食欲不振等症状即提示造模成功。于第3天开始每天08∶00∶00灌胃给药,安神补脑口服液组小鼠灌胃给予安神补脑口服液,1.3 mL/100 g,苏格木勒-4组小鼠灌胃给予苏格木勒-4溶液,0.26 g/100 g(以生药含量算),正常组和模型组小鼠给予同体积的蒸馏水灌胃,1次/d,连续灌胃7 d。各组小鼠每天灌胃前均禁食不禁水12 h。
2.3.2 脑组织样品采集处理 第7天给药结束24 h后,小鼠脱颈处死,断头取脑,在冰盘上分离出大脑皮层,放入-80℃冰箱。将脑样品称重并使用组织匀浆器在冰冷的1.89%甲酸水溶液中以10 mL/g组织的浓度匀浆,4℃14 000 r/min离心40 min,取上清液稀释100倍。取离心管数支,加入稀释后的脑组织上清液45 μL并以9∶1的体积比加入内标DHBA,然后加入5 μL的标准系列液。将含有1%甲酸的乙腈(ACN)以4∶1的体积比加入到上清液中,并在4℃条件下14 000 r/min离心5 min。取上清液,过0.22 μm的滤膜后将样品转移到进样瓶中,等待进行LC-MS/MS测量。
2.3.3 色谱-质谱联用条件0.2%甲酸(A)和乙腈(B)作为流动相。梯度洗脱程序包括0~2.5 min,5%B,2.5~4 min,5%~20%B;4~7 min,20%~60%B;7~7.5 min,60%~5%B;7.5~10 min,5%B,流速:0.2 mL/min,柱温:30℃,进样量:3 μL。
电离方式为ESI+,雾化气为氮气,碰撞气为氩气,DL管温度为250℃,加热气流量为10 L/min,雾化气流量为3 L/min,加热模块温度为400℃,离子源温度为300℃,检测方式为MRM。
2.3.4 标准溶液和质量控制溶液的配制
2.3.4.1 标准品储备液的制备 分别称取5-HT、DA对照品1.0 mg,GABA对照品10 mg,各加入溶剂(1.89%甲酸-甲醇,休积比为7∶3)溶解,并分别定容至10 mL,制得0.1 mg/mL的5-HT、0.1 mg/mL的DA和1 mg/mL的GABA标准品储备液。
2.3.4.2 混合标准溶液的制备 将精密量取的标准储备液作为溶质,在容量瓶中混匀后,加溶剂(1.89%甲酸-甲醇,体积比为7∶3)定容至100 mL,制得分别为181.82、90.91、45.45、22.73、11.36、5.682、2.84 ng/mL的5-HT和DA混合标准溶液,以 及18 181.82、9 090.91、4 545.46、2 272.73、1 136.36、568.18、284.09 ng/mL的GABA的混合标准系列溶液,保存于4℃冰箱中备用。
2.3.4.3 质量控制(QC)液的制备 将适量精密量取的标准储备液作为溶质,加溶剂(1.89%甲酸-甲醇,体积比为7∶3)定容至100 mL,可以得到低、中、高3种不同浓度的溶液,用于配制QC溶液。溶液浓度分别如下:5-HT和DA均分别为181.82、45.45、5.682 ng/mL;GABA为18 181.82、4 545.46、568.18 ng/mL,保存于4℃冰箱中备用。
2.3.5 内标溶液的制备 将约10.0 mg的DHBA对照品作为溶质,溶于溶剂(1.89%甲酸-甲醇,体积比为7∶3)中后定容至10 mL,得到的内标储备液浓度约为1.0 mg/mL。加入溶剂直至适量内标储备液定容至100 mL,制得浓度为3.6 μg/mL的DHBA内标标准溶液,保存于4℃冰箱中备用。
2.3.6 统计学方法 使用SPSS 22.0软件处理实验数据,计量资料以(±s)表示。经检验数据方差齐,组间比较采用单因素方差分析(One-Way ANOVA),两两比较采用LSD检验。P〈0.05为差异有统计学意义。
3 结 果
3.1 网络药理学预测结果
3.1.1 GC-MS分析结果 根据各色谱峰相应的质谱图以相关文献进行匹配筛选。再将各色谱图进行处理,去电溶剂峰,再通过归一化的方法得出各化学成分含量较高的10个化学成分。(见图1)各成分在数据库中搜索得到108个靶点,去重复后得到39个靶点。(见表1)

表1 苏格木勒-4精油组分信息

图1 苏格木勒-4精油质谱图
3.1.2 药物精油成分-疾病共同靶点的筛选 在GeneCards数据库搜索“失眠”,共得到疾病靶点2 599个(重复除外)。利用Venny 2.1在线软件绘制成韦恩图,共得到19个共同靶点。(见图2)
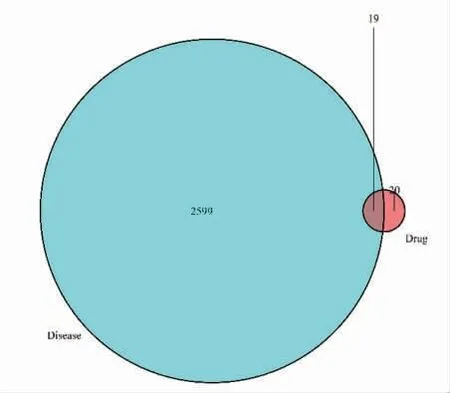
图2 苏格木勒-4精油成分靶点与失眠相关基因交集韦恩图
3.1.3 苏格木勒-4精油成分-靶点网络模型的构建 在TCMSP数据库检索苏格木勒-4精油的10种主要成分,将39个潜在靶点输入到Cytoscape软件中绘制网格,得到“药物-成分-靶点”相互作用的网络图。药物用椭圆标记,苏格木勒-4精油中的10种活性成分用菱形标记,39个靶点用长方形标记,直线表示化合物与靶点之间的相互作用关系。(见图3)

图3 苏格木勒-4精油-活性成分-靶点网络图
3.1.4 靶点PPI网络分析结果 所得PPI网络中包含19个节点和94条边。PPI网络平均Degree为4.9,度值排名前5位的是SLC6A3、GABRA2、GRIA2、GABRA1和GABRA6。(见图4)

图4 苏格木勒-4精油成分与失眠蛋白质相互作用核心网络图
3.1.5 GO富集分析R语言运行后,将19个共同靶点进行GO分析提取出生物过程、细胞组分及分子功能3个部分。结果表明,交集基因集合会汇合到54条生物学过程通路中,主要有氯离子跨膜转运活性(chloride transmembrane transporter activity)、神经递质受体的活动(neurotransmitter receptor activity)、无机阴离子转运体活性(inorganic anion transmembrane transporter activity)、参与突触后膜电位调节的神经递质受体活性(neurot ransmitter receptor activity involved in regulation of postsynaptic membrane potential)、递质门控离子通道活性(transmitter-gated ion channel activity)、突触后神经递质受体活性(postsynaptic neurotransmitter receptor activity)、细胞外配体门控离子通道活性(extracellular ligand-gated ion channel activity)、被动跨膜转运体活性(passive transmembrane transporter activity)等。(见图5)

图5 GO分析生物过程
3.1.6 KEGG富集分析 在R语言的运行下,19个药物与疾病的靶点会得到14个KEGG通路,P表示富集显著性,且颜色越红,表示显著性越强。结果表明共同靶点主要富集在神经活性配体与受体之间的相互作用(Neuroactive ligand-receptor interaction)、尼古丁成瘾(Nicotine addiction)、逆行内源性大麻素信号(Retrograde endocannabinoid signaling)、味觉转导(Taste transduction)、GABA能突触(GABA ergic synapse)、吗啡成瘾(Morphine addiction)、钙信号通路(Calcium signaling pathway)、可卡因成瘾(Cocaine addiction)、苯丙胺成瘾(Amphetamine addiction)、血小板激活(Platelet activation)、多巴胺能突触(Dopaminergic synapse)、cGMP-PKG信号通路(cGMP-PKG signaling pathway)。(见图6)
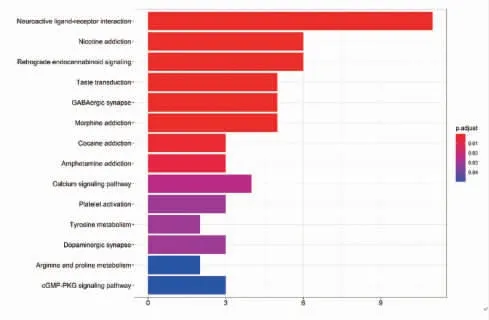
图6 KEGG通路分析
3.1.7 分子对接验证结果 使用Autodock 4.2.6软件,得到关键靶点GABRA2与苏格木勒-4精油中6个有效成分结合能。(见表2)关键靶点GABRA2与活性成分结合能≤-5.0 kcal/mol,展现出较好的结合能力,说明关键靶点与成分之间的结合力较好。将结合能为-7.2 kcal/mol的石竹烯与GABRA2靶点对接结果使用PyMOL软件进行可视化分析。(见图7)

表2 苏格木勒-4精油部分有效成分与关键靶点分子对接信息表

图7 石竹烯与GABRA2的相互作用
3.2 小鼠大脑皮层神经递质检测结果
3.2.1 线性关系考察 以各神经递质的质量浓度为横坐标,被测物与内标峰面积比为纵坐标,进行线性回归,结果见表3。
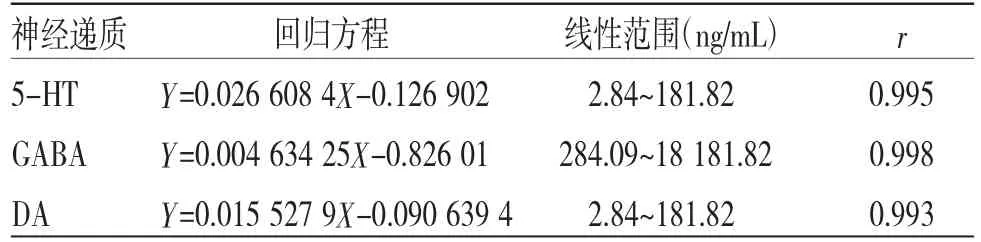
表3 4种神经递质的线性方程
3.2.2 准确度和精密度 精密量取45 μL被稀释过后的脑组织上清液,分别加入5 μL内标溶液和5 μL高、中、低3个浓度的QC溶液,配制成高、中、低3个浓度水平的样品,按照“2.3.2”项下方法进行预处理。所有浓度都要对6个样本展开分析,对本方法的精密度RSD和准确度RE进行计算,结果见表4。

表4 4种神经递质的精密度、准确度和回收率
3.2.3 稳定性 取“2.3.4”项下配制的混合对照品溶液,于4℃保存,分别在0、6、12、24 h进样分析,结果表明于4℃条件下24 h内稳定性较好。取脑样品3份,于-80℃保存,每天测定1份,比较各个神经递质在不同时间点的含量变化,表明脑样品于4℃条件下在24 h内较好,存于-80℃的样品较稳定,在3周内无明显降解。
3.2.4 各组小鼠大脑皮层5-HT、GABA、DA含量比较 与正常组比较,模型组小鼠大脑皮层DA含量明显升高(P〈0.01),5-HT、GABA含量均明显降低(P〈0.01),提示造模成功。与模型组比较,苏格木勒-4组小鼠大脑皮层DA含量明显降低(P〈0.01),5-HT、GABA的含量均明显升高(P〈0.01);与模型组比较,安神补脑口服液组小鼠大脑皮层DA含量明显降低(P〈0.01),而5-HT和GABA含量与模型组比较,差异均无统计学意义(P〉0.05)。(见表5)
表5 各组小鼠大脑皮层5-HT、GABA、DA含量比较(±s,μg/mL)

表5 各组小鼠大脑皮层5-HT、GABA、DA含量比较(±s,μg/mL)
注:与正常组比较,aP〈0.01;与模型组比较,bP〈0.01
组别 动物数(只)给药剂量 5-HT GABA DA正常组 10 - 0.409±0.063 276.841±54.019 0.421±0.050模型组 10 - 0.293±0.011a 57.352±8.003a 0.959±0.434a安神补脑口服液组10 1.30 mL/100 g 0.306±0.015 110.705±25.273 0.414±0.060b苏格木勒-4组 10 0.26 g/100 g 0.449±0.087b 568.354±92.052b 0.397±0.046b F 21.840 174.427 88.408 P 0.000 0.000 0.000
4 讨 论
蒙药具有多成分、多靶点、多途径的特点,应探索蒙药中可以代表药效的多个有效成分。本研究通过GC-MS技术确定苏格木勒-4精油中的成分,再结合网络药理学分析,为寻找苏格木勒-4精油治疗失眠的多种活性成分提供了一定的理论依据,而小鼠脑组织神经递质的检测实验进一步验证了苏格木勒-4精油治疗失眠的相关作用机制。本研究探索的10种潜在活性成分,包括β-蒎烯、桉油精、芳樟醇、4-松油醇、L-α-松油醇、乙酸松油酯、石竹烯、大牛儿烯D、β-红没药烯、乙酸橙花叔醇酯。其中,芳樟醇不仅具有缓解抑郁的作用[6],还可以镇静安眠[7]。以往的研究[8]中,已经证实芳樟醇对中枢神经系统有安抚作用,如促进睡眠、减少惊厥和降低体温等。蒎烯可以缓解压力[9]。石竹烯被认为是催眠的活性成分[10]。研究证实,薰衣草精油中乙酸松油酯有较好的助眠作用[7]。
基于网络药理学构建的苏格木勒-4精油活性成分-作用靶点网络图显示,苏格木勒-4精油治疗失眠是通过多种成分作用于多个靶点产生效应。其中GABRA1、GABRA2、PTGS2、camC、NCOA2、SLC6A2、CHRM2、GABRA6、CHRM1、GABRA5、IL-6等为主要靶蛋白。NIWA Y[11]等通过实验发现毒蕈碱乙酰胆碱受体CHRM1和CHRM3对睡眠调节至关重要,尤其是对快速眼动睡眠。而CHRM2作为毒蕈碱乙酰胆碱受体,同样可对睡眠进行调节[12]。GO分析表明苏格木勒-4精油活性成分抗失眠的作用机制主要与配体门控氯通道、神经递质受体的活动、参与突触后膜电位调节的神经递质受体活性、递质门控离子通道活性、突触后神经递质受体活性等多个生物过程有关。KEGG分析通路显示,苏格木勒-4精油活性成分通过调控神经活性配体-受体相互作用、尼古丁成瘾、逆行内源性大麻素信号、味觉转导、GABA能突触、多巴胺能突触、钙信号通路等方法来治疗失眠的症状。神经活性配体-受体相互作用通路中受体与配体之间相互作用信号和神经功能相关,该通路与神经递质传递在失眠的治疗过程中发挥着重要的作用[13-14]。共11个基因富集在该通路上(CHRM1、GABRA6、GABRA1、GABRA2、GABRA5、ADRA1A、NR3C1、GABRA3、ADRA1B、F2、GRIA2),大致可分为γ-氨基丁酸、多巴胺、肾上腺素α/β受体和乙酰胆碱类受体,是临床上常用的镇静、抗焦虑及抗惊厥药物的靶受体。其中GABRA1、GABRA2、GABRA6、GABRA5基因均编码γ-氨基丁酸(GABA)受体[15]。GABA是哺乳动物大脑中主要的抑制性神经递质,它作用于GABA-A受体,属于配体门控氯通道。这些通道的氯离子电导可以通过结合GABA-A受体的苯二氮艹卓类药物来调节。另外,分子对接发现苏格木勒-4精油中β-蒎烯、桉油精、方樟醇、4-松油醇、L-α-松油醇、石竹烯均与GABRA2有较好结合能力,而且动物实验中苏格木勒-4组小鼠大脑皮层GABA含量明显高于模型组,说明苏格木勒-4精油多个成分可以通过调控配体门控氯通道和GABA能突触通路来发挥抗失眠作用。
DA是脑内非常重要的神经递质,可以促使清醒过程的进行[16],且有动物实验证明大脑DA含量降低后可改善大鼠睡眠紊乱的症状[17]。本研究中苏格木勒-4组小鼠大脑皮层DA含量下降,故苏格木勒-4精油的抗失眠机制为下调DA含量,使觉醒减少,从而达到增加睡眠时间的效果。5-羟色胺是参与睡眠、食欲、焦虑及抑郁等生理功能活动中很重要的神经递质。研究报道,薰衣草精油中主要生物活性成分芳樟醇和乙酸松油酯[18],可以通过调控5-HT神经递质的传递发挥其抗焦虑作用[19]。苏格木勒-4精油中的有效成分也包括芳樟醇和乙酸松油酯,且苏格木勒-4组小鼠大脑皮层中5-HT含量增加,说明苏格木勒-4精油能通过改变大脑皮层中5-HT含量来发挥抗失眠作用。
综上所述,将GC-MS检测结果和网络药理学方法相结合,对苏格木勒-4精油的化学成分和作用机制进行预测分析,再结合小鼠大脑皮层神经递质实验可知苏格木勒-4精油中多种成分都涉及与睡眠相关的神经递质靶点。苏格木勒-4精油活性成分治疗失眠存在多成分、多靶点、多途径的复杂网络机制,为下一阶段的相关研究提供了方向与参考。

