补肾通脉方通过调控microRNA-126-3p对血管内皮损伤的保护作用*
陈宏昱,程 红,庄震坤,徐 翀,刘树楷,赵海梅,彭少林,燕竹青,陈颖颖,焦萁荟,程 晶
(广州中医药大学第四临床医学院/深圳市中医院,广东 深圳 518033)
动脉粥样硬化(atherosclerosis,AS)一直是心血管疾病发生发展的主要原因,亦是其防治的关键。由AS所致的临床疾病主要包括缺血性心脏病、缺血性中风和周围动脉硬化等,这些疾病都有很高的致残率、致死率。截至2019年,我国心血管病患病人数达3.3亿,其中脑卒中1 300万、冠心病1 100万[1]。基于AS复杂的发病机制,从20世纪50年代至今涌现出多种相关假说,包括脂质浸润学说、损伤-反应学说、内皮功能学说、炎症反应学说、氧化学说、剪切应力学说等,这些假说基本明确了炎症、脂肪、血流异常、内皮细胞等作为媒介在AS过程中的重要作用,为进一步研究AS的病理机制奠定了基础。目前治疗AS的药物主要有他汀类的调脂药,以阿司匹林为主的抗血小板聚集药,通过降低心率-血压乘积进而减缓AS进程的β受体阻滞剂,以及抑制血管内皮增生的血管紧张素转换酶抑制剂及其受体拮抗剂,但药物的禁忌证、副作用及患者依从性使得治疗存在一定局限性;非药物治疗有动脉内膜切除术、动脉内支架植入术及经皮动脉腔内血管成形术,因手术的创伤性及其一定比例的再狭窄率使其应用受到限制[2]。近几年AS相关microRNA(miRNA)领域的研究飞速发展,从基因层面揭露了AS的发生发展过程。研究发现miRNA作为细胞黏附、增殖,脂质摄取和流出,以及炎症介质的产生等病理生理过程的重要调节因子,可以直接或间接调节内皮细胞功能、炎症反应和脂质代谢,以发挥延缓AS进程的作用[3-4]。
miRNA-126是一种内皮细胞特异性miRNA,是在内皮细胞分化过程中和成年内皮细胞中表达最多的miRNA之一[5]。在维持血管完整性和调节血管生成方面,miRNA-126能够直接靶向某种蛋白或调节因子,激活相关分子途径以发挥抗AS的作用。研究表明,HUVEC凋亡小体中过表达的miRNA-126-3p靶向祖细胞动员的负调节因子G蛋白信号调节因子16(Regulator of G-protein signaling 16,RGS16)可以诱导趋化因子(C-X-C基序)配体12[chemokine(C-X-C motif)ligand 12,CXCL12]表达,通过促进具有内皮祖细胞功能的lin-Sca-1+祖细胞募集,以加速内皮修复的方式抑制AS进展[6-7]。miRNA-126-3p作为miRNA-126的主要客链,在AS进展中发挥着至关重要的作用,故本研究尝试以miRNA-126-3p为主要对象以阐明补肾通脉方对miRNA-126的调控作用。
1 材 料
1.1 实验动物10周龄普通级健康雄性新西兰大白兔15只,体质量2.0~2.5 kg,购自广东省医学实验动物中心,动物许可证号:SCXK(粤)2019-0035,正式实验开展前适应性饲养7 d,饲养条件为温度(23±2)℃,湿度(50±10)%,自由摄食水。本实验中新西兰大白兔均由耳缘静脉注射空气致死,实验操作符合一般动物实验伦理学原则,经医学实验动物管理委员会批准。
1.2 药物与试剂补肾通脉方,方药组成:附子15 g,桂枝15 g,酒苁蓉30 g,川芎20 g,三七10 g,麦冬15 g,陈皮10 g,熟地黄10 g,石菖蒲15 g,制天南星10 g,人参30 g。上述中药均来源于深圳市中医院药剂科,药剂科主任审核鉴定后由医院煎药房煎煮成汤剂。氨基甲酸乙酯(乌拉坦,批号:H20130609)购自上海沪试实验室器材股份有限公司;阿托伐他汀(立普妥,批号:H20051408)购自美国辉瑞制药有限公司;TRIzol Reagent(货号:15596-018)购自广州创融生物科技有限公司;人源氧化低密度脂蛋白(oxidized low density lipoprotein,ox-LDL)(货号:OX-LDL-01)购自北京华力德科技有限公司;RIPA裂解液(货号:P0013B)购自广州继科生物科技有限公司;0.1%Ⅰ型胶原酶(货号:AAPR531-A)购自广州沛瑜生物制品有限公司;胰蛋白酶(货号:T6325-100g)购自上海麦克林生化科技有限公司;PrimeScript RT Master Mix(货号:RR036A)购自广州天骏生物科技有限公司;逆转录试剂盒(货号:RBWG5-100T)购自广州一科生物科技有限公司;2×SYBR Green qPCR Mix(货号:SL2690-1mL)购自深圳市文乐生物科技有限公司;CD31抗体(货号:ab28364)购自广州维德昕生物科技有限公司;山羊抗兔IgG H&L(货号:ab150077)购自宝如亿(北京)生物技术有限公司。
1.3 主要仪器H1M型多功能微孔板检测仪(广州达瑞生物技术股份有限公司);5810R型台式大容量冷冻离心机(广州金锋生物科技有限公司);ME203E型电子天平[梅特勒-托利多仪器(上海)有限公司];371型二氧化碳培养箱[赛默飞世尔科技(中国)有限公司];Ts2R倒置显微镜(北京中实天工仪器设备有限公司);FQD-96A型荧光定量PCR仪(济南鑫贝西生物技术有限公司)。
2 方 法
2.1 补肾通脉方及阿托伐他汀含药血清的制备将15只新西兰大白兔随机分为补肾通脉方组、阿托伐他汀组及正常组,每组5只;补肾通脉方组和阿托伐他汀组每只兔分别给予30 mL补肾通脉方汤剂、30 mL阿托伐他汀溶液(按0.8 mg/kg给药)进行灌胃,1次/d,灌胃7 d,在末次给药2 h后采血;正常组兔正常进食水,7 d后采血;腹腔注射20%乌拉坦溶液(按1.2 g/kg给药)对兔进行麻醉,观察兔活动度,待兔失去疼痛反射后解剖,充分暴露腹主动脉后采血;所得血液标本静置于37℃环境中,3 000 r/min离心15 min,无菌条件下使用移液器分离血清,分装后保存于-20℃环境中备用。
2.2 人脐静脉内皮细胞(human umbilical vein endothelial cells,HUVEC)培养获取健康剖腹产新生婴儿脐带(已签署知情同意书),立即在室温下用浓度为0.1%的Ⅰ型胶原酶消化,1 h后得血管内皮细胞,置于5%CO2、37℃、饱和湿度的培养箱进行原代培养,培养基采用含有10%胎牛血清的M199培养基(50 μg/mL肝素钠、2 mmol/L谷氨酰胺、10 U/mL贝复济、50 U/mL庆大霉素、100 U/mL青霉素),定期更换培养液,并在倒置显微镜下观察原代及传代细胞的形态特点。
2.3 HUVEC鉴定将已培养完成的HUVEC接入铺有盖玻片的六孔板内,24 h后,观察细胞融合情况,细胞融合至70%左右时开始染色;HUVEC经过固定、透化和封闭,加入CD31抗体,后于4℃条件下孵育12 h;次日经PBS漂洗后加入荧光二抗,室温孵育1 h;重复上述操作,共漂洗3次,并在最后一次漂洗时加入核染料DAPI,再加入10~20 μL封片剂封片;最后镜下观察拍照。
2.4 ox-LDL干预HUVEC建立内皮细胞损伤模型在96孔板中配置100 μL的HUVEC细胞悬液,将培养板置于37℃,5%CO2培养箱中预培养。24 h后向培养板加入10 μL不同质量浓度(10、50、100 μg/mL)的ox-LDL,将培养板置于培养箱孵育24 h,然后向每孔加入10 μL CCK8溶液,将培养板在培养箱内继续孵育4 h,用酶标仪测定各组细胞在450 nm处的吸光度,了解细胞活性;选定ox-LDL作用浓度。以同样的方法选定合适的作用时间,最终以合适的ox-LDL作用浓度及作用时间干预HUVEC建立内皮细胞损伤模型。
2.5 分组及含药血清干预在ox-LDL诱导内皮细胞损伤模型建立中,将HUVEC分为8组:正常对照组,损伤对照组,补肾通脉方5%、10%、15%浓度组,阿托伐他汀5%、10%、15%浓度组。正常对照组予正常兔血清干预;在细胞损伤模型建立完成后,损伤对照组予正常兔血清干预,补肾通脉方组及阿托伐他汀组予不同浓度的含药血清干预,含药血清浓度设定为补肾通脉方5%、10%、15%及阿托伐他汀5%、10%、15%。24 h后用CCK-8法检测各组细胞活性。
2.6 qPCR检测HUVEC中miRNA-126-3p的表达分别收集正常对照组、损伤对照组、补肾通脉方10%浓度组和阿托伐他汀组细胞,经PBS漂洗3次,加入Trizol裂解液。分离提取总miRNA,逆转录获得cDNA,再以cDNA为模板,采用SYBR Green染料法相对定量qPCR实验;所采用反应条件:94℃预变性2 min,94℃5 s、60℃30 s共40个循环,72℃10 min,最后以2-ΔΔCt法(Livak法)计算miRNA-126-3p相对表达量,每组实验均进行3次。引物序列详见表1。
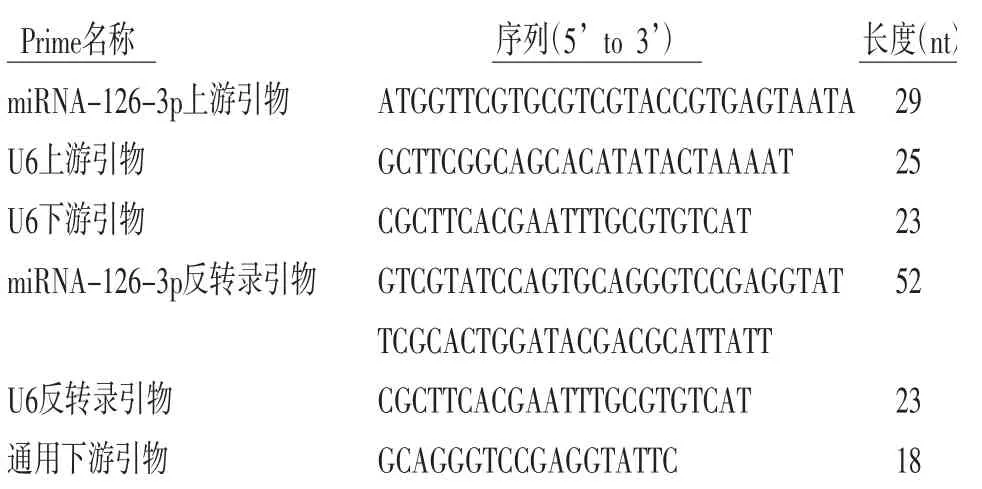
表1 qPCR引物序列
2.7 统计学方法采用SPSS 26.0统计学软件进行数据分析。计量资料以“均数±标准差”(±s)表示,组间比较采用单因素方差分析,两两比较用LSD-t检验,P〈0.05为差异有统计学意义。
3 结 果
3.1 HUVEC培养光镜下可见大量3~4个成团的内皮细胞。细胞接种后4 h开始贴壁生长,5 d左右可融合成片,原代细胞呈小三角形、圆形或梭形,细胞分布不均匀,成簇生长互不重叠。(见图1)
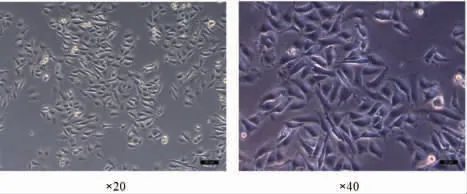
图1 光镜下观察HUVEC细胞形态
3.2 HUVEC鉴定免疫荧光结果显示所有HUVEC细胞均表达CD31,表明本实验分离培养的HUVEC细胞纯度较高。(见图2)
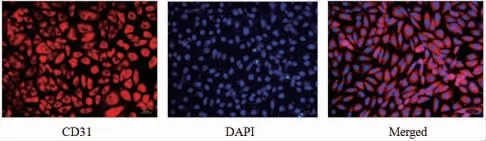
图2 CD31免疫荧光染色HUVEC细胞
3.3 ox-LDL作用浓度及作用时间对细胞活性的影响以ox-LDL作用24 h为条件,ox-LDL干预质量浓度为10、50、100 μg/mL时,细胞活性均有下降。与正常对照组比较,10、50 μg/mL组细胞活性下降不明显,差异无统计学意义(P〉0.05);100 μg/mL组细胞活性下降至正常对照组的47%,差异有统计学意义(P〈0.05)。(见图3A)选定ox-LDL作用质量浓度为50 μg/mL,ox-LDL干预时间分别为12、24、48 h,细胞活性均有下降。与正常对照组比较,干预12、24 h组细胞活性下降不明显,差异无统计学意义(P〉0.05);48 h组细胞活性下降至正常对照组的53%,差异有统计学意义(P〈0.05)。(见图3B)综上,质量浓度为50 μg/mL的ox-LDL作用24 h为最适合的实验条件。
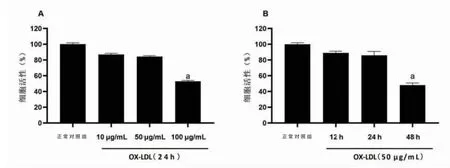
图3 ox-LDL作用浓度及作用时间对细胞活性的影响(±s,n=6)
3.4 补肾通脉方及阿托伐他汀对ox-LDL内皮细胞损伤的保护作用与正常对照组比较,损伤对照组、补肾通脉方5%浓度组、补肾通脉方15%浓度组、阿托伐他汀5%浓度组及阿托伐他汀15%浓度组细胞活性均明显降低(P〈0.05);与损伤对照组比较,补肾通脉方5%、10%、15%浓度组及阿托伐他汀10%、15%浓度组细胞活性均明显升高(P〈0.05);与补肾通脉方10%浓度组比较,补肾通脉方5%、15%浓度组细胞活性均明显降低(P〈0.05);与阿托伐他汀10%浓度组比较,阿托伐他汀5%、15%浓度组细胞活性均明显降低(P〈0.05)。表明补肾通脉方对ox-LDL内皮细胞损伤具有保护作用。(见图4)
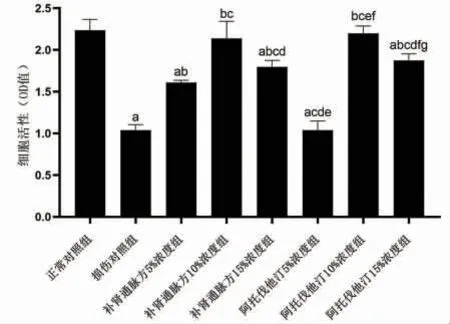
图4 各组细胞活性水平比较(±s,n=8)
3.5 各组HUVEC细胞中miRNA-126-3p相对表达量比较与正常对照组比较,阿托伐他汀组HUVEC细胞中miRNA-126-3p相对表达量明显上调,差异有统计学意义(P〈0.05);与损伤对照组比较,补肾通脉方组及阿托伐他汀组HUVEC细胞中miRNA-126-3p相对表达量均明显上调,差异有统计学意义(P〈0.05);补肾通脉方组HUVEC细胞中miRNA-126-3p的相对表达量与阿托伐他汀组比较,差异无统计学意义(P〉0.05)。(见图5)
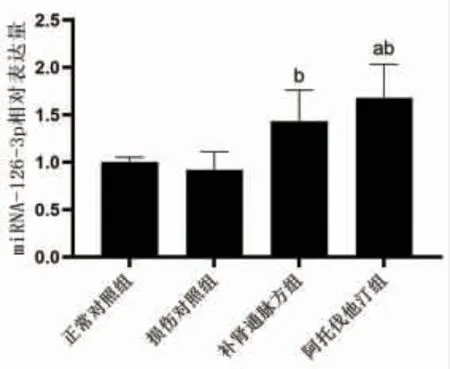
图5 各组HUVEC细胞中miRNA-126-3p相对表达量比较(±s,n=3)
4 讨 论
本研究通过体外实验已证实补肾通脉方对ox-LDL诱导的内皮细胞损伤具有保护作用,并能上调miRNA-126-3p的表达。中医学以“以证定法,以法选方”为基本原则,动脉粥样硬化以肾气亏虚、痰瘀互结为基本证型。肾阳亏虚,则鼓动无力,津液运行迟缓,布散失常,聚留而成痰瘀,与血液轴流失常的病理状态相似,并逐步发展为炎症细胞浸润、内皮损伤等病理阶段;肾阴不足,濡润失司,津液化生乏源,则津枯血少,结为痰瘀,此过程与血管内皮损伤后炎症细胞浸润类似,最后发展为动脉粥样硬化。故自拟方药“补肾通脉方”以奏补肾益气、活血化瘀之功,发挥内皮保护功能而起到预防作用。该方中用附子、桂枝温肾助阳,徐生肾气,桂枝以通为主,附子以补为要,一通一补,使阳气充沛,肾气得充;人参为补气之要药,气为血之帅,气充才能鼓动脉道内的血液运行周身,与熟地黄相配,使阴中有阳,助生精血;熟地黄补血滋阴,益精填髓。《本草纲目》有云:“填骨髓,长肌肉,生精血,补五脏内伤不足,通血脉,利耳目,黑须发。”熟地黄兼有补益和通利血脉两种功效;肉苁蓉归肾经,专补肾中水火,与熟地黄为伍可增强温肾阳、益精血之功;川芎善行散,走而不守,上至巅顶,下至血海,活血祛瘀之力强,三七尤其擅长活血、止血,但补虚强壮亦能彰显其特点,正如《本草纲目拾遗》中记载:“人参补气第一,三七补血第一,味同而功亦等,故称人参三七,为中药中之最珍贵者。”川芎、三七两药配伍一者可补血润脉,二者可活血通脉;麦冬养阴生津,与人参相伍,一补一润,则益气养阴之功益彰;陈皮理气健脾,使全方补而不滞;石菖蒲、制天南星燥湿化痰,使痰瘀得散。各药相配,旨在补肾活血化痰。大量临床研究已经证实了以补肾、活血为首要原则的中药处方治疗动脉粥样硬化的有效性[8-9]。王信林等[10]研究表明人参皂苷Rg1对载脂蛋白E基因敲除小鼠的主动脉动脉粥样硬化具有较好的抑制作用,其作用机制可能为抑制核因子-κB(NF-κB)信号通路异常活化而阻止巨噬细胞向促炎型巨噬细胞转化,抑制炎症细胞浸润,从而通过抑制炎症反应发挥内皮保护作用。孙晓晶等[11]采用人参皂苷Rb1干预缺血性脑卒中大鼠模型,结果表明,实验组中胞内磷脂酰肌醇激酶(phosphatidylinositide 3-kinases,PI3K)与蛋白激酶B(protein kinase B,Akt)的表达上调。行为学评分、水迷宫实验显示,人参皂苷Rb1对缺血性脑卒中大鼠模型脑组织具有保护作用,其机制可能与调控PI3K/AKT信号通路相关。该通路与细胞增殖、凋亡密切相关,可通过促进内皮修复的直接方式保护内皮细胞。亦有相关实验证明了三七、川芎、附子、桂枝、肉苁蓉的内皮保护特性[12-14]。就整体方药而言,本课题组前期研究应用该方治疗颈动脉粥样硬化患者,结果提示补肾通脉方能够发挥抗动脉粥样硬化作用,其作用效果与阿托伐他汀组无明显差别[15];体外实验表明,补肾通脉方可上调抑制凋亡基因B淋巴细胞瘤-2(B-cell lymphoma-2,Bcl-2)的表达,降低促凋亡基因半胱氨酸天冬氨酸蛋白酶3(Caspase-3)的表达活性,减少内皮细胞的凋亡数,抑制细胞凋亡发挥内皮细胞保护作用,此过程可能与补肾通脉方上调miRNA-126-3p的表达有关[16];同时,该方还能下调基质金属蛋白酶2(matrix metalloproteinases-2,MMP2),上调金属蛋白酶2组织抑制因子(tissue inhibitor of metalloproteinase 2,TIMP-2)在兔动脉粥样硬化模型斑块内的表达,而MMP2作为分解斑块内基质的主要蛋白,其表达水平的下降能有效稳定动脉粥样硬化斑块、抑制动脉粥样硬化进展[17-18]。所以补肾通脉方不仅能够在动脉粥样硬化初期阶段保护损伤的内皮细胞,在动脉粥样硬化进展期也能够有效稳定斑块,进而延缓动脉粥样硬化的进一步发展。
通过与给定靶标mRNA的3'非翻译区结合,miRNA在转录后可调节基因表达模式,进而调控蛋白质的表达水平以达到影响动脉粥样硬化发展过程的作用[19-21]。近几年,有一些研究已经明确了有关miRNA在炎症激活、细胞增殖和内皮细胞再生中的调节作用[22-23]。miRNA-126-3p防治动脉粥样硬化的作用机理较为复杂,在多个方面均有论证。QU Q X[24]等通过细胞实验研究证明miRNA-126-3p能促进HUVECs增殖、迁移和成管作用,并在之后的动物试验中建立大鼠静脉动脉化模型,结果分析显示,用miRNA-126-3p修饰的人脐带间充质干细胞移植治疗的组别具有更高的静脉再内皮化,并可以显著减少大鼠移植血管内膜增生。此作用机制可能与SPRED-1(sprouty related EVH1 domain containing 1,SPRED-1)/PI3K/AKT/ERK1/2信号通路有关。该信号通路与细胞增殖、迁移密切相关,能加速病变血管的内皮修复。高水平的促炎性细胞因子一直被认为是动脉粥样硬化疾病发展及并发症发生的危险因素。OHTA M等[25]通过研究发现炎症因子白细胞介素-6(IL-6)能够抑制人脐静脉细胞融合细胞中miRNA-126-3p的表达水平,加速内皮细胞炎症反应,其作用机制可能与调控细胞间黏附分子1(ICAM-1),促进单核细胞向内皮细胞迁移有关。除了脂质聚集所致的内皮损伤之外,大量单核细胞黏附于内皮细胞表面也是动脉粥样硬化前期进展的关键因素之一。IL-6可通过下调miRNA-126-3p的表达水平促进ICAM-1表达,进而导致动脉粥样硬化进展。另外,细胞自噬作为机体自我更新的保护机制,对于抗细胞衰老及凋亡至关重要。研究表明,ox-LDL诱导的HUVEC自噬通量下调,而miRNA-126的干预能够逆转此过程、挽救自噬通量,以减少HUVEC中的细胞损伤及细胞凋亡,此过程可能与PI3K/AKT/mTOR通路有关,但具体客链尚未明确[26],这也值得研究者深入探索。这些研究确定了miRNA-126-3p无论是调控内皮细胞增殖和迁移、抑制炎症反应,还是抗细胞衰老及凋亡,均能够发挥延缓动脉粥样硬化进展的作用,这与补肾通脉方的内皮保护机制相契合。
本实验通过体外实验观察补肾通脉方对miRNA-126-3p的调控作用,尝试从基因层面阐释补肾通脉方对动脉粥样硬化中内皮损伤的保护作用。结果显示,在补肾通脉方含药血清的作用下,ox-LDL诱导的HUVEC损伤模型细胞活性明显升高。与损伤对照组比较,5%、10%、15%浓度补肾通脉方均能挽救细胞活性;10%浓度的作用最明显,且补肾通脉方10%浓度组细胞活性与正常对照组比较,差异无统计学意义(P〉0.05)。同时,与损伤对照组比较,补肾通脉方含药血清能明显提高HUVEC中miRNA-126-3p的表达水平,且补肾通脉方组HUVEC中miRNA-126-3p表达水平与阿托伐他汀组比较,差异无统计学意义(P〉0.05)。综上所述,补肾通脉方能够上调miRNA-126-3p的表达以发挥内皮保护作用,进而延缓动脉粥样硬化进展。

