NaCl对兔肉蛋白质氧化的影响
何琪,董怡,邓莎,向燕,何培君,何强
(四川大学 轻工科学与工程学院,成都 610065)
兔肉是一种健康又经济的肉类,含有丰富的多不饱和脂肪酸、蛋白质、必需氨基酸等营养成分,蛋白质含量高达70%,具有低脂肪、低热量、低胆固醇的特点[1-2]。基于以上优点,兔肉产品在近十年来得到了迅速的发展,受到消费者的青睐。
腌制是肉类及肉制品加工和保鲜中广泛使用的一种方法,具有提高肉质风味、嫩化等作用[3]。NaCl是腌制肉的基础用料,能够赋予肉制品更好的口感;提高肉制品的保藏性。在肉制品中添加盐还可以提高肉的保水能力,提高肉制品的风味,抑制有害微生物的生长和繁殖[4]。然而,在腌制过程中还会发生氧化和蛋白质变性等化学反应,肉品腌制过程中发生的脂质和蛋白质氧化反应是导致肉及肉制品劣变的主要非微生物因素[5]。兔肉因富含不饱和脂肪酸容易发生氧化反应,添加NaCl也会促进脂肪氧化,脂质氧化的次级产物进一步与蛋白质、多肽和氨基酸发生反应,促进蛋白质氧化,从而破坏其功能特性,肉制品的营养价值降低[6]。
兔肉的氧化程度会影响其保质期,并受兔肉的内在性质和外部因素的影响。在肉制品生产加工过程中,绞碎、腌制、烹饪等步骤会促使活性氧(ROS)的产生,ROS能够攻击蛋白质发生一系列链式反应,从而诱导蛋白质氧化,修饰其骨架和侧链,导致蛋白质结构和功能的改变[7]。肉制品蛋白质结构的改变会影响氨基酸的利用率,较温和的氧化过程使得蛋白质结构展开,蛋白水解酶可以与底物结合,然而严重的氧化过程会使蛋白质聚合,结构更加紧密,从而导致结合位点的改变,降低蛋白水解酶的作用效果[8]。蛋白质氧化会影响肉制品的质地、口感、风味、可接受度和营养价值,因此控制好蛋白质氧化程度才能让产品质量保持在较好的水平。
目前关于兔肉蛋白质氧化与NaCl之间的关系研究较少,本实验以兔肉作为研究对象,通过添加不同质量浓度的NaCl对兔肉进行腌制处理,进一步探究NaCl对腌制过程中兔肉蛋白质氧化的影响,为提高腌制兔肉的品质、延长产品贮藏期提供了相关理论参考。
1 材料与方法
1.1 材料与试剂
新鲜兔肉购自四川省成都市当地市场,平均质量约1.7 kg,取兔后腿作为实验材料。
NaCl、磷酸氢二钠、磷酸二氢钠、盐酸、2,4-二硝基苯肼、三氯乙酸、无水乙醇、乙酸乙酯、尿素、2-硝基苯甲酸、氯化镁、乙二胺四乙酸二钠、溴酚蓝:均为分析纯,成都市科龙化工试剂厂;牛血清蛋白:生化试剂,上海如吉生物科技有限公司。
1.2 仪器与设备
SQP电子分析天平 赛多利斯科学仪器(北京)有限公司;1736R高速冷冻离心机 ScanSpeed公司;JRJ300-D-1匀浆机 上海沪析实业有限公司;HH-1A恒温水浴锅 北京科伟永兴仪器有限公司;SHA-C水浴振荡器 金坛市科析仪器有限公司;FiveEasy Plus pH计 德国梅特勒-托利多公司;F-7000荧光分光光度计 日本日立公司;MCR 302流变仪 奥地利安东帕(中国)有限公司;UV-6000PC 紫外可见分光光度计 上海元析仪器有限公司。
1.3 方法
1.3.1 样品处理
选取一定量兔后腿,剔骨留下肌肉部分,除去脂肪和肌膜,将兔肉切成约2 cm×3 cm×2 cm的立方体后分为6组,分别加入0%、3%、6%、9%、12%、15%的NaCl混合均匀,放入4 ℃的冰箱中腌制48 h。
1.3.2 蛋白质提取
参考Zhang等[9]的方法,并进行适当的修改。取10 g兔肉绞碎,加入40 mL磷酸盐缓冲液(PBS,pH 7.0,100 mmol/L的NaCl、2 mmol/L的MgCl2和1 mmol/L的EDTA-2Na)。然后在冰浴下以8000 r/min均质1 min,用纱布过滤后得到总的蛋白溶液。以牛血清蛋白为标准,用双缩脲法测定蛋白质的浓度。
1.3.3 羰基含量测定
参考Wang等[10]的方法,并进行适当的修改。用20 mmol/L的PBS (pH 6.0)稀释样品至5 mg/mL。从每组样品中取两份400 μL的稀释液,其中一份用800 μL含0.2% 2,4-二硝基苯肼的2 mol/L盐酸处理,另一份用800 μL的2 mol/L盐酸处理。样品在室温下反应30 min后,加入三氯乙酸(0.4 g/mL)400 μL,混合物于4 ℃离心(5000 r/min, 5 min),除去上清液。然后加入1 mL乙醇-乙酸乙酯混合液(1∶1,体积比)与沉淀物混合,随后在4 ℃、5000 r/min条件下离心5 min,重复洗涤3次。加入1.5 mL含有6 mol/L盐酸胍的PBS(20 mmol/L,pH 6.5)溶解沉淀。放置过夜后,在370 nm波长处测定吸光度,根据摩尔消光系数22000 L/(mol·cm)计算求得,公式如下:
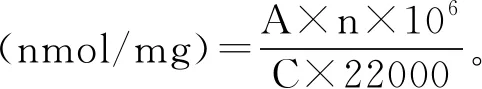
式中:A表示在370 nm波长处的吸光度值;C表示蛋白质的质量浓度,mg/mL;n表示稀释倍数。
1.3.4 巯基含量测定
参考Wang等的方法,并进行适当的修改。用PBS(20 mmol/L,pH 6.0)稀释样品至5 mg/mL。取1 mL样品溶液,用9 mL PBS(50 mmol/L,pH 7.0,含8 mol/L尿素,0.6 mol/L NaCl,0.01 mol/L EDTA-2Na)稀释。然后取3 mL稀释后的溶液与0.4 mL 0.1%的2-硝基苯甲酸混合,在40 ℃下避光静置25 min。冷却至室温后在412 nm波长处测量吸光度,巯基含量计算公式如下:
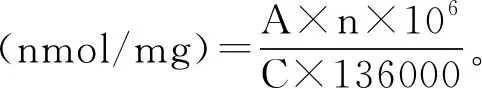
式中:A表示在412 nm波长处的吸光度值;C表示蛋白质的质量浓度,mg/mL;n表示稀释倍数。
1.3.5 表面疏水性测定
参考Zhang等的方法,并进行适当的修改。用PBS(20 mmol/L,pH 6.0)稀释样品至5 mg/mL。将1 mL稀释液与0.2 mL溴酚蓝溶液(BPB,1 mg/mL)混合。对照组加入PBS 1 mL,BPB溶液0.2 mL。所有样品于25 ℃摇匀10 min,然后于4 ℃、2000×g离心15 min。离心后取上清液0.4 mL,加入PBS(20 mmol/L, pH 6.0)3.6 mL稀释,在595 nm处测定吸光度。蛋白表面疏水性的计算公式如下:
1.3.6 紫外吸收光谱测定
参考Wang等[11]的方法。用 PBS(20 mmol/L,pH 6.0)稀释样品至0.5 mg/mL,在室温下记录230~320 nm稀释溶液的吸收光谱。PBS(20 mmol/L,pH 6.0)为空白。
1.3.7 内源荧光光谱测定
参考Wang等的方法。用20 mmol/L的PBS(pH 6.0)稀释样品至0.5 mg/mL,使用荧光分光光度计在激发波长为295 nm的条件下,记录在300~400 nm之间的发射光谱,电压为700 V。
1.3.8 流变学特性测定
将样品稀释至15 mg/mL,测定其流变学特性。流变仪的测定条件:测试温度25 ℃,频率0.1 Hz,剪切速率0.1~100 s-1。
1.4 数据处理
实验数据的方差分析采用SPSS 26.0软件进行,显著性分析采用Duncan's多重比较,在p<0.05时为差异显著,使用Origin 2021软件进行绘图。所有实验重复3次,样品至少设置3组重复。
2 结果与讨论
2.1 NaCl对蛋白质巯基和羰基含量的影响
巯基含量是评判蛋白质氧化程度的重要指标,蛋白质氧化程度越高,巯基含量越少。羰基是蛋白质氧化的另一重要生成物,也可以反映蛋白质的氧化程度[12]。NaCl对兔肉蛋白质羰基和巯基含量的影响见图1。
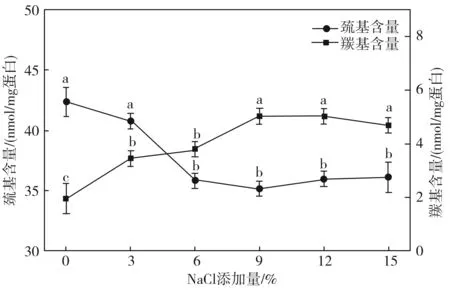
图1 NaCl添加量对兔肉蛋白质巯基和羰基含量的影响
由图1可知,未加NaCl的兔肉蛋白巯基含量最高,而添加NaCl后,兔肉蛋白中巯基的含量显著下降(p<0.05),下降了约20%。随着NaCl添加量的增加,兔肉蛋白中羰基含量显著上升(p<0.05),最大值达到5.03 nmol/mg,这与Zhao等[13]结果保持一致,NaCl能够显著促进蛋白质的氧化,加速兔肉蛋白质中巯基的损失和羰基的形成。兔肉蛋白质巯基含量下降的原因是半胱氨酸中巯基基团氧化转化为二硫键和半胱氨酸含氧酸,二硫键的形成会导致蛋白质分子间或分子内的交联[14]。同时,兔肉在腌制后会释放一些血红素,从而促进过渡金属如Fe2+、Fe3+参与反应,蛋白质则可以通过金属催化氧化(MCO)途径形成ROS进一步羰基化。由于链式反应的活化能较高,反应开始较慢,随后蛋白质迅速氧化,并在精氨酸、赖氨酸、脯氨酸和苏氨酸的侧链产生羰基[15]。脂质氧化产物与蛋白质形成的加合物也可形成蛋白质羰基化,如丙二醛、4-羟基壬烯醛等。
2.2 NaCl对蛋白质表面疏水性的影响
蛋白质能够维持三级结构的要素是疏水基团之间存在一种非共价键作用力,绝大多数非极性氨基酸侧链都隐藏在蛋白质内部,而部分非极性基团会暴露在蛋白质分子表面,具有疏水性[16]。溴酚蓝与蛋白质分子表现出良好的疏水相互作用,通过二者的结合量可以反映蛋白质的构象变化,以此判断氧化变性程度[17]。NaCl对兔肉蛋白质表面疏水性的影响见图2。

图2 NaCl添加量对兔肉蛋白质表面疏水性的影响
由图2可知,不添加NaCl的兔肉组别表面疏水性最弱,仅为38.76 μg,随着NaCl添加量的增加,蛋白质表面疏水性显著增强(p<0.05),而在NaCl添加量为9%以上时蛋白质表面疏水性增加的不明显(p>0.05)。NaCl添加量为9%以下时,NaCl破坏了蛋白质亲水基团和疏水基团的平衡,蛋白质三级结构展开,构象发生剧烈的改变,隐藏在蛋白质内部的疏水基团暴露出来,所以蛋白质的表面疏水作用显著增强[18]。随着NaCl添加量的进一步增加,兔肉蛋白疏水性变化不显著,可能是高盐抑制了蛋白质的疏水和二硫键作用,也可能是过度氧化导致蛋白质通过疏水相互作用发生聚集,使得表面疏水性的增加有所减弱。
2.3 NaCl对蛋白质紫外吸收光谱的影响
蛋白质中含有芳香环结构的氨基酸,如苯丙氨酸、酪氨酸和色氨酸残基具有紫外吸收特性,所以紫外吸收光谱可以反映芳香族氨基酸侧链的变化,从而揭示蛋白质的构象变化。不同NaCl添加量下兔肉蛋白质的紫外吸收光谱见图3。

图3 NaCl添加量对兔肉蛋白质紫外吸收光谱的影响
由图3可知,经过不同添加量NaCl腌制处理后,兔肉蛋白质紫外吸收光谱趋势相似,都在280 nm处出现了峰的拐点。由此可知,NaCl对兔肉蛋白质有促氧化作用,但是氧化不会改变蛋白质的整体结构,随着NaCl添加量的增加,蛋白质的吸收峰轻微下降。Zhang等研究发现,蛋白质的最大紫外吸收峰随着氧化强度的增大而减小,这是因为蛋白质表面酪氨酸和色氨酸残基的氧化修饰作用。酪氨酸容易被ROO·攻击,在杂原子取代物处发生氢原子提取反应,然后产生酪氨酸苯氧基,两个酪氨酸自由基发生偶联,并进一步通过共价键生成二聚酪氨酸。色氨酸残基也会发生类似的反应,从而增强分子内或分子间的蛋白质交联。
2.4 NaCl对兔肉蛋白质内源荧光强度的影响
内源荧光光谱通常用来表征蛋白质构象的变化。不同NaCl添加量下兔肉蛋白质的内源荧光强度见图4。

图4 NaCl添加量对兔肉蛋白质内源荧光强度的影响
由图4可知,添加NaCl之后,兔肉蛋白质的内源荧光强度有所降低,当NaCl添加量为9%时荧光强度最低,并发生了轻微的红移,说明NaCl有促进兔肉蛋白质氧化的作用。这可能是因为氧化会导致蛋白质结构发生变化,蛋白质空间结构展开,暴露了内部疏水结构的色氨酸残基,色氨酸具有较高的荧光强度,当蛋白质展开、色氨酸暴露于外部环境时荧光强度反而会降低,这与赵亚南等[19]的研究结果相似。
2.5 NaCl对蛋白质流变学特性的影响
NaCl对兔肉蛋白质剪切应力的影响变化曲线见图5。
由图5可知,不同NaCl添加量的兔肉蛋白质剪切应力随着剪切速率的增大而增大。在低剪切速率阶段,蛋白质溶液的剪切应力几乎呈线性上升的趋势,蛋白质溶液表现出牛顿流体的性质,这是因为蛋白质的高分子链段在剪切速率较低时没有表现出黏弹性形变。在相同的剪切速率下,添加NaCl的样品剪切应力高于未添加NaCl的样品,且在添加量为6%时达到最大。这可能是由于盐能促进肌原纤维蛋白的溶解,形成致密的三维网络,蛋白质与蛋白质之间的作用力得以增强,在低盐环境下肌球蛋白间有较强的作用力,如氢键、离子键等,降低了溶液的流动性,所以需要更大的剪切应力[20]。而高盐会导致蛋白质过度氧化并发生聚集现象,分子间作用力有所降低。
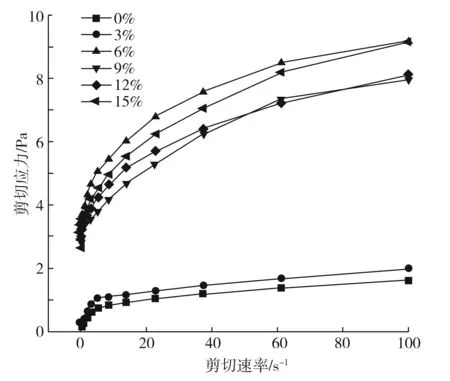
图5 NaCl添加量对兔肉蛋白质流变学特性的影响
3 结论
本研究通过添加不同质量浓度的NaCl腌制兔肉,以探讨NaCl对兔肉蛋白质氧化的影响。结果表明,随着NaCl添加量的增加,兔肉蛋白质中巯基含量降低了约20%,羰基含量升高至5.03 nmol/mg,表面疏水性得到增强,表明NaCl作为促氧化剂使蛋白质氧化程度有所增加。不同NaCl添加量腌制处理后的兔肉蛋白质紫外吸收光谱相似,都在280 nm处出现了峰的拐点,而随着NaCl添加量的增加,蛋白质的紫外最大吸收峰会略微下降。添加NaCl后,兔肉蛋白质的内源荧光强度也有降低的现象,在添加量为9%时荧光强度最低,并发生了轻微的红移,这说明NaCl的促氧化作用导致蛋白质结构发生变化。兔肉的肌原纤维蛋白在NaCl的作用下溶解,蛋白溶液的流动性减弱,剪切应力增大,且在NaCl添加量为6%时最大,而高盐腌制的兔肉蛋白质发生聚集,分子间作用力减小,导致剪切应力减小。总体而言,NaCl会促进蛋白质的氧化,但是高盐会导致蛋白质过度氧化,蛋白质的结构和性质发生改变,降低兔肉的食用品质,所以在实际生产中要注意调控盐的用量。

