A型肉毒毒素通过自噬途径对大鼠皮瓣缺血再灌注的保护作用研究
崔 超,张 珊,林 煌
(1.北京怀柔医院急诊科 北京 100014;2.北京怀柔医院肿瘤科 北京 100014;3.首都医科大学附属北京安贞医院整形科 北京 100029)
游离皮瓣越来越多地用于修复严重外伤和肿瘤术后的皮肤和软组织缺损。缺血再灌注损伤是不可避免的,会导致游离皮瓣显著组织损伤[1]。尽管皮肤缺血再灌注损伤的病因尚不清楚,但越来越多的证据表明微血管塌陷和血流缺陷是皮瓣缺血再灌注损伤的主要环节[2]。内皮细胞凋亡可能导致血管通透性、微血栓形成和组织炎症[3]。近年来,许多保护皮瓣的潜在方法和措施相继被挖掘出来,如高压氧、分子氢、缺血后处理等[4-5],显示出良好的发展前景。几项研究表明,A型肉毒毒素(Botulinum toxin A,BTX-A)可以减轻动物模型上由缺血再灌注损伤引起的皮瓣坏死[6-7]。保护皮瓣的机制可能与增加血流量和血管舒张有关[8]。自噬是缺氧、低循环组织中细胞的一种保护作用,在维持细胞再灌注损伤等应激条件下的存活方面起着重要作用。研究证实,缺氧和复氧微环境导致血管内皮细胞损伤进而引起自噬基因表达增加[9]。本研究的主要目的是评估BTX-A对缺血再灌注损伤后大鼠皮瓣的保护作用是否与自噬有关。
1 材料和方法
1.1 实验动物:本研究经北京安贞医院伦理委员会批准。均采用成年雄性Sprague-Dawley(SD)大鼠购自北京思贝福生物有限公司,体重300~350 g,在22℃~25℃标准条件下将大鼠圈养在12 h的明暗循环环境中。
1.2 实验方法与分组:80只雄性SD大鼠随机分为四组:I/R组(n=20):缺血8 h后血流再灌注,I/R前7 d注射生理盐水200 μl;BTX-A+I/R组(n=20):缺血8 h后再灌注,I/R前7 d注射1 U BTX-A(Allergan,美国),余操作同I/R组;BTX-A+I/R+3-MA(3-甲基腺嘌呤,自噬拮抗剂,Sigma,美国)组(n=20):再灌注前20 min注射3-MA(30 mg/kg),其他处理同BTX-A组;假手术组(n=20):无缺血/再灌注,前7 d注射生理盐水200 μl。见图1。
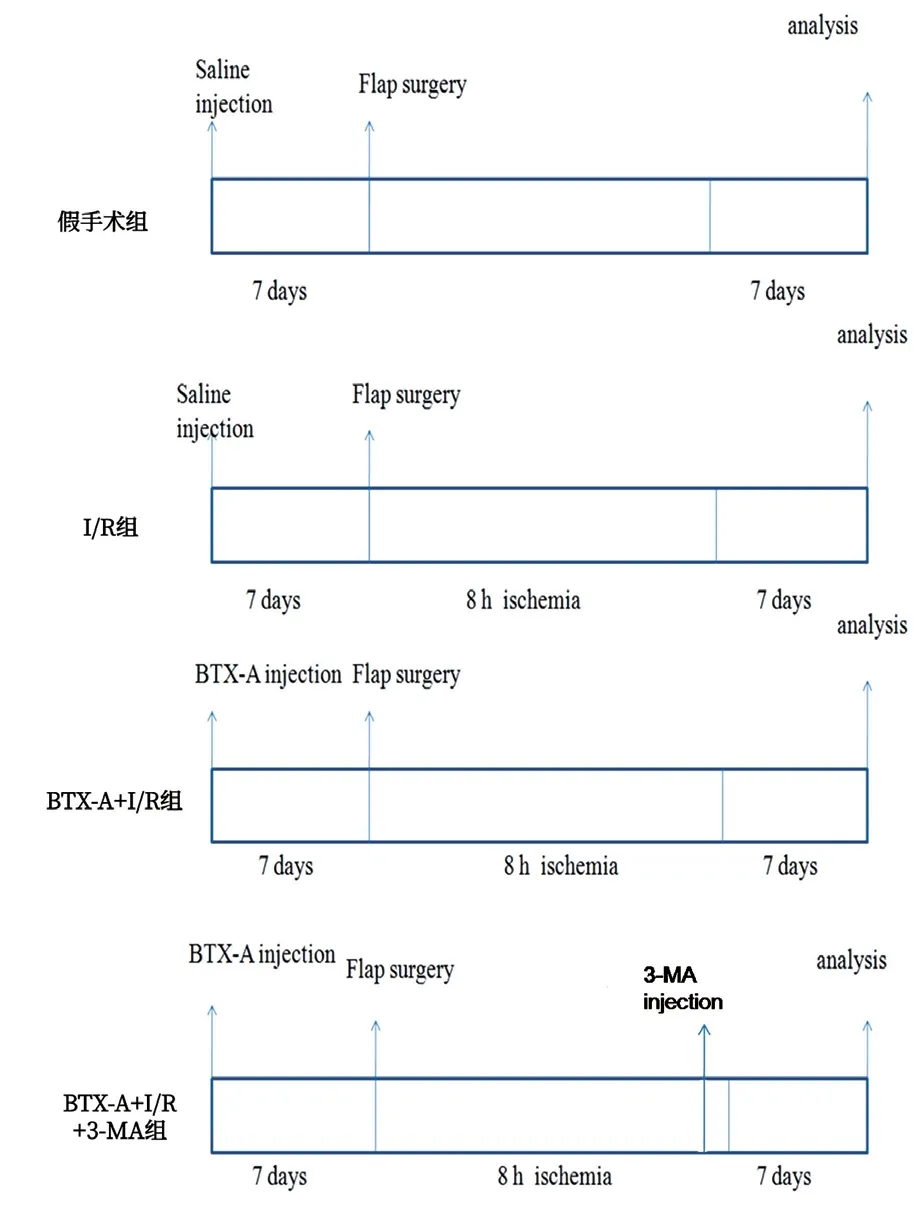
图1 实验方案示意图
1.3 操作方法:大鼠用1%戊巴比妥钠(5 ml/kg)麻醉。整个腹部区域备皮,并在大鼠身上设计了一个3 cm×6 cm的左侧腹股沟皮瓣(见图2)。结扎左股血管的其他分支,皮瓣保留浅表腹壁血管作为血管蒂。用微血管钳夹住左股血管8 h,夹紧位置靠近左股血管的胯部(见图3~4)。1 U BTX-A或生理盐水注射到蒂附近的皮下层。3-MA(30 mg/kg)通过腹腔注射给药。在缺血期结束时,移除夹子(见图5)。使用5-0尼龙线(Ethilon,Johnson,美国)进行连续缝合。
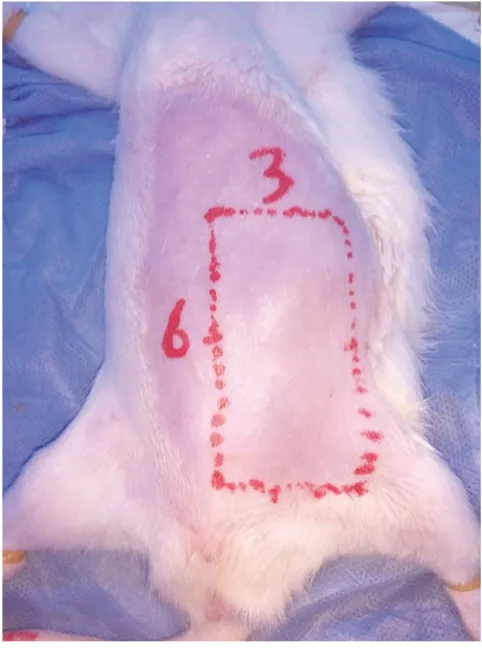
图2 皮瓣缺血再灌注设计面积
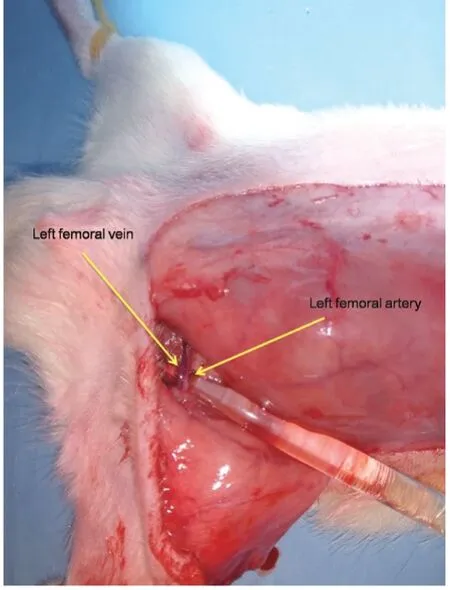
图3 左腹部股动脉和股静脉的解剖位置
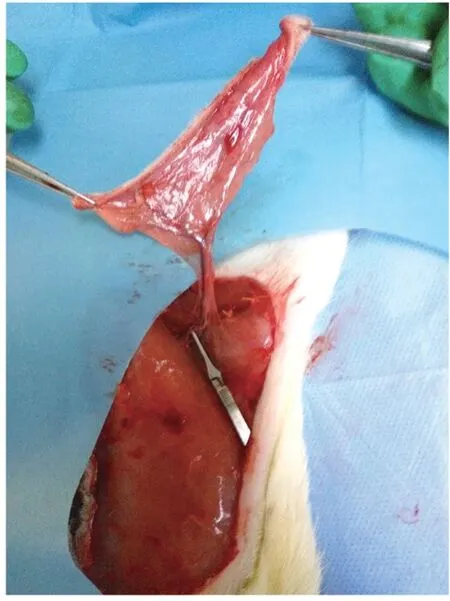
图4 腹壁浅血管带血管蒂皮瓣解剖图

图5 5-0尼龙线连续缝合
1.4 HE染色:从皮瓣存活区域取出皮瓣组织片(每个约1 cm2大小)。将样品切片并用0.1 mol/L磷酸盐缓冲液的4%多聚甲醛固定。然后包埋在石蜡中,固定在载玻片上,进行HE染色。检测皮瓣组织和微血管的病理情况。同时,计算血管密度。
1.5 免疫组化(CD34&LC3)染色:切片通过抗体孵育、苏木精染色、封固,用于观察血管生成和LC3的表达。
1.6 Tunel染色:将50 μl POD加入到暗湿箱中带有盖玻片或密封膜的标本中;进行DAB染色、自来水冲洗、苏木精复合染料和1%盐酸分化。安装后进行显微镜观察。凋亡细胞核呈棕色和黄色。通过选择含有微血管的切片,计算在高倍视野(400次)下沿血管分布的凋亡细胞数。
1.7 皮瓣坏死区的评估:术后第7天使用数码相机评估皮瓣存活率。使用Image J软件(1.51版,美国国立卫生研究院)确定皮瓣的存活面积和坏死面积。正常皮肤是柔软、温暖和粉红色的。坏死的皮肤为肿胀、变黑、变硬和变冷。然后计算坏死面积的百分比。
2 结果
2.1 BTX-A可防止缺血再灌注引起的皮瓣坏死:本次所有大鼠均存活。图6显示了术后第1天、第3天、第5天和第7天各组皮瓣的存活和坏死状态。与假手术组相比,缺血再灌注处理增加了皮瓣的坏死面积;BTX-A+I/R组的坏死百分比低于I/R组,BTX-A+I/R+3-MA组的坏死百分比高于BTX-A+I/R组,差异均有统计学意义(P<0.05)。见图7。

图6 各组术区情况
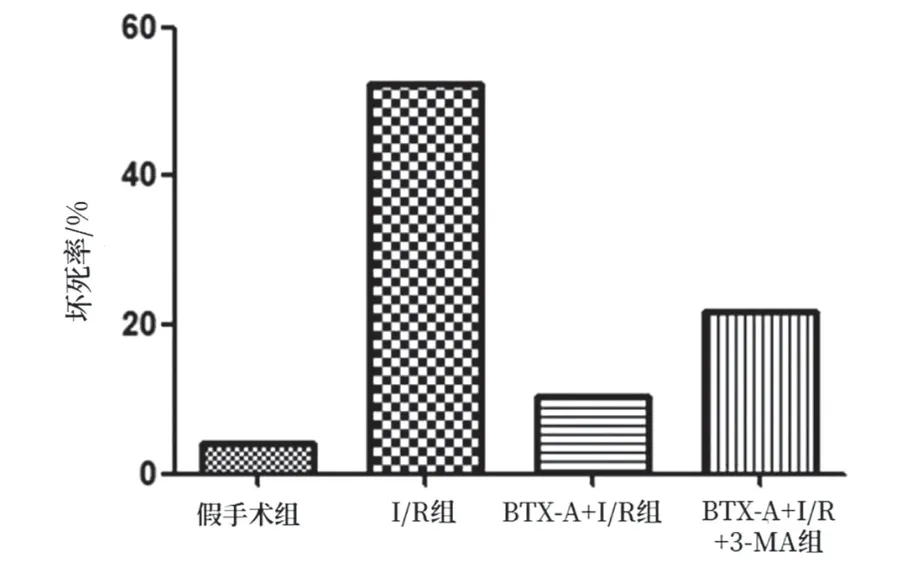
图7 各组皮瓣坏死率
2.2 HE染色结果:假手术组皮瓣组织结构正常,可见大量血管,组内未见炎性浸润。I/R组皮瓣组织结构疏松,血管数量明显减少,分布着大量的炎性细胞。与I/R组相比,BTX-A+I/R组皮瓣组织正常,血管数量增多,炎症浸润不明显。与BTX-A+I/R组相比,BTX-A+I/R+3-MA组血管分布减少并显示出炎症浸润。见图8~9。

图8 各组皮瓣组织HE染色结果(100×)

图9 各组皮瓣组织微血管计数
2.3 免疫组化(CD34&LC3)结果:图10可知,假手术组皮瓣组织血管内皮细胞CD34阳性,细胞质是棕色的,排列成一个圆圈。与假手术组相比,I/R组皮瓣组织结构松散,血管明显缩小。与I/R组相比,BTX-A+I/R组CD34阳性细胞数增加。BTX-A+I/R+3-MA组血管组织数量少于BTX-A+I/R组。图11可知,LC3阳性表达为棕黄色。BTX-A+I/R组皮瓣组织中LC3的表达水平高于I/R组。BTX-A+I/R+3-MA组LC3的表达水平降低。

图10 各组CD34免疫组化染色结果(400×)

图11 各组LC3 IHC染色结果(400×)
2.4 Tunel染色结果:假手术组凋亡细胞较少(见图12),但I/R组凋亡细胞比例明显增加。BTX-A+I/R组皮瓣组织凋亡细胞百分比明显低于I/R组。BTX-A+I/R组抗凋亡作用被3-MA减弱。见图13。
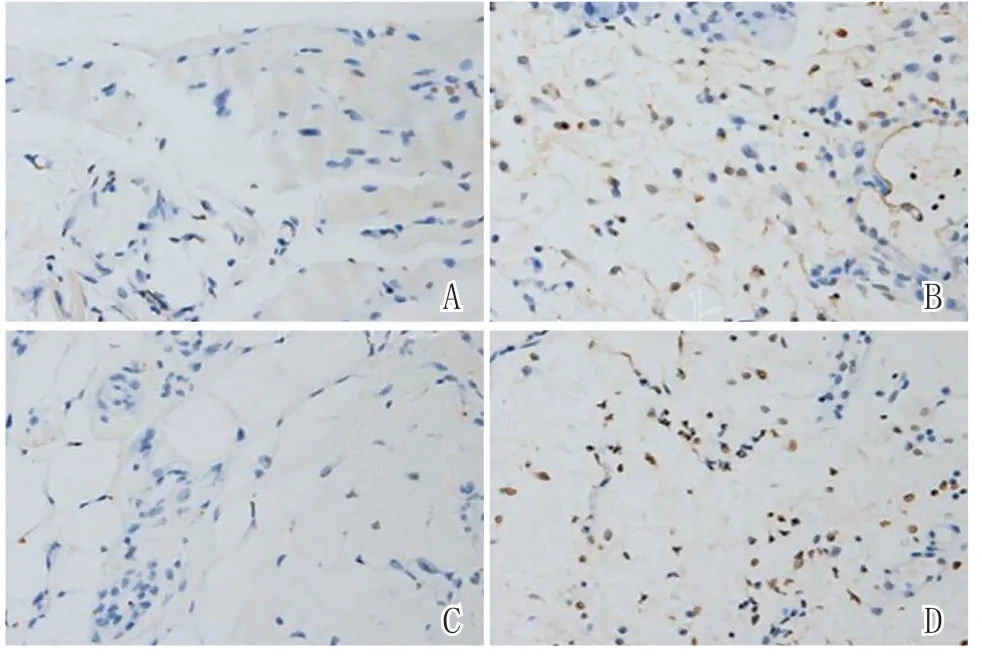
图12 各组TUNEL染色结果(400×)

图13 各组TUNEL阳性细胞比例
3 讨论
尽管保护游离皮瓣的综合治疗措施不断完善,游离皮瓣的成活率仍为90%~95%[10]。分析抗再灌注损伤的分子机制,确立皮瓣的靶点,具有现实的紧迫性。早在1986年,Murry在心肌缺血研究中就提出了预处理的概念[11]。研究表明,药物预处理可以通过增强缺血再灌注中的自噬作用来减弱内皮细胞凋亡[12]。
肉毒毒素是肉毒杆菌在生殖过程中分泌的一种有毒蛋白质。肉毒毒素存在多种亚型(A、B、C、D、E、F、G),其中A型研究得最为清楚。目前已经揭示了BTX-A对皮瓣缺血再灌注损伤的保护作用[13-14],这与本次结果一致。在本研究中,BTX-A+I/R组的坏死百分比低于I/R组。与I/R组相比,该组血管存活数增加,细胞凋亡数减少。然而,其机制尚不清楚。缺血再灌注损伤诱导炎症,包括白细胞和巨噬细胞的浸润和促炎细胞因子的产生,并导致血管内皮、毛细血管功能障碍,狭窄、血管梗塞和血管痉挛。这些血管损伤导致组织缺氧和氧化应激,导致这些组织的凋亡和坏死[15]。本研究中进行HE染色和CD34(一种新血管生成相关细胞表面蛋白,作为组织对缺血再灌注损伤的保护程度的标志),以上两个结果表明,I/R组的血管数少于假手术组。Tunel染色显示I/R组细胞凋亡数高于假手术组。
研究表明,自噬与大鼠皮瓣的存活有关[16]。然而,目前尚没有证据表明自噬参与了BTX-A的保护机制。足够的证据表明,自噬在缺血再灌注过程中在人体重要脏器中起着重要作用[17]。然而,自噬在皮瓣缺血再灌注中的作用尚未得到充分报道。这些器官的自噬机制可能与细胞凋亡的调节有关。本研究中,由于自噬阻滞剂的应用,皮瓣成活面积百分比、皮瓣血管分布均较BTX-A组降低,皮瓣炎症浸润和细胞凋亡增多。同时,3-MA注射后LC3的表达水平低于BTX-A+I/R组。说明BTX-A通过增强自噬保护皮瓣缺血再灌注损伤。本研究为提高皮瓣移植成功率提供了一种新的理论方法。
虽然本次证明BTX-A可以防止缺血再灌注损伤,但该研究有局限性。首先,皮瓣的血管损伤量测量不充分,在未来的研究中,可以通过蛋白质印迹或逆转录酶聚合酶链反应确定VEGF(血管内皮生长因子)、iNOS(诱导型一氧化氮合酶)和CD34。此外,可以利用这些方法进一步评估相关的凋亡蛋白(如Caspase-3、Bcl-2)及自噬相关蛋白。总之,本次研究结果可能有助于制定相关的转化方案,以提高显微游离皮瓣术后组织的存活率,未来需要进一步的研究来阐明BTX-A在皮瓣上的确切机制。

