miR-892a通过细胞外因子/β-连环蛋白信号通路调控对前列腺癌细胞增殖及凋亡的影响
伍宏亮,李文永,汪 盛,陈志军,关 翰
(蚌埠医学院第一附属医院泌尿外科,安徽蚌埠 233004)
前列腺癌(prostate cancer,PCa)是一种发生于前列腺的上皮恶性肿瘤,是老年男性最常见的癌症[1]。目前,临床上多采用根治性前列腺切除术和放疗治疗前列腺癌, 约70%的患者得到治愈[2]。然而,前列腺癌晚期大多数患者发展成去势抵抗性前列腺癌从而导致治疗效果欠佳,易出现远处转移,其5年生存率不足30%[3]。微小RNA (miRNA)是一类内源性长度为20~22个核苷酸的非编码小RNA,在调控基因转录后的表达中发挥着重要作用。miR-892a作为一种重要的抑癌基因,已被证实参与了肝癌、喉癌、口腔癌的发展进程[4]。本研究旨在探讨miR-892a在前列腺癌细胞系中的表达情况及其过表达对细胞生物学功能的影响和相关机制,为诊治前列腺癌寻找新的生物学指标提供了理论依据,现报道如下。
1 材料与方法
1.1 仪器与试剂 人正常前列腺上皮细胞系(RWPE-1)及人前列腺癌细胞系(DU145、PC3)来自中国科学院细胞库。RPMI 1640培养基、10%胎牛血清(FBS)、二甲亚砜(DMSO)均购自美国ThemoFisher公司。CCK-8试剂盒购自上海研生实业有限公司。磷酸甘油醛脱氢酶(GAPDH)抗体、放射免疫沉淀试验(RIPA )裂解液、喹啉甲酸(BCA)试剂盒和总RNA抽提试剂(TRIzol)试剂盒购自上海信裕生物科技公司。实时荧光定量逆转录聚合酶链反应(qRT-PCR)仪购自美国Bio-Rad公司、Olympus荧光显微镜购自日本Olympus公司。miR NC及miR-892a mimic由上海生工合成本研究经蚌埠医学院第一附属医院医学伦理委员会批准。
1.2 细胞转染及分组 将对数期生长的DU145细胞接种于6孔板(5×105个/孔),培养24 h后, 严格按照Lip2000转染试剂说明书进行转染操作,转染后培养48 h。实验分为3组:空白对照组(BC)即BC组,转染空载病毒阴性对照组(NC)即miR-NC组;转染miR-892a过表达慢病毒序列为miR-892a mimic组。每组6个复孔。慢病毒载体由上海吉玛生物制药有限公司构建(提供慢病毒序列)。
1.3 CCK-8法检测细胞存活率 将过表达miR-892a细胞接种至96孔板(1×105个/孔),参照CCK-8试剂盒说明书,分别培养24、48、72 h后,加入CCK-8试剂检测各组细胞活性,采用酶标仪(美国Bio-Rad;型号:1680)检测450 mm波长吸光度值(OD)值表示细胞存活率。细胞存活率=[实验孔吸光度-空白孔吸光度]/[对照孔吸光度-空白孔吸光度] ×100%。
1.4 qRT-PCR检测 miR-892a、细胞外因子(Wnt)、β-连环蛋白(β-Catenin)、c-myc基因及转录因子SOX5的mRNA(信使核糖核酸)表达 收集对数期生长的DU145细胞,加入TRIzol提取总RNA。采用紫外分光光度计检测RNA浓度,按照逆转录试剂盒操作步骤,将RNA逆转录为cDNA,-20 °C保存备用。以cDNA为模版进行qRT-PCR法扩增。反应体系:cDNA 2.5 μL,2×SYBR mix 10 μL,上下游引物各1 μL,加水至20 μL。反应条件:95 °C 20 s,60 °C 30 s,68 °C延伸30 s,40个循环。U6作为内参,根据2-ΔΔCt法计算 miR-892a、Wnt、β-Catenin、c-myc基因及转录因子SOX5的mRNA 相对表达量。
1.5 流式细胞术检测细胞凋亡率 收集各组的DU145细胞,制成1×106/mL悬浮细胞。根据Annexin V-FITC凋亡检测试剂盒说明书分别加入5 μL的Annexin V-FITC,充分混匀,再加入5 μLPI,室温下遮光孵育20 min,置于流式细胞仪(美国BD,型号:FACS Calibur)中,并采用Cellauest软件检测分析各组细胞的凋亡情况。
1.6 统计学分析 采用SPSS 22.00统计学软件处理数据。计量资料以(x)表示,两组间的比较采用独立样本t检验,多组间比较采用单因素方差分析,两两比较采用LSD-t检验。以P<0. 05为差异有统计学意义。
2 结果
2.1 miR-892a在前列腺癌细胞和正常前列腺上皮细胞中的mRNA表达,人前列腺癌细胞DU145、PC3中miR-892a的表达水平显著低于人正常前列腺上皮细胞RWPE-1,差异有统计学意义(P<0.05),见图1。
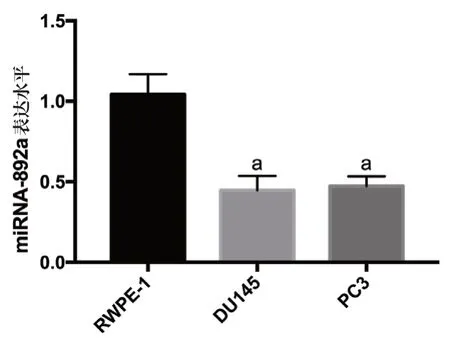
图1 miR-892a在前列腺癌细胞和正常前列腺上皮细胞中的mRNA表达
2.2 过表达miR-892a对前列腺癌细胞增殖的影响 慢病毒转染之后miR-892a mimic组的miR-892a表达水平显著高于BC组及miR-NC组,差异有统计学意义(P<0.05)。miR-892a mimic组24、48、72 h的前列腺癌细胞增殖活力均显著低于BC组及miR-NC组,差异有统计学意义(P<0.05),见表1、图2。
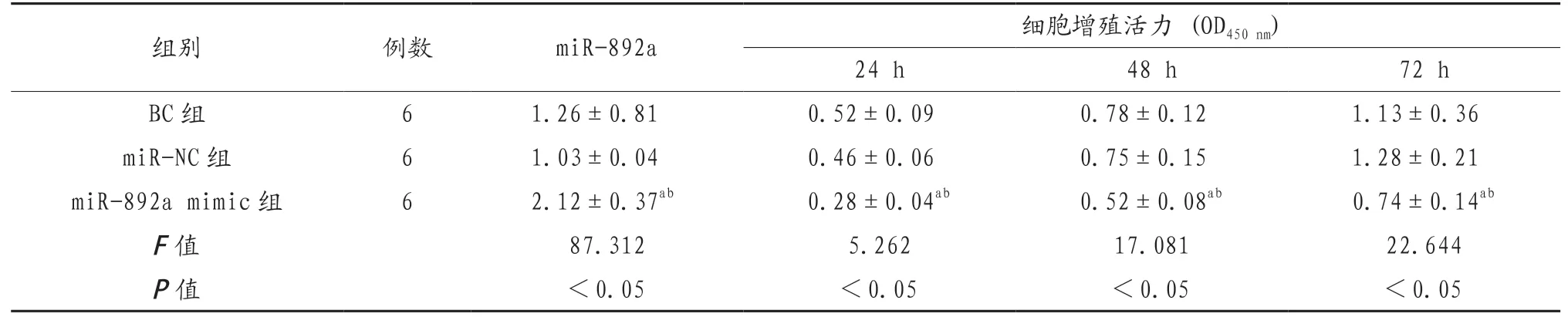
表1 过表达miR-892a对前列腺癌细胞增殖的影响(x)
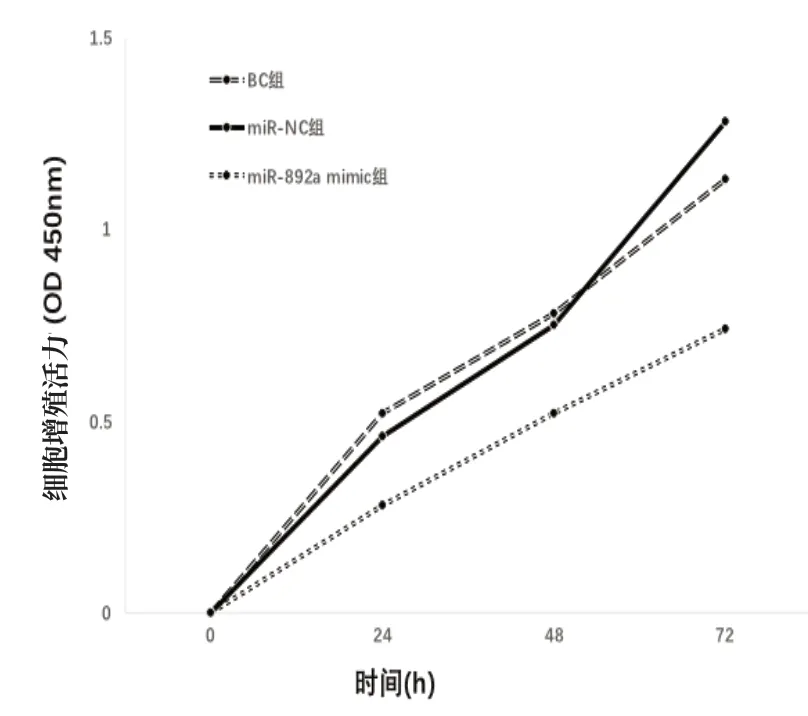
图2 过表达miR-892a后前列腺癌细胞生长曲线
2.3 过表达miR-892a对前列腺癌细胞凋亡的影响 流式细胞术检测各组细胞的凋亡率,miR-892a mimic 组的前列腺癌细胞凋亡率显著高于BC组及miR-NC组,差异有统计学意义(P<0.05),见表2、图3。
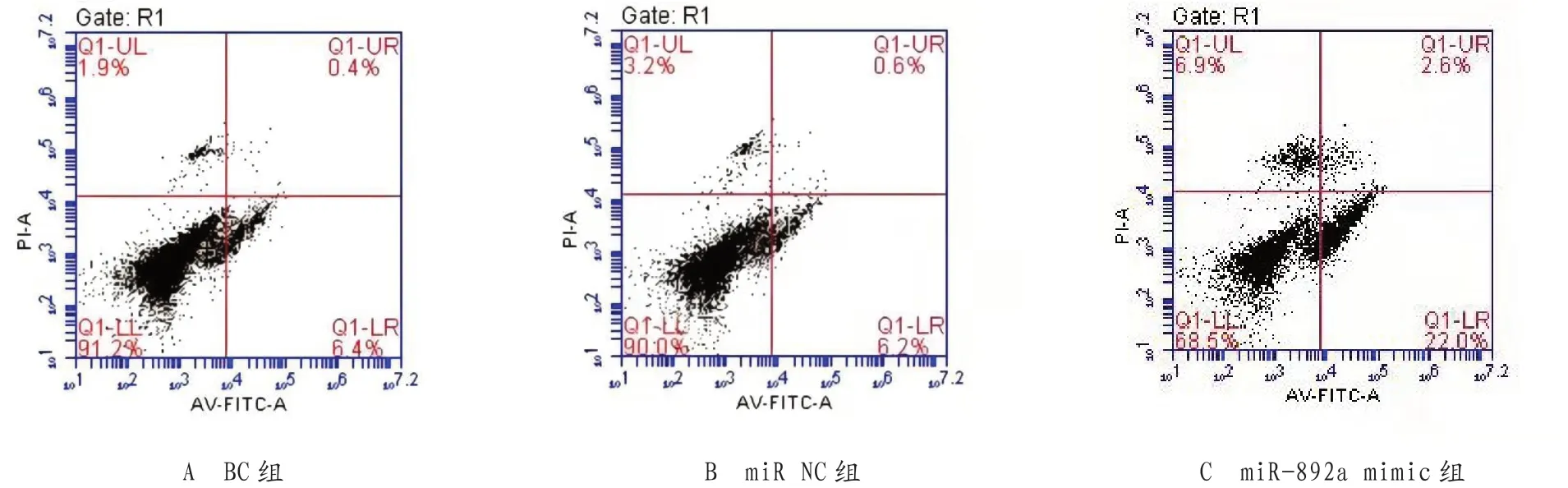
图3 流式细胞仪检测过前列腺癌细胞的凋亡情况

表2 过表达miR-892a对前列腺癌细胞凋亡的影响(x)
2.4 过表达miR-892a对前列腺癌细胞中Wnt、β-Catenin、c-myc基因及转录因子SOX5表达的影响 miR-892a mimic 组的Wnt、β-Catenin、c-myc基因及转录因子SOX5的mRNA 表达水平显著低于BC组及miR-NC组,差异有统计学意义(P<0.05),见表3、图4。
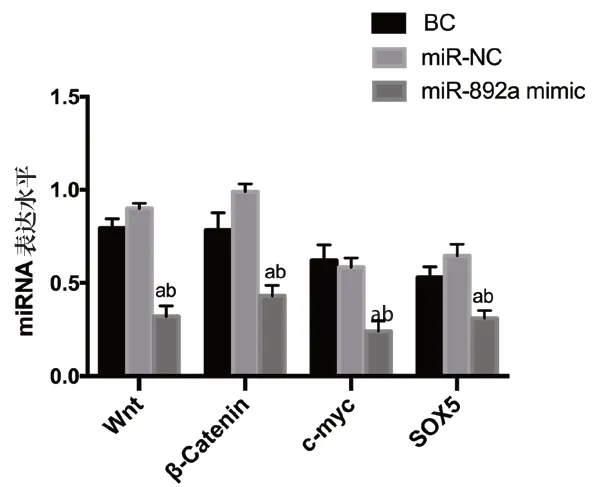
图4 过表达miR-892a后前列腺癌细胞中Wnt、β-Catenin、c-myc基因及转录因子SOX5的mRNA表达水平
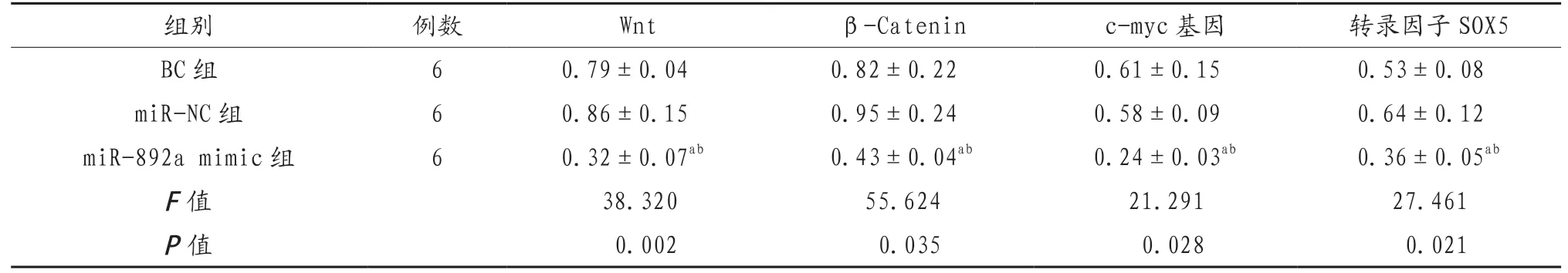
表3 过表达miR-892a对前列腺癌细胞中Wnt、β-Catenin、c-myc基因及转录因子SOX5表达的影响(x)
3 讨论
miRNA的组织特异性和时序性决定了组织和细胞的功能特异性,表明miRNA在细胞生长和发育过程中发挥着多种作用[5]。既往报道证实在去势抵抗性前列腺癌细胞中miR-616的表达显著上升,过表达的miR-616能增强前列腺癌细胞的增殖能力,抑制细胞凋亡[6]。前期通过生物信息学分析发现miRNA-892a在正常前列腺组织和前列腺癌患者的肿瘤组织中的表达存在明显的差异,miR-892a在前列腺癌细胞中低表达,预示着miR-892a的表达水平可能与前列腺癌的发生、发展密切相关。
本研究分析了 miR-892a 在前列腺癌细胞中的mRNA表达水平,结果发现与人正常前列腺上皮细胞RWPE-1比较,人前列腺癌细胞DU145、PC3中miR-892a的表达水平明显较低,提示miR-892a的表达缺失与前列腺癌的发生相关。进一步通过CCK-48法检测研究前列腺癌细胞的增殖能力,结果表明,miR-892a mimic 组的前列腺癌细胞增殖活力明显低于BC组及miR NC组。以上结果证实miR-892a能抑制前列腺癌细胞的增殖,对前列腺癌的发生发展起到负向调控的作用。本研究结果发现,miR-892a mimic 组的前列腺癌细胞凋亡率显著高于 BC 组及 miR-NC 组,提示miR-892a过表达可以促进前列腺癌细胞的凋亡。
Wnt蛋白是一种通过自分泌或旁分泌发挥作用的细胞生长信号因子,其异常表达或激活能引起肿瘤[7]。β-Catenin作为Wnt信号通路的重要调解蛋白,在Wnt信号激活的细胞中由胞浆进入胞核成为转录激活因子[8]。c-myc 是一种可以使细胞无限增殖、促进细胞分裂的基因[9]。于婷等[10]发现过表达的miR-181能抑制 Wnt/β-Catenin 信号通路从而抑制急性B淋巴细胞的增殖。同时,SOX5作为一种转录因子,已被证实可以结合DNA或其他蛋白调节基因的表达。研究表明,miR-132通过靶向调控SOX5在垂体肿瘤中发挥抑癌基因的作用[11]。本研究结果显 示,miR-892a mimic 组 的Wnt、β-Catenin、c-myc及SOX5的mRNA 表 达 水 平 低 于BC组 合miR-NC,与韩兵等[12]研究结果相似,证实miR-892a过表达可以通过下调Wnt/β-Catenin信号通路及下游蛋白,使其活性受到抑制从而抑制前列腺癌细胞的增殖,促进细胞凋亡。但本研究只初步验证了miR-892a对前列腺癌细胞增殖、凋亡的影响,涉及的具体通路作用机制尚不明确,后续研究将继续展开分子实验进一步深入探究。
综上所述,miR-892a在前列腺癌细胞中呈低表达状态,过表达miR-892a能抑制抑制前列腺细胞的增殖、促进前列腺癌细胞的凋亡,其可能通过调控Wnt /β-Catenin信号通路而发挥作用,提示miR-892a在诊治前列腺癌中具备成为生物学指标的潜力。

