异丹叶大黄素对脂多糖诱导的小鼠急性肺损伤的影响
姚培宇,邓瑞冰,李珍珠,张 茁
天津市人民医院急诊医学科,天津 300121
急性肺损伤(acute lung injury,ALI)是由肺内或肺外多种疾病引起的,以高死亡率为特征的疾病[1]。尽管近些年在ALI机械通气策略等治疗手段上取得了一些进展,但其死亡率仍然居高不下[2],因此探索治疗ALI的新策略及方法具有重要意义。细胞自噬是真核生物进化中高度保守的、对细胞内物质进行周转的重要过程[3]。众多研究表明,细胞自噬通过调节与炎症相关的转录因子如核因子-κB(nuclear factor-κB,NF-κB)的表达,调控炎症复合物的活化以及炎症介质的产生与降解,进而抑制炎症反应[4]。异丹叶大黄素(isorhapontigenin,ISO)是从小叶买麻藤中提取出的一种新的芪类单体成分,研究表明其具有抗肿瘤、抗氧化和抗炎活性[5-7]。本研究拟探讨ISO是否通过激活细胞自噬,对脂多糖(lipopolysaccharide,LPS)诱导的ALI起到保护作用。
材料和方法
材料RAW264.7巨噬细胞系购自中国科学院典型培养物保藏委员会细胞库。ISO购自日本TCI股份有限公司,并溶于二甲基亚砜(dimethyl sulfoxide,DMSO),且DMSO浓度<0.1%。胎牛血清、RPMI-1640培养基购自美国Gibco公司,CCK-8试剂盒购自日本Dojindo Laboratories公司,细胞内活性氧(reactive oxygen species,ROS)试剂盒购自上海碧云天生物技术有限公司,LPS(Escherichiacoli055:B5)购自美国Sigma公司,3-甲基腺嘌呤(3-methyladenine,3-MA)购自美国Selleckchem公司,LC3、Beclin1、P62、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白细胞介素(interleukin,IL)-6、IL-1β、环氧合酶2(cyclooxygenase-2,COX-2)、诱生型一氧化氮合酶(inducible nitric oxide synthase,iNOS)、高迁移率组蛋白B1(high mobility group box-1,HMGB1)、β-actin抗体均购自武汉三鹰生物技术有限公司,P65、磷酸化-P65(p-P65)、IκBα、磷酸化-IκBα(p-IκBα)抗体以及HRP标记二抗均购自美国Abcam公司。
细胞培养及处理选取加有10%胎牛血清、100 U/ml青霉素和100 μg/ml链霉素的RPMI-1640培养基培养小鼠RAW264.7细胞,并放置于37 ℃、含5% CO2的恒温细胞培养箱中,待细胞融合度达80%时进行细胞传代。使用200 ng/ml LPS诱导RAW264.7细胞,根据实验需要分为:(1)对照组:单纯培养基处理;(2)ISO组:10 μmol/L ISO处理细胞12 h;(3)LPS组:200 ng/ml LPS处理细胞12 h;(4)3-MA组:5 mmol/L 3-MA处理细胞2 h;(5)LPS+ISO(5 μmol/L)组:5 μmol/L ISO处理细胞12 h后弃去,随后加入200 ng/ml LPS处理细胞12 h;(6)LPS+ISO(10 μmol/L)组:10 μmol/L ISO处理细胞12 h后弃去,随后加入200 ng/ml LPS处理细胞12 h;(7)LPS+ISO(10 μmol/L)+3-MA组:3-MA处理细胞2 h后弃去,加入10 μmol/L ISO处理细胞12 h后弃去,随后加入200 ng/ml LPS处理细胞12 h。
实验动物建模及分组选取6~8周龄雄性C57BL/6小鼠70只(体重18~22 g),饲养于天津市人民医院动物医学实验中心,控制室环境温度(23±2) ℃,相对湿度(50±10)%,12 h明暗交替,标准饲料无菌水饲养。定期监测记录小鼠体重。采用腹腔注射LPS(15 mg/kg)方法,制造小鼠ALI模型。ISO溶于0.3%羧甲基纤维素(carboxymethylcellulose,CMC)中,并添加L-抗坏血酸(终浓度0.1 mg/ml)以提高其稳定性,配制成ISO浓度为3.33 mg/ml的灌胃溶液。将实验小鼠应用随机数字表法分为7组(每组10只):(1)对照组:腹腔注射无菌水12 h后处死;(2)ISO组:每天灌胃ISO(51.6 mg/kg),连续7 d;(3)3-MA组:每天腹腔注射3-MA(10 mg/kg),连续7 d;(4)LPS组:腹腔注射LPS(15 mg/kg)12 h后处死;(5)LPS+ISO组:每天灌胃ISO(51.6 mg/kg),连续7 d,末次给药1 h后,腹腔注射LPS(15 mg/kg)12 h后处死;(6)LPS+ISO+3-MA组:每天腹腔注射3-MA(10 mg/kg)1 h后,灌胃ISO(51.6 mg/kg),连续7 d,末次给药1 h后,腹腔注射LPS(15 mg/kg)12 h后处死;(7)0.3% CMC组:每天灌胃0.3% CMC(15.5 ml/kg),连续7 d,末次给药1 h后,腹腔注射无菌水 12 h后处死。本研究经天津市人民医院实验动物管理委员会批准(伦理审查编号:2021-SYDWLL-000175)。
CCK-8检测取对数生长期RAW264.7细胞以5×104个/孔接种于96孔板中,置于37 ℃、含5% CO2的恒温细胞培养箱中培养24 h。分别使用0、1、5、10、15、20、25 μmol/L ISO处理细胞24 h,弃上清液,PBS溶液洗2遍,每孔加入10 μl CCK-8试剂和90 μl无血清培养基,培养30 min。采用酶标仪测定各孔在450 nm处的光密度(optical density,OD)值。同时以无血清培养基作为空白对照组。细胞活力=(OD实验组-OD空白对照组)/(OD0 μmol/LISO-OD空白对照组)。
DCFH-DA探针检测RAW264.7细胞ROS水平取对数生长期RAW264.7细胞以8×104个/孔接种于6孔板中,加药处理后,使用无血清RPMI-1640培养基洗涤,加入DCFH-DA荧光探针(10 μmol/L)于37 ℃孵育30 min,PBS洗涤后,荧光显微镜下观察。
肺组织HE染色小鼠右肺经10%福尔马林固定,常规脱水后石蜡包埋、切片。采用二甲苯脱蜡及梯度酒精复水,苏木精染色、冲洗、伊红染色,梯度乙醇、二甲苯Ⅰ和二甲苯Ⅱ脱水透明,中性树胶封片。使用光学显微镜观察并记录肺组织形态的病理变化。
流式细胞术检测收集小鼠支气管肺泡灌洗液(bronchoalveolar lavage fluid,BALF),使用ACK裂解缓冲液处理BALF,PBS洗涤沉淀的细胞并离心弃去上清液。按照1∶1000用无血清RPMI-1640培养基稀释DCFH-DA使终浓度为10 μmol/L。将收集好的细胞悬浮于DCFH-DA溶液中,37 ℃细胞培养箱内孵育30 min,每隔3~5 min颠倒混匀一下,使探针和细胞充分接触,随后用无血清RPMI-1640培养基洗涤细胞3次,在激发波长488 nm、发射波长522 nm条件下,使用流式细胞仪检测荧光强度。
Western blot检测将各实验组的细胞及组织提取总蛋白,BCA法检测蛋白浓度。根据分子量大小调配不同浓度的分离胶,上样后电泳分离,湿转膜法进行转膜。10%脱脂奶粉室温下封闭1 h,TBST洗膜后,一抗4 ℃摇床孵育过夜,TBST洗膜后加入二抗封膜,室温摇床孵育1 h,TBST洗膜,使用ECL发光试剂盒检测蛋白质表达情况,Image-J软件测定各显色条带灰度值。
统计学处理使用SPSS 19.0软件进行统计分析。计量资料以均数±标准差表示,组间比较采用Studentt检验。每组实验均重复3次。P<0.05为差异有统计学意义。
结 果
不同浓度ISO对RAW264.7细胞活力的影响CCK-8法检测结果显示,ISO 0、1、5、10、15、20、25 μmol/L组的RAW264.7细胞活力分别为0.98±0.12、0.99±0.08、0.96±0.11、0.98±0.09、0.95±0.15、0.63±0.10、0.47±0.17,其中,20、25 μmol/L组的细胞活力明显低于0 μmol/L组(t=4.054,P=0.015;t=4.317,P=0.013)。根据本实验结果,选取浓度为5、10 μmol/L的ISO进行后续实验。
ISO抑制LPS诱导的RAW264.7细胞炎症因子的表达Western blot检测结果显示,与对照组比较,LPS组的IL-1β(0.89±0.17比0.05±0.02;t=8.637,P=0.001)、IL-6(2.66±0.26比0.12±0.01;t=17.201,P<0.001)、TNF-α(2.42±0.13比0.09±0.02;t=31.201,P<0.001)、iNOS(1.13±0.02比0.03±0.01;t=28.320,P<0.001)、COX-2(1.06±0.01比0.01±0.01;t=32.323,P<0.001)、HMGB1(1.09±0.01比0.39±0.03;t=24.322,P<0.001)表达水平显著升高。与LPS组比较,LPS+ISO(5 μmol/L)组和LPS+ISO(10 μmol/L)组的IL-1β(0.82±0.12比0.89±0.17;t=0.582,P=0.032和0.31±0.08比0.89±0.17;t=5.458,P=0.015)、IL-6(2.02±0.15比2.66±0.26;t=3.746,P=0.020和1.05±0.11比2.66±0.26;t=9.982,P=0.001)、TNF-α(1.67±0.12比2.42±0.13;t=7.329,P=0.002和1.19±0.09比2.42±0.13,t=13.630,P<0.001)、iNOS(1.02±0.02比1.13±0.02;t=7.512,P=0.002和0.65±0.15比1.13±0.02;t=10.485,P<0.001)、COX-2(0.72±0.01比1.06±0.01;t=7.892,P=0.002和0.46±0.01比1.06±0.01,t=29.538,P<0.001)、HMGB1(0.70±0.01比1.09±0.01;t=8.512,P=0.002和0.46±0.01比1.09±0.01;t=25.382,P<0.001)表达水平均显著降低且呈浓度依赖性(图1)。

ISO:异丹叶大黄素;LPS:脂多糖;IL:白细胞介素;TNF-α:肿瘤坏死因子-α;iNOS:诱生型一氧化氮合酶;COX-2:环氧合酶2;HMGB1:高迁移率组蛋白B1;Mr:相对分子质量ISO:isorhapontigenin;LPS:lipopolysaccharide;IL:interleukin;TNF-α:tumor necrosis factor-α;iNOS:inducible nitric oxide synthase;COX-2:cyclooxygenase-2;HMGB1:high mobility group box-1;Mr:relative molecular mass图1 Western blot 检测ISO对LPS诱导的RAW264.7细胞炎症因子表达的影响Fig 1 Western blotting to detect the effects of ISO on the expression of inflammatory cytokines in LPS-induced RAW264.7 cells
ISO抑制LPS诱导的RAW264.7细胞ROS的产生与对照组比较,ISO组对RAW264.7细胞ROS的产生无影响,而LPS组则促进ROS的产生;与LPS组比较,LPS+ISO(5 μmol/L)组以及LPS+ISO(10 μmol/L)组均抑制RAW264.7细胞ROS的产生(图2)。
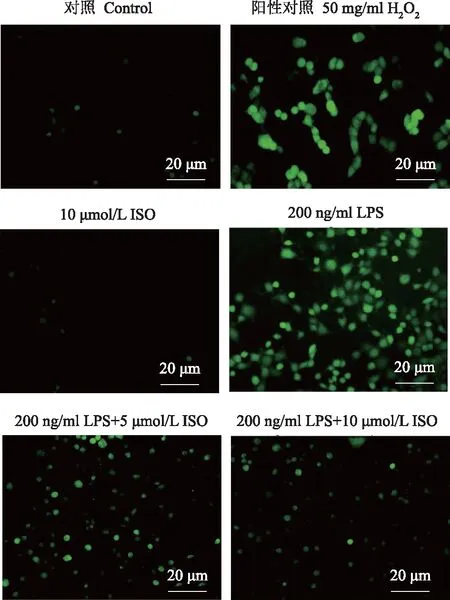
图2 不同浓度ISO对LPS诱导的RAW264.7细胞活性氧的影响Fig 2 Effects of different concentrations of ISO on reactive oxygen species of RAW264.7 cells induced by LPS
ISO促进RAW264.7细胞自噬相关蛋白的表达
Western blot检测结果显示,ISO(10 μmol/L)处理RAW264.7细胞后,LC3Ⅱ/Ⅰ和Beclin1在1(1.06±0.17比0.54±0.02;t=5.324,P=0.006和1.27±0.01比1.04±0.01;t=33.483,P<0.001)、6(0.90±0.08比0.54±0.02;t=4.314,P=0.005和1.72±0.02比1.04±0.01;t=60.378,P<0.001)、12 h(1.10±0.20比0.54±0.02;t=5.314,P=0.006和1.91±0.04比1.04±0.01;t=65.314,P<0.001)的表达水平均明显高于未处理前;而P62在1(1.56±0.09比1.59±0.16;t=3.148,P=0.046)、6(1.38±0.05比1.59±0.16;t=4.016,P=0.009)、12 h(1.03±0.05比1.59±0.16;t=5.809,P=0.004)的表达水平明显低于未处理前(图3)。

图3 Western blot 检测不同时间点ISO对RAW264.7细胞自噬相关蛋白表达的影响Fig 3 Western blot of autophagy-related proteins in the RAW264.7 cells exposed to ISO for different time periods
ISO通过激活巨噬细胞自噬抑制ALI炎症因子和氧化应激的表达Western blot检测结果显示,与对照组比较,LPS+ISO(10 μmol/L)组的LC3Ⅱ/Ⅰ(1.12±0.12比0.41±0.01;t=7.304,P=0.004)、Beclin1(1.98±0.04比1.01±0.01;t=62.714,P<0.001)的表达水平明显增加,而P62(1.01±0.05比1.82±0.04;t=62.343,P<0.001)的表达水平明显下降低。与对照组比较,LPS组的p-P65/P65(1.04±0.01比0.25±0.01;t=60.382,P<0.001)、p-IκB(1.13±0.01比0.31±0.02;t=58.741,P<0.001)、iNOS(1.10±0.01比0.34±0.01;t=351.403,P<0.001)、COX-2(1.06±0.02比0.33±0.01;t=56.761,P<0.001)、HMGB1(1.06±0.02比0.35±0.02;t=54.173,P<0.001)的表达水平明显升高,IκB(0.39±0.01比1.03±0.01;t=149.102,P<0.001)的表达水平明显降低。与LPS组比较,LPS+ISO(10 μmol/L)组p-P65/P65(0.49±0.01比1.04±0.01;t=121.611,P<0.001)、p-IκB(0.43±0.01比1.13±0.01;t=362.904,P<0.001)、iNOS(0.36±0.01比1.10±0.01;t=287.633,P<0.001)、COX-2(0.52±0.01比1.06±0.02;t=41.721,P<0.001)、HMGB1(0.58±0.01比1.06±0.02;t=50.651,P<0.001)的表达水平明显降低,IκB(0.73±0.01比0.39±0.01;t=91.092,P<0.001)的表达水平明显增加。与LPS+ISO(10 μmol/L)组比较,LPS+ISO(10 μmol/L)+3-MA(5 mmol/L)组p-P65/P65(0.78±0.05比0.49±0.01;t=10.543,P<0.001)、p-IκB(0.92±0.01比0.43±0.01;t=56.791,P<0.001)、iNOS(0.70±0.01比0.36±0.01;t=64.260,P<0.001)、COX-2(0.78±0.05比0.52±0.01;t=9.358,P<0.001)、HMGB1(0.77±0.01比0.58±0.01;t=22.522,P<0.001)的表达水平明显增加,IκB(0.44±0.01比0.73±0.01;t=78.464,P<0.001)的表达水平明显降低(图4)。与对照组比较,3-MA组对RAW264.7细胞ROS的产生无影响,而LPS组则促进ROS的产生;与LPS组比较,LPS+ISO(10 μmol/L)组抑制RAW264.7细胞ROS的产生;与LPS+ISO(10 μmol/L)组比较,LPS+ISO(10 μmol/L)+3-MA组促进ROS的产生(图5)。
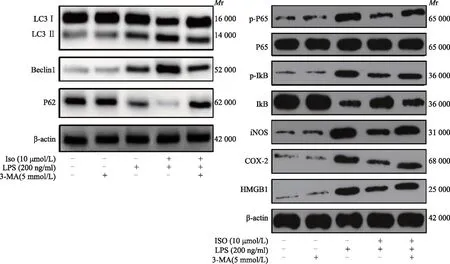
3-MA:3-甲基腺嘌呤;p-P65:磷酸化-P65;p-IκB:磷酸化-IκB
3-MA:3-methyladenine;p-P65:phospho-P65;p-IκB:phospho-IκB
图4 Western blot检测RAW264.7细胞不同组别中炎症因子和自噬相关蛋白的表达
Fig 4 Western blot of inflammatory cytokines and autophagy-related proteins in the treated RAW264.7 cells
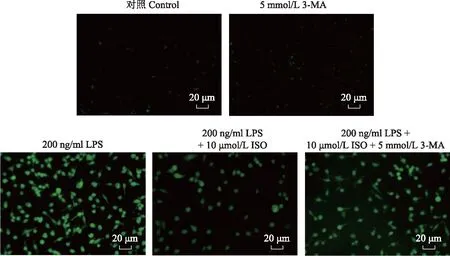
图5 ISO和3-MA对LPS诱导的RAW264.7细胞活性氧的影响Fig 5 Effects of ISO and 3-MA on reactive oxygen species in RAW264.7 cells induced by LPS
ISO对LPS诱导ALI小鼠肺组织的保护作用HE染色结果显示,与对照组比较,ISO组、3-MA组和0.3% CMC组小鼠肺组织在病理学上无明显变化,而LPS组出现肺间质水肿、肺泡壁明显增厚、肺泡腔内严重出血及透明膜形成、肺组织中显著的炎症细胞浸润等典型ALI病理改变。与LPS组比较,LPS+ISO组肺组织损伤程度明显改善;与LPS+ISO组比较,LPS+ISO+3-MA组肺组织损伤病理表现加重(图6)。
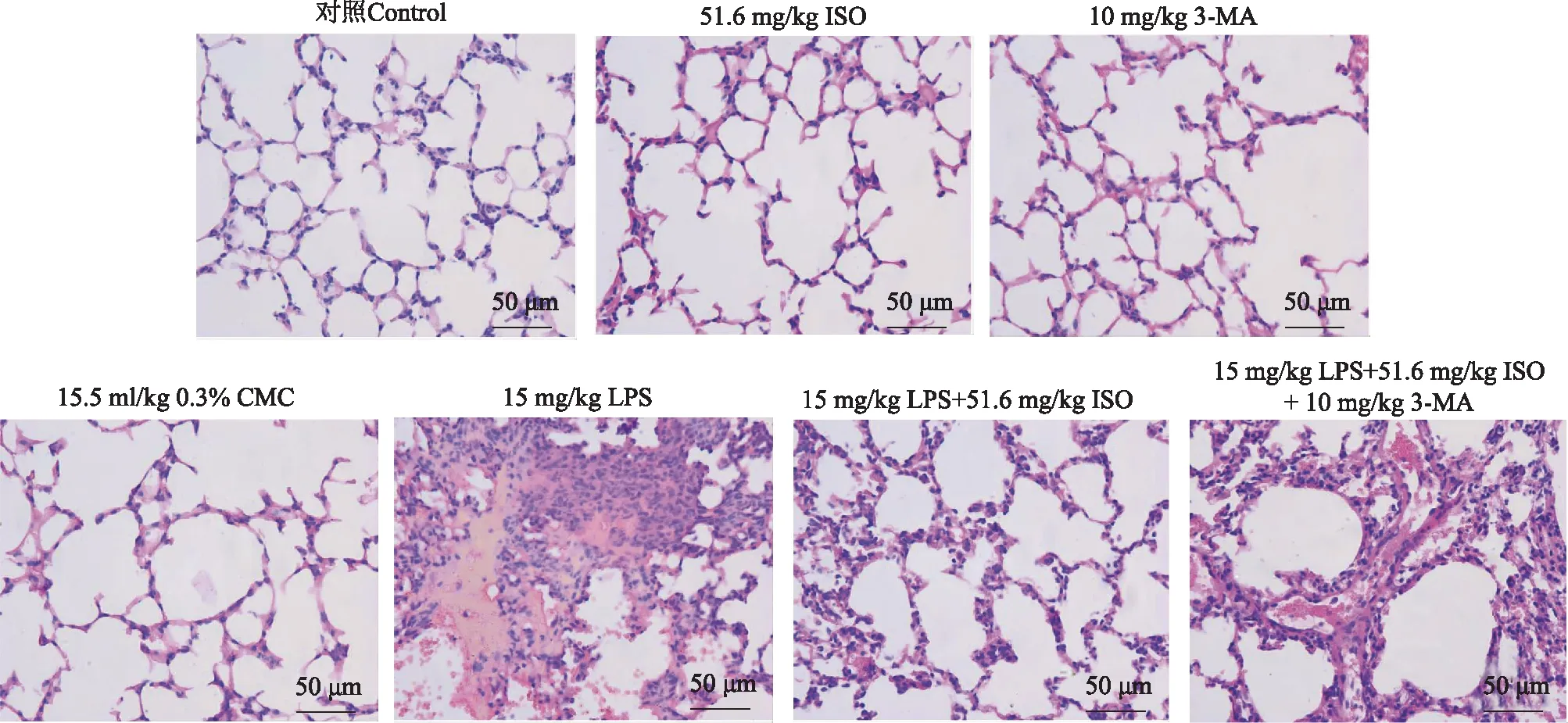
CMC:羧甲基纤维素CMC:carboxymethylcellulose图6 各组小鼠肺组织病理HE染色Fig 6 HE staining of mouse lung tissue
ISO对LPS诱导ALI小鼠肺组织炎症反应的抑制作用Western blot检测结果显示,与对照组比较,LPS组p-P65/P65(1.23±0.01比0.25±0.01;t=32.928,P<0.001)、p-IκB(1.10±0.02比0.28±0.01;t=208.433,P<0.001)、iNOS(1.00±0.02比0.44±0.02;t=97.51,P<0.001)、COX-2(1.03±0.02比0.26±0.01;t=32.927,P<0.001)、HMGB1(1.02±0.02比0.55±0.02;t=68.251,P<0.001)的表达水平明显升高,IκB(0.27±0.01比0.88±0.01;t=57.551,P<0.001)的表达水平明显降低。与LPS组比较,LPS+ISO组p-P65/P65(0.49±0.01比1.23±0.01;t=159.302,P<0.001)、p-IκB(0.63±0.02比1.10±0.02;t=23.201,P<0.001)、iNOS(0.66±0.02比1.00±0.02;t=20.950,P<0.001)、COX-2(0.56±0.02比1.03±0.02;t=28.618,P<0.001)、HMGB1(0.65±0.02比1.02±0.02;t=20.392,P<0.001)的表达水平明显降低,IκB(0.96±0.04比0.63±0.02;t=33.282,P<0.001)的表达水平明显增加。与LPS+ISO组比较,LPS+ISO+3-MA组p-P65/P65(0.95±0.01比0.49±0.01;t=19.952,P<0.001)、p-IκB(1.00±0.02比0.63±0.02;t=20.913,P<0.001)、iNOS(0.77±0.01比0.66±0.02;t=8.269,P<0.001)、COX-2(0.85±0.02比0.56±0.02;t=18.801,P<0.001)、HMGB1(0.82±0.02比0.65±0.02;t=8.498,P=0.001)的表达水平明显增加,IκB(0.65±0.02比0.96±0.04;t=13.40,P<0.001)的表达水平明显降低(图7)。

图7 Western blot 检测各组小鼠肺组织中炎症因子表达的影响Fig 7 Western blot of inflammatory cytokines in mouse lung tissue
ISO对LPS诱导ALI小鼠BALF中ROS的抑制作用与对照组比较,LPS组BALF中ROS含量明显增加(4.01±0.12比1.00±0.01;t=41.704,P<0.001);与LPS组比较,LPS+ISO组BALF中ROS明显降低(1.17±0.01比4.01±0.12,t=39.281,P<0.001);与LPS+ISO组比较,LPS+ISO+3-MA组BALF中ROS明显增加(2.17±0.04比1.17±0.01,t=40.913,P<0.001)。
讨 论
ALI作为呼吸危重症领域一种病情严重、处理棘手的疾病,目前在临床中仍具有较高的死亡率。尽管肺保护机械通气策略,包括小潮气量通气、允许性高碳酸血症、俯卧位通气等以及体外膜肺氧合技术已经广泛应用于临床并显著改善患者预后,然而,由于其发病机制的复杂性和现有临床治疗方法的不良反应,ALI临床研究尤其是药理学治疗研究并未取得较大进展[8]。近年来研究发现,天然药物有效成分具有多途径、多靶点以及不良反应较小的特点和优势,能够发挥防治ALI的作用[9]。ISO是从我国传统的中草药小叶买麻藤中分离出来的有效成分,具有多种包括抗炎症、抗氧化及抗肿瘤在内的生物学特性[10]。研究表明,ISO通过下调脑组织中丙二醛含量并提高超氧化物歧化酶和谷胱甘肽的活性减轻大鼠脑缺血再灌注损伤[11]。ISO与ω-3脂肪酸联合使用可通过抗氧化和抗炎作用对异丙肾上腺素诱导的心肌梗死大鼠产生心脏保护作用[12]。本研究结果证实ISO能够有效抑制LPS诱导的RAW264.7细胞炎症介质IL-1β、IL-6、TNF-α、iNOS、COX-2及HMGB1的表达和ROS的产生,阐明了ISO在体外细胞实验中的抗炎症反应及抗氧化应激的特性;此外,本研究结果也证实ISO可以减轻LPS诱导的ALI小鼠肺组织的病理变化,抑制ALI小鼠肺组织中调控炎症反应的关键信号通路,即NF-κB信号通路,以及iNOS、COX-2、HMGB1炎症介质的产生,降低ALI小鼠BALF中ROS的含量,同样阐明了ISO对LPS诱导的小鼠ALI的保护作用以及抗炎症反应及抗氧化应激的特性。
自噬是一种将已受损、无法发挥生理效应的蛋白质或其他细胞成分通过溶酶体降解方式进行代谢的过程,在细胞维持其自身稳定状态中发挥着关键作用[13]。研究表明,在营养缺乏、炎症及外界压力的刺激下,细胞会产生应激反应,抑制哺乳动物雷帕霉素靶蛋白活性,同时激活细胞的自噬[14]。在细菌导致的炎症反应中,革兰阴性菌的LPS与细胞膜表面的Toll样受体4结合后,通过促分裂原活化的蛋白激酶/P38信号通路激活自噬[15]。然而亦有研究表明,在盲肠穿孔造成脓毒症模型的小鼠体内,自噬在术后初始阶段增加,随后逐渐减弱,并伴有器官的功能障碍[16],这说明自噬参与到包括炎症反应等的应激反应中,且自噬水平的不足可能与脏器功能障碍相关。而近年来的众多研究也显示,促进细胞自噬水平与减轻ALI密切相关。Jia等[17]研究显示,雷帕霉素作为自噬诱导剂,可以通过促进细胞自噬,抑制核苷酸结合寡聚化结构域样受体蛋白3炎症小体的产生,导致炎症因子IL-18以及IL-1β的表达增加,进而减轻LPS诱导的小鼠ALI。Zhao等[18]研究也发现,雷帕霉素诱导的巨噬细胞自噬,明显降低结肠穿孔脓毒症小鼠血清炎症介质的释放,改善ALI小鼠的严重程度并提高小鼠的存活率。本研究在细胞实验中发现,当经过ISO处理后,LPS诱导的RAW264.7细胞LC3Ⅱ/Ⅰ以及Beclin1表达水平上调,P62表达水平下调,表明自噬通路被进一步激活。同样,在动物实验层面也证实了ISO处理可以抑制LPS诱导的ALI小鼠的炎症反应及氧化应激水平,且当使用自噬抑制剂3-MA时,ISO所发挥的抗炎、抗氧化应激作用被逆转,由此证实ISO可能是通过激活细胞自噬来发挥保护作用的。
综上,本研究结果表明,ISO可以对LPS诱导的ALI起到保护作用,其机制可能是通过激活巨噬细胞自噬、抑制炎症反应及氧化应激来实现的。本研究可为ISO治疗ALI奠定一定的理论基础,为开发ALI的治疗药物提供实验依据。

