HbA1c,CK及FBG水平在糖尿病微血管病变筛查中的检测价值
黄河,黄国响,李晓静,李肇暖
1.福建省三明市第二医院检验科,福建三明 366000;2.福建省三明市第二医院内分泌科,福建三明 366000
糖尿病属于临床常见代谢性疾病,遗传基因突变、生活作息不规律等均被认为是该病的诱发因素。随着糖尿病病症的不断发展,机体会持续处于高血糖水平状态,机体毛细血管基底膜会随之出现增厚,进而形成微血栓,诱发一系列微血管病变[1-2]。尽早控制糖尿病微血管病变的发展,有助于防止微血栓损害病变区域器官生理功能,而监测与之相关的因子水平动态变化或能够为临床诊治提供依据。糖化血红蛋白被认为能够反映患者近3个月内血糖水平,该指标水平与患者红细胞中血红蛋白含量关联密切,一定程度上可间接反映血管受损程度;空腹血糖水平与糖尿病微血管病变病理生理症状存在密切关联[3]。此外,有学者发现,糖尿病患者胰岛素抵抗、微循环障碍等病理生理状况进展期间有大量肌酸激酶参与,2型糖尿病肾病、2型糖尿病性视网膜病变等微血管病变患者的CK水平较一般2型糖尿病患者高[4]。基于此,现选取2020年1月—2022年1月福建省三明市第二医院接收的82例糖尿病患者以及同期选取的41名健康人群作为研究对象,就血清HbA1c、CK、FBG水平在糖尿病微血管病变筛查中的检测价值进行分析,旨在探讨以上各项指标与糖尿病微血管病变病理生理症状之间的关联,从而为临床筛查工作提供建议。现报道如下。
1 资料与方法
1.1 一般资料
选取本院接收的82例糖尿病患者以及同期选取的41名健康人群作为研究对象。糖尿病患者纳入观察组,健康人群纳入对照组。观察组男45例,女37例;年龄为45~70岁,平均(53.24±5.82)岁;体质量指数(Body mass index,BMI)为21~26 kg/m2,平均(24.30±1.50)kg/m2;糖尿病病程为3~11年,平均(7.55±1.26)年;根据组内患者资料,将患者分为合并微血管病变者(n=41)以及未合并微血管病变者(n=41)。对照组男23例,女18例;年龄为45~74岁,平均(53.35±5.87)岁;BMI为21~27 kg/m2,平均(24.42±1.46)kg/m2。
1.2 纳入与排除标准
纳入标准:①观察组均满足《2013年ADA糖尿病诊治指南》[5]中相关诊断标准,1型糖尿病患者出现“三多一少”症状,2型糖尿病患者以肥胖、无力等症状为主;②观察组组内合并微血管病变者符合美国内分泌学会制订的糖尿病微血管病变的诊断标准[6],包括肾脏、视网膜等部位的血管病变。排除标准:①合并甲亢、库欣综合征等其他影响内分泌功能的疾病;②合并肾脏等重要器官严重功能障碍。
1.3 方法
分别于观察组患者入院次日、对照组体检当日,待研究对象禁食6 h后,抽取其空腹状态下外周静脉血6 mL,其中2 mL血样置入EDTA抗凝试管,均匀混合后2 h内采用高压液相色谱法(艾克莱8180)检测两组血清HbA1c水平。同时,将剩余的4 mL血样置入普通试管使其自然凝固,后离心(3500 r/min,15 min)提取血清样本,使用全自动生化分析仪(贝克曼5800)检测两组血清CK、FBG水平;CK水平检测采用酶偶联法,FBG水平检测采用葡萄糖氧化酶法。
1.4 观察指标
比较两组血清糖化血红蛋白(glycosylated hemoglobin A1c,HbA1c)、(creatine kinase,CK)、(fasting blood glucose,FBG)水平差异,并对观察组内不同类型患者的血清HbA1c、CK、FBG水平进行对比,采用Spearman分析HbA1c、CK、FBG与糖尿病微血管病变之间的相关性。
1.5 统计方法
采用SPSS 22.0统计学软件进行数据处理,计量资料以(±s)表示,采用t检验;相关性采用Spearman分析,P<0.05为差异有统计学意义。
2 结果
2.1 两组血清HbA1c、CK、FBG水平比较
与对照组相比,观察组血清HbA1c、CK、FBG水平较高,差异有统计学意义(P<0.05)。见表1。
表1 两组血清HbA1c、CK、FBG水平对比(±s)

表1 两组血清HbA1c、CK、FBG水平对比(±s)
组别观察组(n=82)对照组(n=41)t值P值HbA1c(%)9.12±2.373.60±1.2413.969<0.001 CK(mmol/L)152.38±14.5368.39±6.4135.280<0.001 FBG(mmol/L)9.48±3.314.26±2.169.160<0.001
2.2 观察组内不同类型患者血清HbA1c、CK、FBG水平比较
与合并微血管病变的患者相比,未合并微血管病变的患者血清HbA1c、CK、FBG水平较低,差异有统计学意义(P<0.05)。见表2。
表2 观察组内不同类型患者血清HbA1c、CK、FBG水平对比(±s)
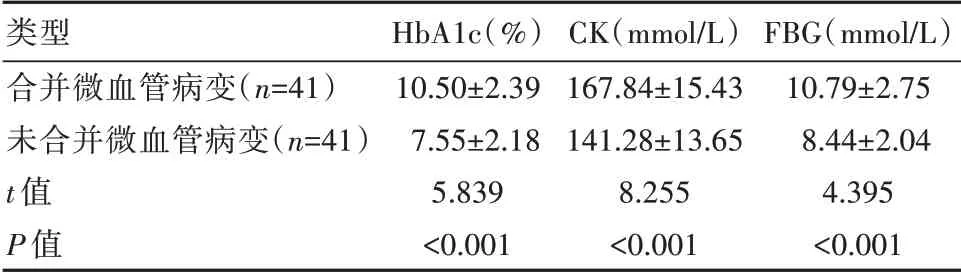
表2 观察组内不同类型患者血清HbA1c、CK、FBG水平对比(±s)
类型合并微血管病变(n=41)未合并微血管病变(n=41)t值P值HbA1c(%)10.50±2.397.55±2.185.839<0.001 CK(mmol/L)167.84±15.43141.28±13.658.255<0.001 FBG(mmol/L)10.79±2.758.44±2.044.395<0.001
2.3 HbA1c、CK、FBG水平与糖尿病微血管病变相关性分析
Spearman分析结果显示,HbA1c、CK、FBG水平与糖尿病微血管病变均为正相关关系(P<0.05)。见表3。
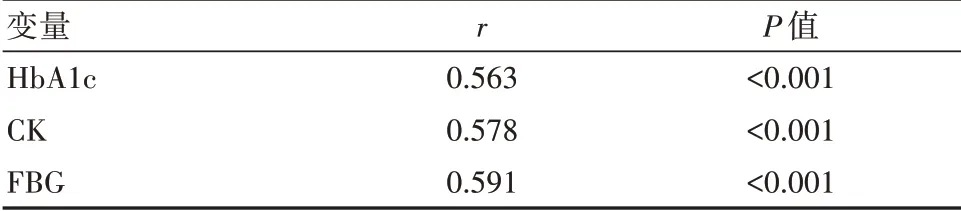
表3 HbA1c、CK、FBG水平与糖尿病微血管病变相关性分析
3 讨论
糖尿病的形成会对人体代谢系统产生严重影响,若代谢紊乱、凝血功能异常等病理生理症状发展至一定程度则会引发微血管病变、纤溶亢进甚至局部器官组织损伤。其中糖尿病微血管病变以微血管基底膜增厚、微血管瘤形成等为病理特征,以上病症被认为是糖尿病患者致残甚至死亡的重要因素[7-8]。尽早检测出具体的病变类型并采取针对性治疗,是控制临床糖尿病患者病残率的关键。既往临床所采取的FBG联合餐后血糖值检测虽有助于明确机体血糖水平,但监测准确率易受到血液中维生素C、胆红素等干扰物质影响。为了避免以上不确定性因素影响临床筛查糖尿病微血管病变患者的准确性,应当结合其他影响因素较少的指标以明确糖尿病患者血管内皮功能。
本研究分别对健康人群及糖尿病患者实施血清HbA1c、CK、FBG水平检测后发现,以上指标与人体血糖水平及微血管病变程度存在显著关联,与司珩等[9]的研究数据相近,该研究显示,糖尿病患者血清HbA1c、CK、FBG水平高于健康对照组(P<0.05),糖尿病患者中,合并微血管病变者各项指标水平较高;提示联合监测以上因子水平有助于明确糖尿病患者微血管功能异常情况。HbA1c广泛存在于人体血液中,主要与葡萄糖结合后形成血红蛋白,FBG水平随HbA1c水平的波动而出现变化;由于HbA1c可在人体内存留3个月,且不易受到运动强度、葡萄糖水平波动等因素影响,因此,将其作为血糖水平动态监测指标有助于避免血液中干扰物质影响监测准确性[10]。另有研究显示,CK水平能够反映短期内糖尿病患者血液中酸性物质的蓄积情况,作为糖尿病患者继发感染的重要评估指标[11]。同时也有研究指出了单行CK监测在鉴别糖尿病患者微血管病变上的不足,该研究分别对合并、未合并视网膜病变的糖尿病患者实施CK水平检测后所得结果差异无统计学意义(P>0.05)[12]。本研究联合监测以上3项指标,能够避免单行某项指标监测而出现漏诊的情况。动态监测血清HbA1c、CK、FBG水平,可分别从机体红细胞合成能力、血管继发感染可能性、血液中细胞因子异常分泌情况等方面对糖尿病微血管病变进行识别,并通过微血管病变相关指标水平的波动程度,结合患者外在病理表现,对累及器官功能失常程度作进一步的评估。
此外,本研究结果显示,各项受检指标水平与糖尿病微血管病变呈正相关关系(P<0.05),与胡田颖等[13]研究结果相近,该研究显示各项受检指标均与糖尿病微血管病变患者病变程度呈正相关关系,综合以上数据可见,对以上指标进行动态监测有助于明确糖尿病微血管病变病症恶化程度、控制情况。HbA1c所反映的血管内皮细胞损伤情况,可作为临床判断糖尿病患者微血管内血红蛋白活化、低密度脂蛋白费酶促糖基化等生理活动稳定性的依据。CK与细胞内能量运转活动存在密切关联,临床在动态监测HbA1c水平的同时配合CK动态监测,能够明确血管内皮细胞异常活化活动对微血管生理活动的影响[14]。在此基础上配合FBG水平监测能够评估血管内皮细胞病理生理活动所致血液高凝状态对微血栓形成的影响[15]。综合分析以上3项因子水平的动态变化趋势,有助于临床了解糖尿病患者微血管病变程度,借助各项指标所反映的凝血功能、细胞合成能力、感染等数据,形成对于微血管病变所致内皮细胞损伤、微循环障碍的特异性分析结果。
综上所述,血清HbA1c、CK、FBG水平均可作为临床筛查糖尿病微血管病变的重要依据,以上指标可反映糖尿病微血管病变的形成情况,动态监测以上指标水平有助于临床明确糖尿病患者血管内皮细胞合成、感染及血液凝结程度等病理生理活动进展情况,进而对累及器官功能进行全面的评估。

