基于网络药理学和实验验证探讨淫羊藿苷经MAPK信号通路防治激素性股骨头坏死的作用机制
王志洲,邹德宝,石 威,,姜红江,*
(1.安徽中医药大学,安徽 合肥 230000;2.山东省文登整骨医 院,山东 威海264400)
激素性股骨头坏死(steroid-induced avascular necrosis of the femoral head, SANFH)是由于长期或大剂量服用激素使血管胶原纤维和弹性纤维功能障碍,股骨头内微小动脉栓塞引起股骨头发生局部或完全性的缺血,从而导致股骨头坏死,是骨科临床最常见的疑难疾病,其主要表现为髋部疼痛和髋关节内旋功能障碍[1-2]。 流行病学调查显示,该病常见于30~50 岁的中青年男性人群,超一半以上的患者发病累及双侧[3],已占据非创伤性股骨头坏死总发病的近60%[4], 且近年来发病率呈逐年升高的趋势,每年新增约15~20 万病例[5-6]。 股骨头坏死范围广,且进展不可逆,致残率极高,已经严重危害患者的生命健康以及降低患者的生活质量[7]。现今,对于SANFH的治疗通常使用降脂、抗凝药,其毒副作用大且疗效不明显, 所以需要迫切寻求更有效的防治方法。中医药具有几千年的历史文明, 其治疗股骨头坏死源来已久,具备完善的理论、丰富的临床经验和独特的优势,可作为防治股骨头坏死的首选方法。淫羊藿苷(icariin, ICA)是中药淫羊藿的一种提取成分,有补肾、抗衰老的作用[8-9]。 现代药理研究证实,ICA 具备优良的促进成骨的功效, 但其治疗SANFH 的作用机制尚不明确,此次实验基于网络药理学和动物实验验证的方法进一步探讨ICA 防治SANFH 的机制,以期为后续研究提供理论依据。
1 材料
1.1 实验动物
8 周龄SPF 级雄性SD 大鼠共24 只,体质量270~310 g,由济南朋悦实验动物繁育有限公司提供,许可证号:SCXK(鲁)20190003。动物饲养于山东省文登整骨医院骨伤组织工程实验室(三级),笼温控制在(20±2) ℃,相对湿度45%~55%。本次实验动物研究通过山东省文登整骨医院医学伦理委员会批准(伦理审批编号:LL2022011501)。
1.2 实验仪器
电子天平(型号:A2013,上海民桥精密科学仪器有限公司);双通道流量计(型号:MS-2,上海玉研科学仪器有限公司);Micro-CT(型号:NMC-100,昆山平生医疗科技有限公司);-80 ℃冰箱(型号:DW-86L338J,青岛海尔生物医疗股份有限公司);Western blot 系统(型号:VE-586,上海天能科技有限公司);高速离心机(型号:Micro21R,赛默飞世尔科技公司)。
1.3 实验药物与试剂
ICA(批号:115H021,北京索莱宝科技有限公司);脂多糖(批号:012021210430,北京碧云天生物技术有限公司);甲泼尼龙(批号:20110408,国药集团容生制药有限公司);青霉素钠(批号:43201105,山东鲁抗医药股份有限公司);苯巴比妥钠(批号:2103071,天津金耀生物科技有限公司);异氟烷(批号:202106,北京科月华诚科技有限公司);牛血清白蛋白、5%脱脂奶粉、RIPA 裂解液、PMSF、一抗/二抗稀释液、PVDF 膜、TBST 溶液、特超敏ECL 试剂盒、p-ERK1 抗体、p-p38 抗体、p-JNK 抗体、GAPDH 抗体(北京碧云天生物技术有限公司,批号分别为ST025、P0216、P0013C、ST505、P0023A/P0023D、FFP26、P0231、P0018AS、AF1891、AF5884、AF5860、AF0006)。
2 方法
2.1 ICA 潜在靶点预测
通过TCMSP 数据库[10]查询ICA 的ADME 属性值和CAS 号,从PubChem 数据库[11]获得ICA 2D 结构用于PharmMapper 数据库[12]潜在靶点的预测,根据Norm Fit[12]进行潜在靶点筛选,完成后利用UniProt数据库对蛋白质靶点进行标准化。
2.2 SANFH 相关靶点获取
以“steroid -induced avascular necrosis of the femoral head”为主题词,检索OMIM 数据库[13]、Gene-Cards 数据库[14]、DisGeNET 数据库[15]中SANFH 的相关靶点,合并3 个数据库靶点,去重后得到SANFH的相关靶点。
2.3 PPI 网络构建
为明确ICA 潜在靶点与SANFH 相关靶点之间的关系,将两者靶点导入Venny 平台制作韦恩图。然后将共同靶点输入STRING 数据库[16]构建PPI 网络模型,最小相互作用值设置为“medium confidence(0.400)”,隐藏网络中断开连接的节点,得到PPI 网络,并通过Cytoscape 3.9.1[17]对PPI 网络进一步分析,并构建ICA-SANFH 靶点的可视化网络图。
2.4 ICA 防治SANFH 相关靶点GO、KEGG 富集分析
将ICA 防治SANFH 的共同靶点录入DAVID数据库,根据count 值选用排名前10 位、前20 位数据导入微生信云平台绘制GO 富集分析条形图、KEGG 通路富集分析气泡图。 为更加直观地显示ICA 防治SANFH 所涉及KEGG 通路的相关靶点,运用Cytoscape 3.9.1 构建“靶点-信号通路”网络图。
2.5 实验分组、造模与灌胃方法
24 只雄性SD 大鼠按随机数字表法分成空白组(n=8)、模型组(n=8)、ICA 组(n=8)。 取模型组、ICA组共16 只大鼠造模,造模方法参照文献[18]并进行适当改进。 造模组按2 mg·kg-1·d-1确定每只大鼠注射LPS 剂量。第3 天开始,造模大鼠臀肌交替注射甲泼尼龙40 mg·kg-1·d-1,连续10 d。 在注射甲泼尼龙后予腹腔注射青霉素钠80 U·d-1以预防感染。 造模成功后普食饲养7 d,空白组、模型组均使用生理盐水5 mL 灌胃,ICA 组按照实验动物用药换算法计算给药剂量,将ICA 用生理盐水配成5 mL 药液进行灌胃,连续8 周。 所有实验动物在相同条件下喂养,用悬吊法饮水使其下肢直立行走。 8 周后腹腔注射苯巴比妥钠处死实验动物,在清洁条件下剖开双侧股骨头,剔除周围软组织后置于-80 ℃冰箱保存备用。
2.6 Micro-CT 定量分析股骨头骨参数
在灌胃8 周后,腹腔注射相应浓度的苯巴比妥钠深度麻醉所有实验动物,在清洁条件下剖开双侧股骨头, 使用Micro-CT 对大鼠股骨头进行扫描定量,分析骨小梁参数如骨矿物质密度(bone mineral density, BMD)、骨小梁厚度(trabecular thickness, Tb.Th)、骨小梁数量(trabecular number, Tb.N)和骨小梁分离度(trabecular spacing, Tb.Sp)4 个指标。
2.7 Western blot 检测相关蛋白的表达
将大鼠股骨头剪碎,与RIPA 裂解液、PMSF 进行混合后加入到离心管中,充分研磨并碾碎,再使用组织匀浆机充分裂解,结束后4 ℃离心10 min,取上清装至离心管中以待检测。使用BCA 蛋白质定量试剂盒测定蛋白含量。取适量上清,加入SDS-PAGE蛋白上样缓冲液,煮沸10 min,转至PVDF 膜上,5%脱脂奶粉封闭2 h。 加入一抗(p-ERK1 按1∶2000 稀释、p-p38 按1∶1000 稀 释、p-JNK 按1∶1000 稀 释,GAPDH 按1∶5000 稀释),4 ℃孵育过夜。 洗膜后加入二抗,室温孵育2 h。TBST 溶液洗3 遍,使用ECL试剂盒进行显影。以GAPDH 为内参,计算各蛋白相对表达量。
2.8 统计学分析
采用SPSS 23.0 软件对本次实验所有数据进行统计分析,计量资料使用“±s”的形式表示,符合正态分布且方差齐的数据采用单因素方差分析。 取显著性水平α=0.05,P<0.05 认为差异有统计学意义。
3 结果
3.1 ICA 靶点的筛选
通过TCMSP 数据库查询到ICA 的CAS 号为489-32-7,OB 值为41.58%,DL 值为0.61,符合筛选原则[19]。 PharmMapper 数据库初步提取前300 位的靶点,对根据Norm Fit≥0.5 筛选得到的靶点进行标准化,去重后得到预测靶点226 个,排名前50 位的预测靶点见表1。

表1 ICA 的预测靶点
3.2 SANFH 相关靶点的获取
从OMIM、GeneCards、DisGeNET 数据库中分别获得SANFH 相关靶点84 个、571 个、74 个,合并3个数据库的相关靶点后除去重复值,最终得到677个SANFH 相关靶点。
3.3 PPI 网络的构建
将筛选出来的ICA 靶点与SANFH 靶点取交集,并通过Venny 平台制作韦恩图,得到ICASANFH 共同靶点53 个,见图1。 进而将共同靶点输入STRING 平台,得到ICA-SANFH 靶点PPI 网络,排除1 个游离的靶点蛋白(无相互作用蛋白),见图2。 为了进一步筛选出有较多交互关系的靶点,利用Cytoscape 平台,根据Degree>30 筛选出更为重要的共同靶点聚类,见图3。

图1 ICA-SANFH 靶点韦恩图
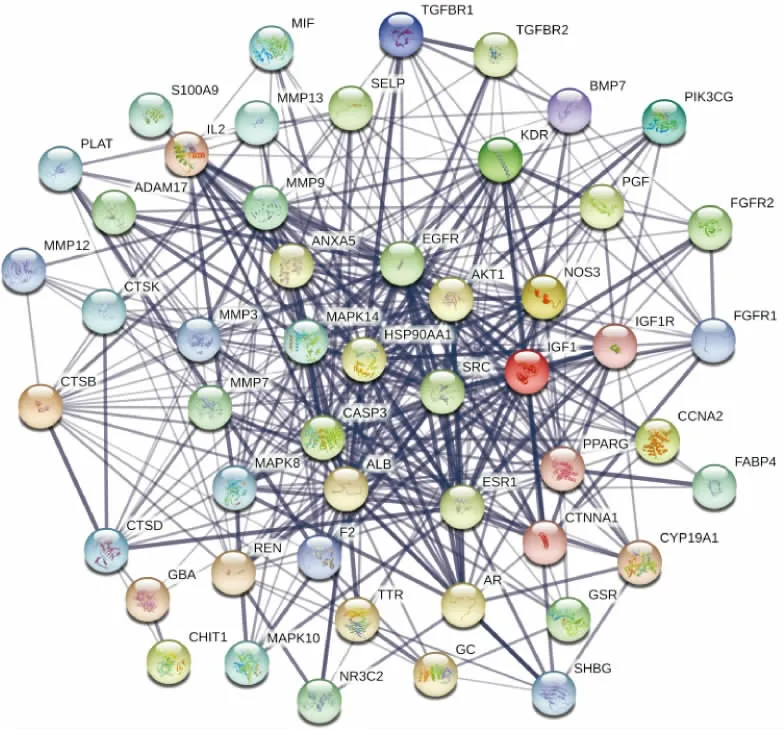
图2 ICA-SANFH 靶点PPI 网络图
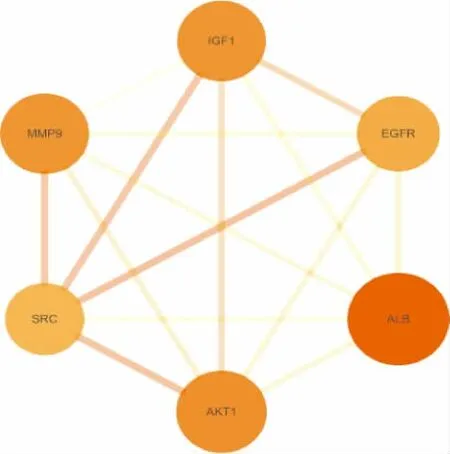
图3 共同靶点聚类
3.4 GO、KEGG 富集分析
将53 个共同靶点导入DAVID 数据库进行GO富集分析,根据count 值分别选取排名前10 位的靶点运用微生信平台对结果进行可视化,见图4。 由结果可见ICA 参与的重要生物进程包含凋亡过程的负调节、细胞增殖的正向调控和信号转导等,在细胞组分中主要作用于细胞外隙、细胞质和胞质溶胶等,调节SANFH 的功能主要富集于蛋白结合、相同的蛋白结合和ATP 结合等。 根据count 值选用KEGG通路结果中排名前20 位的通路绘制成气泡图,见图5。KEGG 富集通路提示ICA 可以通过癌症、MAPK、PI3K-Akt 等信号通路和MAPK8、MAPK10、MAPK14、AKT1、EGFR 等主要靶点参与调控SANFH。 为了更加直观地显示ICA 治疗SANFH 的KEGG 通路所涉及的相关靶点,使用Cytoscape 软件构建的“靶点-信号通路”网络图共有56 个节点,213 条边,见图6。从图中可知,每条通路可能富集到多个靶点基因,而一个靶点基因同时又出现在多条KEGG 通路中。
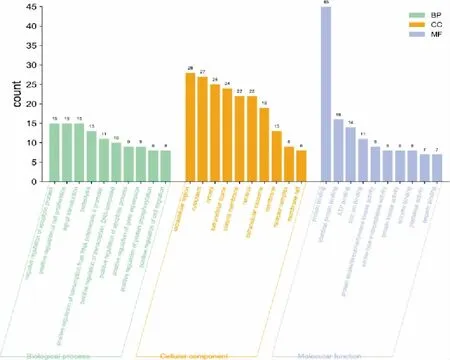
图4 ICA 治疗SANFH 靶点GO 富集分析条形图
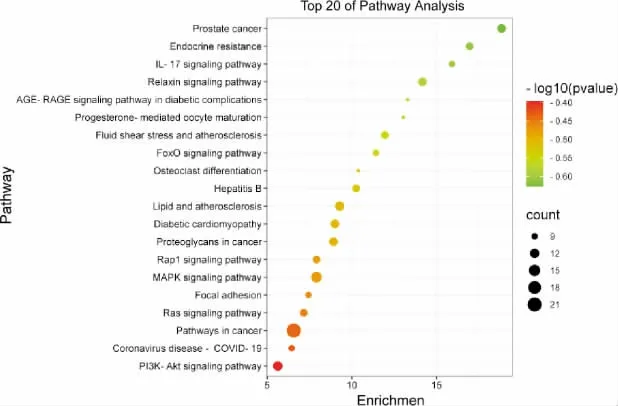
图5 ICA 治疗SANFH 靶点KEGG 通路富集分析气泡图

图6 ICA 治疗SANFH“靶点-信号通路”网络图
3.5 Micro-CT 扫描骨参数结果
Micro-CT 扫描结果显示:空白组大鼠股骨头骨小梁结构致密有规则,未见坏死征象;模型组大鼠股骨头明显骨质疏松,骨小梁变细、断裂,骨小梁间隙明显增宽,提示有明显骨坏死征象;相比于模型组,ICA 组大鼠股骨头骨小梁结构增多,间隙有改善,稍有骨小梁变细、断裂迹象,骨坏死范围明显减少,见图7。 Micro-CT 扫描结果显示:相比于空白组,模型组和ICA 组的BMD、Tb.Th、Tb.N、Tb.Sp 指标差异均具有统计学意义(P<0.05);相比于模型组,ICA 组的BMD、Tb.Th、Tb.N、Tb.Sp 指标差异均具有统计学意义(P<0.05)。 详见表2。
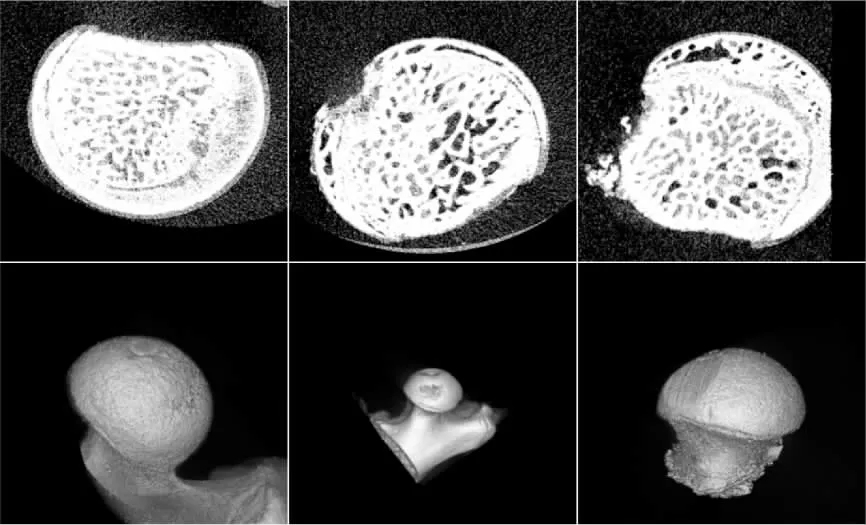
图7 Micro-CT 扫描的大鼠股骨头征象
表2 Micro-CT 骨参数比较(n=8,±s)

表2 Micro-CT 骨参数比较(n=8,±s)
注:与空白组相比,△P<0.01;与模型组相比,▲▲P<0.01。
指标BMD Tb.Th Tb.N Tb.Sp空白组0.909±0.029 0.649±0.035 6.113±0.211 0.055±0.005模型组0.674±0.044△0.377±0.033△3.146±0.198△0.146±0.015△ICA 组0.741±0.035▲▲0.512±0.033▲▲3.946±0.226▲▲0.105±0.006▲▲
3.6 Western blot 检测p-ERK1、p-p38、p-JNK 蛋白表达结果
3 组大鼠骨组织内p-ERK1、p-p38、p-JNK 蛋白表达情况见图8。根据表3 可知,相比于空白组,模型组p-ERK1 蛋白明显降低(P<0.05),p-p38、p-JNK蛋白明显增加(P<0.05);相比于模型组,ICA 组p-ERK1 蛋白明显升高(P<0.05),p-p38 蛋白降低(P<0.05),p-JNK 蛋白明显降低(P<0.05)。
表3 3 组p-ERK1、p-p38、p-JNK 蛋白表达比较(n=8,±s)

表3 3 组p-ERK1、p-p38、p-JNK 蛋白表达比较(n=8,±s)
注:与空白组相比,△P<0.01;与模型组相比,▲P<0.05,▲▲P<0.01。
ICA 组0.699±0.034▲▲0.98±0.045▲0.99±0.068▲▲指标p-ERK1 p-p38 p-JNK空白组0.959±0.037 0.848±0.037 0.824±0.018模型组0.563±0.04△1.086±0.088△1.159±0.07△

图8 大鼠股骨头p-ERK1、p-p38、p-JNK 蛋白的表达情况
4 讨论
在中医学中,根据股骨头坏死的临床症状、发病特点,结合中医古籍论述,早期股骨头坏死归属于 “骨痹”“痹证”, 进一步缺血性坏死则归类为“骨痿”“骨蚀”的范畴[20]。 《素问·长刺节论篇》[21]有骨痹的记载。 《脾胃论》认为肾藏精,主骨,生髓,髓养骨,骨枯髓减,发为骨蚀。 《素问》就有“肾主身之骨髓……发为骨痿之症”的记载。 从发病形态、致病机制、临床症状上看,可认为股骨头坏死属于中医学中的“骨蚀”“骨痿”“骨痹”。 其病机主要为肾虚和血瘀。 治疗上以补肝肾、强筋骨、祛瘀生新为主。
由于ICA 可能通过不同的靶点和信号通路对SANFH 进行调节,因此借助网络药理学的手段加以预测分析。 本次PPI 网络分析结果得到的核心靶点有ALB、AKT1、MAPK9、IGF1、EGFR 等,表明ICA防治SANFH 具有多靶点的特征。 SANFH 的发病首先侵犯的是软骨,参与关节软骨细胞增殖、分化的信号通路对于治疗SANFH 至关重要。KEGG 通路富集分析结果显示,ICA 治疗SANFH 涉及的主要信号通路有癌症、MAPK、PI3K-Akt 通路等。 (1)癌症通路:包含了诸多通路如Wnt 信号通路、Hedgehog信号通路、Notch 信号通路等多个下游通路[22],比较复杂。其中,Wnt 蛋白是一组分泌型糖蛋白,是促进成骨细胞分化和活性的重要调节因子[23]。 (2)MAPK 信号通路:该通路属于关节软骨损伤的重要信号传导通路[24],能够影响成骨细胞的分化和凋亡[25]。 (3)PI3K-Akt 信号通路:该通路属于调节自噬的经典通路,参与调节关节软骨细胞的平衡[26],已被证实与血管修复再生、成骨细胞和破骨细胞分化密切相关[27]。 由此预测,ICA 可通过ALB、AKT1、MAPK9、IGF1、EGFR 等靶点作用于癌症、MAPK、PI3K-Akt 等通路调控SANFH 的发生。
为进一步研究网络药理学预测的科学意义,对MAPK 通路的靶点进行验证,采用甲泼尼龙联合LPS 的方式诱导SANFH 大鼠模型,并予以ICA 灌胃处理。 动物药理实验结果显示:与空白组相比,模型组大鼠BMD、Tb.Th、Tb.N 和Tb.Sp 指标差异均具有统计学意义(P<0.05),p-ERK1 蛋白表达显著降低(P<0.05),p-p38 蛋白和p-JNK 蛋白显著升高(P<0.05);与模型组相比,ICA 组大鼠BMD、Tb.Th、Tb.N和Tb.Sp 均具有统计学意义(P<0.05),p-ERK1 蛋白表达显著升高(P<0.05),p-p38 蛋白和p-JNK 蛋白显著降低(P<0.05)。 既往研究发现,ICA 具有改善骨代谢和增强骨密度与强度的作用[28],同时ICA 可作为细胞外因素刺激MAPK 信号通路进行成骨分化[29]。MAPK 家族主要包括ERK、p38、JNK。 WAN 等[30]研究证实ERK 的激活或抑制可以调控成骨分化。在成骨分化过程中,调控p38 相关通路有助于促进成骨细胞功能表达和体内骨矿化[31]。 JNK 相关通路与ERK 和p38 通路存在相互作用和密切联系,是机体细胞代谢过程中重要的调节点,在成骨细胞分化中发挥着重要作用[32]。 YOON 等[33]研究发现JNK 相关通路是软骨细胞代谢过程中重要的调控环节。 结合实验结果说明,ICA 能够提高骨密度,同时具有促进成骨细胞生成,从而对SANFH 发挥治疗作用,证明了ICA 对MAPK 通路是存在作用的。
综上所述,本次研究采用网络药理学结合动物药理实验的方法证实了ICA 经MAPK 信号通路治疗SANFH 的作用机制,具有一定的应用价值,且课题组将在后续研究中会使用不同浓度的ICA,深入研究其治疗SANFH 的作用机制,从而更好地为药物的研发提供新思路。

