棕榈酰化修饰的NOD2在失血性休克动物模型中的作用
谷子,唐勇,周程继,郑强
失血性休克(hemorrhagic shock,HS)及组织再灌注时会产生大量的氧自由基,后者可作为信息分子广泛激活炎症系统[1],促使大量炎性细胞在内脏组织中聚集,并产生大量的细胞因子、趋化因子及其他炎性介质,引起循环衰竭和器官损伤[2],其中最早且最典型的便是引起急性肺损伤(acute lung injury,ALI)[3]。核苷酸结合寡聚化结构域2(nucleotidebinding oligomerzation domain 2,NOD2)通过模式识别受体(pattern recognition receptors,PRRs)识别损伤相关分子模式,诱导多种炎性介质和生长因子的释放[4]。HS时,高 迁移 率 族 蛋 白B1(high mobility group protein B1,HMGB1)诱导增强NOD2的表达,通过激活核因子(NF)-κB而促使细胞释放炎性因子[5]。细菌免疫时,HMGB1诱导增强NOD2的表达,增强表达的NOD2需在棕榈酰基转移酶ZDHHC5的调控下产生棕榈酰化修饰的NOD2,NOD2识别并诱发细胞内NOD2介导的免疫应答,通过激活NF-κB促使细胞释放炎症因子[6]。不同的是,细菌免疫时NOD2还需经ZDHHC5的调控产生棕榈酰化修饰的NOD2而发挥作用。那么HS时,NOD2是否也需经ZDHHC5的调控产生棕榈酰化修饰的NOD2发挥作用?本研究拟采用定压型HS大鼠模型,探讨HS及组织再灌注时NOD2在HS及缺血再灌注时对器官损伤的作用及机制。
1 材料与方法
1.1实验材料及仪器8周龄的体质量250~300 g SPF级雄性NOD2基因敲除SD大鼠10只和普通SD大鼠30只,购自成都达硕生物科技有限公司[动物生产许可证号:SCXK(川)2020-030]。肿瘤坏死因子(TNF)-α、白细胞介素(IL)-1β、IL-6检测试剂盒购自四川迈克科技有限公司;HMGB1、ZDHHC5及NOD2检测试剂盒购自成都派克生物技术有限公司;丙二醛(MDA)、髓过氧化物酶(MPO)检测试剂盒、DAPA染色液购自武汉六合生物技术有限公司;兔源棕榈酰化修饰酶(PAT)抗体和兔源NOD2抗体购自美国Sigma公司;兔源HMGB1、ZDHHC5、NOD2一抗及鼠源β-actin一抗购自美国Santa公司;羊抗兔及羊抗鼠二抗购自上海基因科技有限公司。鼠源荧光单抗购自美国Millipore公司;抗鼠荧光二抗购自美国Invitrogen公司。ABL90血气分析仪由雷度米特公司提供;SAR-1000型动物呼吸机由世联博研(北京)科技有限公司提供。荧光显微镜购自日本Olympus公司;电泳仪、蛋白转膜装置、凝胶成像仪均购自美国Bio-Rad公司。
1.2方法
1.2.1动物分组及模型制备10只NOD2基因敲除SD大鼠,制备动物模型:使用1%戊巴比妥钠35 mg/kg腹腔内注射麻醉,固定。气管插管成功后连接呼吸机(潮气量2 mL,呼吸频率55次/min),吸入气体的氧浓度分数(Fraction of inspiration O2,FIO2)25%,通过吸入1%异氟醚来维持麻醉。外科手术分离左右股动、静脉并置管,右股动脉连接压力转换器(Pclab-530C生物医学信号采集系统),左股动脉抽血,右股静脉用于液体输注。使用加热垫和加热灯使动物体温保持在37℃。通过左股动脉失血使平均动脉压(MAP)迅速降低至(35.0±2.0)mmHg(1 mmHg=0.133 kPa),通过失血控制后维持30 min。收集血液后肝素化(肝素7.5 IU/mL),保持在35℃,并经常摇动。造模成功后设为对照组。另30只普通SD大鼠经动物模型制备(方法同上)后,按随机数字表法分为3组:空白组、anti-PAT组及anti-NOD2组,每组10只。通过股静脉通道分别给对照组予生理盐水,空白组予生理盐水,anti-PAT组予PAT抗体(1 mg/kg),anti-NOD2组予NOD2抗体(200 mg/kg),后给予4组大鼠生理盐水进行液体复苏15 min,45 min后使其MAP控制在(50.0±2.0)mmHg,并维持60 min。105 min后,予以血液回输及生理盐水复苏15 min,120 min后使其MAP控制在≥80 mmHg,并维持120 min。240 min后拔出气管插管及动静脉置管,进行血管止血并缝合切口后将大鼠放回笼内,自由饮食,24 h后采集血液标本,再将其处死并采集肺组织。
1.2.2标本处理将2 mL血液标本以3 000 r/min离心15 min,取血浆于-70℃低温冰箱保存备用。取5 g肺组织加入1 mL蒸馏水,充分研磨后,6 000 r/min离心15 min,取上清液,于-70℃低温冰箱保存备用。部分肺组织用4%多聚甲醛固定。
1.2.3血气分析在实验开始、休克初期及再灌注后2 h分别进行血气分析,包括酸碱度(pH)、氧分压[p(O2)]、二氧化碳分压[p(CO2)]、实际碳酸氢根(HCO3-)、碱剩余(BE)和乳酸(Lac)值。
1.2.4TNF-α、IL-1β、IL-6、MDA及MPO检测酶联免疫吸附测定法检测血浆TNF-α、IL-1β和IL-6水平;比色法检测肺组织MDA水平;硫代巴比妥酸(TBA)法检测肺组织MPO水平。
1.2.5Western blot法检测肺组织HMGB1、ZDHHC5及NOD2表达水平取100 mg肺组织,每组10个标本,加入蛋白裂解液,提取蛋白,用酶标仪测定蛋白浓度。随后每组取30 μg蛋白样品行聚丙烯酰胺凝胶电泳,将蛋白移至聚偏二氟乙烯(PVDF)膜,5%脱脂奶粉封 闭,PBS洗膜后,分别加入HMGB1、ZDHHC5、NOD2及β-actin一抗(均1∶1 000),4℃孵育12 h,洗膜后加入二抗(均1∶10 000),37℃孵育1 h,用化学发光剂避光反应,将PVDF膜放至暗室中曝光显影。应用Image J软件对检测结果的灰度值进行分析,以β-actin为内参照,目标蛋白与其相比进行分析。
1.2.6棕榈酰化修饰的NOD2免疫荧光分析取厚度为8 μm的脱水肺组织,用PBS洗涤3次,每次10 min。擦干后滴加0.2%Triton X-100,打孔15 min。用PBS洗涤3次,每次10 min。擦干后滴加一抗,放于湿盒中4℃孵育过夜。用PBS洗涤3次,每次10 min。滴加二抗,放于湿盒中避光孵育2 h。用PBS洗涤3次,每次10 min。滴加DAPI,室温5 min染细胞核,用PBS洗涤3次,每次10 min。擦干滴加抗荧光封片剂封片。置于显微镜下观察。
1.2.7肺组织病理分析取4%多聚甲醛固定的肺组织,乙醇脱水、二甲苯浸泡、浸蜡、石蜡包埋、切片、附贴,HE染色后由2位有经验的病理医师采用盲法对每个标本进行病理学分析。
1.3统计学方法采用SPSS 25.0软件进行数据分析。计量资料用均数±标准差(±s)表示,2组间比较采用t检验,多组间差异比较用单因素方差分析,组间多重比较采用LSD-t法。P<0.05为差异有统计学意义。

Fig.1 MAP and heart rate computer acquisition map of hemorrhagic shock model图1失血性休克模型MAP和心率电脑采集图
2 结果
2.1 失血性休克动物模型的基本资料0、30、45、120 min MAP分 别 为(132.2±17.5)、(37.6±2.8)、(53.4±2.8)、(115.5±15.6)mmHg。符合实验失血性休克各阶段建模要求,见图1。
2.2 各组血气指标比较240 min时,对照组、anti-PAT组和anti-NOD2组p(O2)均高于空白组(P<0.05);30 min及240 min时对照组、anti-PAT组和anti-NOD2组Lac水平均低于空白组(P<0.05),见表1。
2.3 各组炎性因子水平比较对照组、anti-PAT组和anti-NOD2组的TNF-α、IL-1β、MDA及MPO水平均低于空白组(P<0.05),该3组指标水平依次增高(P<0.05);对照组、anti-PAT组和anti-NOD2组的IL-6水平均低于空白组(P<0.05),且anti-PAT组和anti-NOD2组高于对照组(P<0.05),见表2。
Tab.1 Comparison of blood gas indexes between four groups表1各组血气指标比较 (n=10,±s)

Tab.1 Comparison of blood gas indexes between four groups表1各组血气指标比较 (n=10,±s)
*P<0.05,**P<0.01;a与空白组比较,b与对照组比较,P<0.05。
组别空白组对照组anti-PAT组anti-NOD2组F pH 0 min 7.39±0.01 7.40±0.01 7.39±0.01 7.40±0.01 0.655 30 min 7.21±0.01 7.21±0.01 7.23±0.01ab 7.22±0.02 2.692*240 min 7.39±0.01 7.40±0.01 7.39±0.01 7.39±0.01 1.380 p(O2)(mmHg)0 min 97.1±1.1 97.0±0.8 97.9±1.1 97.4±1.1 1.555 30 min 80.2±1.1 81.4±1.8 81.2±1.5 80.8±1.6 1.165 240 min 82.0±2.5 92.8±1.4a 94.6±1.5ab 94.0±1.9a 101.480**p(CO2)(mmHg)0 min 40.7±1.2 40.0±0.9 40.3±0.9 40.4±0.9 1.160 30 min 30.5±1.1 31.1±1.4 30.7±1.4 31.0±0.9 0.396 240 min 40.9±2.1 42.3±1.7 42.4±1.9 42.9±2.0a 1.849*组别空白组对照组anti-PAT组anti-NOD2组F HCO3-(mmol/L)0 min 23.2±0.4 23.2±0.7 23.4±0.5 23.4±0.5 0.414 30 min 13.0±0.8 13.3±1.0 13.1±0.7 13.2±1.1 0.193 240 min 20.8±0.4 21.4±0.8 21.9±1.2a 21.2±1.2 2.509*BE(mmol/L)0 min 3.5±0.3 3.6±0.3 3.8±0.3a 3.7±0.3 1.605*30 min-16.4±0.6-16.0±0.7-16.2±0.7-16.2±0.7 0.701 240 min-7.2±0.6-7.2±0.5-6.9±0.6-7.1±0.4 0.697 Lac(mmol/L)0 min 1.5±0.2 1.5±0.2 1.5±0.2 1.5±0.2 0.025 30 min 15.2±1.1 12.4±0.7a 12.6±0.8a 12.8±0.6a 27.054**240 min 14.9±1.4 5.3±0.6a 5.0±0.6a 5.3±0.4a 326.881**
Tab.2 Comparison of inflammatory factors between four groups表2各组炎性因子水平比较 (n=10,±s)

Tab.2 Comparison of inflammatory factors between four groups表2各组炎性因子水平比较 (n=10,±s)
**P<0.01;a与空白组比较,b与对照组比较,c与anti-PAT组比较,P<0.05。
组别空白组对照组anti-PAT组anti-NOD2组F TNF-α(ng/L)216.4±12.0 34.7±2.4a 141.6±3.8ab 153.8±4.7abc 1 224.163**IL-1β(ng/L)152.6±6.1 22.7±1.4a 86.5±5.7ab 91.0±4.9abc 1 168.905**IL-6(ng/L)103.1±6.0 22.2±3.3a 61.4±5.5ab 63.0±5.2ab 424.840**MDA(μmol/g)167.3±10.7 31.0±2.1a 88.2±6.0ab 103.6±8.0abc 573.928**MPO(μg/L)226.1±12.5 50.1±3.6a 127.0±6.4ab 138.2±7.0abc 797.415**
2.4 各组HMGB1、NOD2和ZDHHC5蛋白表达水平比较Western blot结果显示,对照组、anti-PAT组和anti-NOD2组的HMGB1、NOD2和ZDHHC5的表达量均低于空白组(P<0.05);该3组HMGB1、NOD2的表达量依次增高(P<0.05),见图2、表3。

Fig.2 Western blot analysis of HMGB1,NOD2 and ZDHHC5 proteins in animal model lung tissue图2动物模型肺组织的HMGB1、NOD2和ZDHHC5蛋白免疫印迹分析
2.5 各组棕榈酰化修饰的NOD2免疫荧光及病理结果肺组织棕榈酰化修饰的NOD2的免疫荧光可见,空白组棕榈酰化修饰的NOD2的免疫荧光表达量明显高于对照组、anti-PAT组及anti-NOD2组,见图3。动物模型肺组织的病理切片可见,空白组较对照组、anti-PAT组及anti-NOD2组肺泡内皮及肺泡组织破坏明显,炎性细胞浸润明显,见图4。
Tab.3 Comparison of HMGB1,NOD2 and ZDHHC5 between four groups表3各组肺组织HMGB1、NOD2和ZDHHC5表达水平比较 (n=10,±s)

Tab.3 Comparison of HMGB1,NOD2 and ZDHHC5 between four groups表3各组肺组织HMGB1、NOD2和ZDHHC5表达水平比较 (n=10,±s)
**P<0.01;a与空白组比较,b与对照组比较,c与anti-PAT组比较,P<0.05。
组别空白组对照组anti-PAT组anti-NOD2组F HMGB1 2.10±0.04 0.75±0.07a 1.26±0.20ab 1.45±0.10abc 221.503**NOD2 1.26±0.12 0.19±0.03a 0.54±0.06ab 0.65±0.06abc 365.514**ZDHHC5 1.39±0.11 1.17±0.16a 0.56±0.10ab 1.03±0.08abc 90.836**
3 讨论
3.1 NOD2与多种疾病的发生发展密切相关N样受体(N like receptors,NLRs)是模式识别受体家族中的主要受体,在NLRs家族中共有22个成员,其中最具代表性的是NOD2[7]。研究发现,NOD2基因的变异与克罗恩病(Crohn′s disease,CD)[8]和Blau综合征(Blau syndrome,BS)[9]有关。且有研究发现NOD2与动脉粥样硬化[10]、老年痴呆[11]和糖尿病[12]等多种疾病的发病机制有关。Kim等[13]提出,在肾脏缺血再灌注过程中,NOD2可诱导机体产生大量细胞因子、趋化因子及其他炎性介质,对肾脏产生损伤。还有研究指出,当HS发生时,NOD2通过激活NF-κB信号通路导致肺部炎症增加,诱发ALI[14]。ZDHHC结构域蛋白家族是一类与蛋白质翻译后的棕榈酰化修饰作用相关的蛋白,这类蛋白大多具有PAT活性。Dante Neculai团队揭示了在细菌免疫时NOD2的棕榈酰化修饰介导细胞内源性免疫损伤的重要机制,该研究指出NOD2的棕榈酰化修饰是影响其亚细胞定位及正确免疫应答功能的关键因素,并鉴定了NOD2棕榈酰化的发生位点及相应的棕榈酰基转移酶ZDHHC5,提出棕榈酰化修饰的NOD2能够识别并诱发细胞内NOD2介导的免疫损伤应答,通过激活NF-κB信号通路从而促使细胞释放炎症因子[15]。HS及组织再灌注时,组织产生大量氧自由基,氧自由基可作为信息分子广泛激活炎症系统,导致全身性炎症反应综合征。NOD2通过PRRs识别损伤相关分子模式诱导多种炎性介质和生长因子的释放。HS时,HMGB1可诱导增强NOD2的表达,通过激活NF-κB信号通路从而促使细胞释放炎性因子[16]。那么,HS时NOD2是否也需经ZDHHC5的调控产生棕榈酰化修饰的NOD2,并产生大量炎性介质,从而引起器官损伤值得深入研究。因此,本研究拟采用定压型HS大鼠模型,探讨HS及组织再灌注发生时NOD2对器官损伤的作用及机制。

Fig.3 Immunofluorescence staining results of palmitoylated NOD2 in lung tissues of four groups(×400)图3各组肺组织的棕榈酰化修饰的NOD2的免疫荧光染色结果(×400)
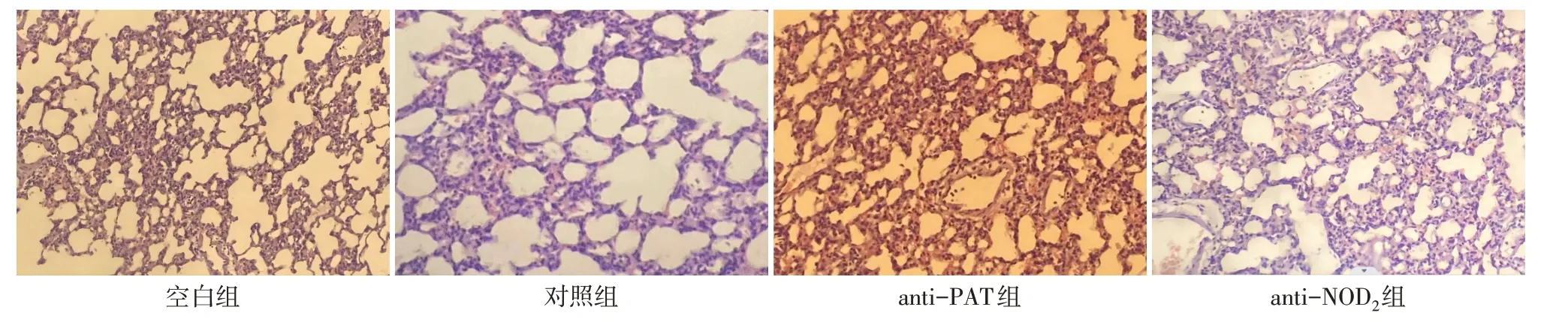
Fig.4 Pathological sections of lung tissues in four groups(HE staining,×200)图4各组肺组织病理切片(HE染色,×200)
3.2 HS及缺血再灌注时NOD2对炎性因子的影响TNF-α、IL-1β、IL-6、MDA及MPO等是目前主要的炎性因子,上述炎性因子聚集在炎症部位而发生氧化反应,进而形成大量超氧化物和氧化物,导致广泛的炎症反应,最终损伤细胞及组织器官[17]。本研究显示,对照组、anti-PAT组和anti-NOD2组的TNF-α、IL-1β、IL-6、MDA及MPO水平低于空白组,且后两组的水平高于对照组。说明当HS及缺血再灌注时,NOD2可促使TNF-α、IL-1β、IL-6、MDA及MPO炎性因子释放增加。
3.3 HS及缺血再灌注时肺组织炎性因子调控蛋白的变化HMGB1可调控核小体稳定和DNA的重组复制、修复及转录,诱导TNF-α、IL-1β、IL-6、MDA及MPO等炎性因子的释放,进而造成多种组织细胞及器官损伤[18]。本研究显示,对照组、anti-PAT组和anti-NOD2组的HMGB1的表达量均低于空白组,后2组HMGB1的表达量高于对照组。从各组血气分析及乳酸水平可以看出,240 min时对照组、anti-PAT组和anti-NOD2组的p(O2)水平均高于空白组;30 min及240 min时3组的乳酸水平均低于空白组。说明当HS及缺血再灌注时,动物模型发生了ALI。肺病理切片结果显示,对照组较其他3组肺泡内皮及肺泡组织明显破坏、炎性细胞浸润明显,更加验证了HS及缺血再灌注早期便可发生ALI。以上结果说明当HS及缺血再灌注时,NOD2可促使HMGB1蛋白的合成增加,进而增加多种炎性因子的释放,造成ALI。Western blot结果显示,对照组、anti-PAT组和anti-NOD2组的NOD2和ZDHHC5的表达量均低于空白组;后两组NOD2和ZDHHC5的表达量均高于对照组。说明当HS及缺血再灌注时,NOD2在ZDHHC5的调控下产生棕榈酰化修饰的NOD2。
综上所述,在失血性休克及缺血再灌注动物模型中,HMGB1可 诱 导增 强NOD2的表达,NOD2在ZDHHC5的调控下产生棕榈酰化修饰的NOD2,从而促使细胞释放TNF-α、IL-1β、IL-6、MDA及MPO等炎性因子,损伤肺组织。这将为临床抢救失血性休克患者,预防ALI提供参考及干预的靶点。

