大鼠心肌缺血再灌注损伤模型改良置管法*
李 睿, 王祎昕, 纪树亮, 刘坤东, 孙治中, 冯艺昕,章洁淳, 邝枣园, 卿立金, 吴 伟△
(1广州中医药大学第一临床医学院,广州 440100;2广州中医药大学基础医学院,广州 440100;3广州中医药大学第一附属医院,广州 440100)
急性心肌梗死因其高致死率和致残率的特点而成为心血管疾病的头号杀手。随着各地区各级医院再血管化措施的不断普及(包括溶栓、冠脉介入术及冠脉旁路移植术等),急性心肌梗死患者住院死亡率由最初约30%,下降至如今4.3%[1]。虽然再灌注手段对于该病疗效显著,但随着心肌梗死患者的增加和心脏介入治疗的普及,急诊介入围术期无复流现象、微循环障碍及心肌缺血再灌注损伤(myocardial ischemia/reperfusion injury,MIRI)等问题日益突出,如何进一步增加冠脉介入的获益成为当下研究热点。MIRI可引发心肌缺血期间并不存在的损伤或使已有损伤加重,是减少急性心肌梗死再灌注的治疗获益的重要因素,然而其复杂的病理生理机制和潜在的治疗靶点仍有待阐明和开发。目前,MIRI 研究最常用的模型动物为大鼠,然而,现有大鼠造模方法常存在气管插管困难、气管切开损伤大、左前降支结扎力度难以把握或线结易松动等问题,难以达到稳定的造模效果。本实验在现有大鼠MIRI 造模方法基础上进行改良,以期为MIRI 研究提供较稳定可靠的模型制备方法。
材料和方法
1 实验动物
45 只 SPF 级雄性 SD 大鼠,6~8 周龄,体重 220~250 g,由南方医科大学动物实验中心提供[SCXK(粤)2021-0041]。饲养在广州中医药大学第一附属医院SPF级屏障环境动物房[SYXK(粤)2018-0092],大鼠自由进食,环境昼夜均衡,温度23~26 ℃,湿度(50±5)%,实验动物的使用遵循3R 原则。所有实验操作均获得广州中医药大学第一附属医院实验动物伦理委员会的审批(审批号:TCMF1-2021044)。
2 主要仪器和试剂
戊巴比妥钠盐(型号57330)、2,3,5-氯化三苯基四氮唑(2,3,5-triphenyltetrazolium chloride,TTC;货号T8877)购自Sigma;伊文思蓝(Evans blue,EB;货号E6135)购自上海麦克林生化科技有限公司;多聚甲醛固定液(型号G1101-500ML)、HE 染液套装(型号G1003)和TUNEL 试剂盒(型号G1501)均购于赛维尔生物有限公司;乳酸脱氢酶(lactate dehydrogenase,LDH)测定试剂盒(型号S03034)购于深圳雷杜生命科技有限公司;肌酸激酶同工酶MB(creatine kinase isoenzyme MB,CK-MB)测定试剂盒(型号C060)购于长春汇力生物技术有限公司;大鼠心肌钙蛋白I(cardiac troponin I,cTnI)酶免分析试剂盒(货号MM-0377R1)购自江苏酶免实业有限公司;鼠恒温实验台(型号JR-30)和信号采集与处理系统(型号BL-420I)均购于成都泰盟科技有限公司;大鼠手术撑开辅助牵引器(型号10 mm 弯边)购于创博环球生物科技有限公司;麻醉咽喉镜(型号MAC0)购于江苏永乐医疗科技有限公司;台式高速冷冻离心机(型号D3024R)购于大龙仪器有限公司;U 型槽升降滑轮(型号2.5寸)购于安捷顺鼎有限公司;全自动生化分析仪(型号Chemray 240)购于深圳雷杜生命科技有限公司;数字病理切片扫描仪(型号Pannoramic MIDI Ⅱ)购于济南丹吉尔电子有限公司。
3 主要方法
3.1 实验分组 45只SD 大鼠按随机数字表法分为3 组:假手术(sham)组、垫线(即传统模型,traditional model,TM)组和改良置管(即优化模型,optimized model,OM)组,每组15 只(每组用于心肌梗死面积测定 3 只,心肌组织 HE 染色及血清 LDH、CK-MB 和cTnI 含量测定 6 只,心肌组织 TUNEL 染色 6 只)。大鼠均可自由进食,适应性饲养1 周后进行造模,术前12 h内禁食不禁水。
3.2 MIRI模型建立方法
3.2.1 垫线结扎法[2](TM 组) (1)气管插管:采用2%戊巴比妥钠对大鼠进行腹腔注射麻醉(1.5 mL/kg)后将其胸前区备皮置于恒温台,四肢连接心电电极。待心电信号稳定后,将恒温台立起,使用新生儿咽喉镜压舌抬腭,联合颈外光源照射可见咽喉声门带随呼吸开合,待吸气相声门开启时迅速将16G 的气管导管插入,成功后连接呼吸机辅助通气。呼吸机参数设置:潮气量10.0 mL、呼吸频率80 min-1,吸呼比 1∶1。(2)开胸:胸骨中点位置旁开0.5 cm 处提起皮肤,横行剪开1 cm,钝性分离皮下肌肉,使用眼科直镊于第3 肋间隙胸骨旁开0.5 cm 位置小心戳破肋间肌及胸膜,直上剪断第3 肋骨并使用止血钳扩开2~4 肋间隙切口,使用小动物扩胸器撑开胸廓,暴露心脏。(3)冠脉左前降支结扎:用少量湿润棉絮别开肺部,小心扯开心包膜,在肺动脉圆锥与左心耳交界处直下2~4 mm 处,在向左侧旁开2 mm 的位置使用穿有5-0 缝合线的4×6 mm 圆针进针,走向垂直于肺动脉圆锥与左心耳交界延长线并于肺动脉圆锥下出针,宽度2~3 mm,深度约为2 mm,穿线后提起心肌隐约可见白色细条状冠状动脉左前降支,结扎时于针线上方垫一直径为1.0 mm 适当长度的棉线并打活结,见结扎以下部位心肌发白且心电图逐渐显示ST段上抬或出现心律失常则提示定位准确。(4)再灌注:结扎完成后湿润纱布盖好胸部创口,缺血30 min后松开活结,术后无需抽吸所谓胸腔积气即可逐层关胸,拔出气管插管,将大鼠继续置于恒温台上恢复苏醒。(5)模型标准:以左室前壁心肌发白、心电图ST段抬高0.1 mV 以上为缺血标志;再灌注时左室前壁缺血心肌部分恢复红润,心电图ST 段下降50%以上,即再灌注损伤造模成功。
3.2.2 改良置管法[3](OM 组) OM 组在 3.2.1 第(3)步穿过冠脉左前降支后取出针头,将线两端穿过一聚乙烯管(如采血针管),长度约0.5 cm,继而借助12×5 mm 圆针于进针口处旁开约0.5 cm 处垂直往上依次穿过肋间肌、胸大肌直至皮肤,弃针头,上端缝线打死结,借助拉钩、滑轮及数个充满水的2 mL 离心管拉直缝线(其中滑轮距大鼠心脏垂直距离约15 cm,拉钩线长约8~10 cm 且与大鼠心脏平面约成60°角),可见心电图ST 段立即抬高至R 波的1/2 以上,稳定后创口覆盖湿润盐水纱块。其余步骤同3.2.1。见图1。
3.2.3 假手术法(sham 组) 假手术除在3.2.1 中第(3)步是只穿线不结扎,其余步骤与3.2.1 相同,因其执行假手术,故心电图ST段应无明显变化。
上述各组大鼠于再灌注90 min 末,经相应处理后采用腹主动脉失血休克法处死并取材检测。
3.3 监测造模过程心电图变化 通过观察并记录Ⅱ导联心电图,监测大鼠插管前后、结扎前后及再灌注时的心电图表现,观察并记录大鼠心电图有无心律失常现象。

Figure 1. The optimized method for MIRI modeling in rats. A and B:endotracheal intubation with neonatal laryngoscope;C:cut the skin horizontally;D:after passing through the left anterior descending artery and tying a slip knot,the left myocardium can be seen white;E and F:the ligature is passed through a 0.5 cm long polyethylene tube;G and H:hook the ligature through the skin with the help of hooks and pulleys.图1 大鼠MIRI模型改良置管法
3.4 大鼠心脏缺血/梗死面积观察 再灌注90 min末麻醉大鼠,再次结扎冠脉左前降支后腹腔静脉注射2 mL 2%EB,待周身蓝染后迅速摘取心脏,清洁灌洗并冷冻后,使用心脏切片槽将结扎以下部位切割呈5片,每片厚度2 mm。将切片放置1%TTC溶液中37 ℃避光孵育约15~20 min后多聚甲醛固定过夜;数码相机拍照后使用ImageJ 软件分析。白色为梗死区域(infarction area,IA),非蓝色区域为缺血区(area at risk,AAR)。梗死面积(%)=IA/AAR;缺血面积(%)=AAR/左心室区(left ventricule,LV)。
3.5 心肌酶学指标检测 再灌注末大鼠经腹主动脉取血,静止并分离血清后,采用全自动生化仪检测血清LDH 和CK-MB 活性,并按照说明书采用酶联免疫吸附试验检测血清cTnI含量。
3.6 心脏组织损伤病理染色及观察 造模完成后取材并将组织于4%多聚甲醛固定24 h。依次入梯度乙醇、醇苯混合液、二甲苯,观察至充分透明。烤片整修,组织膜放在45 ℃的水中展开,用多聚赖氨酸载玻片捞片,二甲苯脱蜡、梯度乙醇水化,放入苏木素染色,水洗,放入伊红染色30 s,依次梯度乙醇脱水、二甲苯脱蜡至透明,后用中性树胶封片,显微镜下观察并拍片。
3.7 心脏组织细胞凋亡染色 预冷0.9%氯化钠液清洗缺血区心肌组织,置于4%多聚甲醛固定8 h 后脱水包埋切片。按TUNEL 试剂盒方法进行操作,最后采用DAPI 染料染核。荧光显微镜拍照并使用ImageJ软件计算心肌组织细胞凋亡率。
4 统计学方法
所有数据均采用SPSS 24.0 进行统计学处理。计量资料符合正态分布的以均数±标准差(mean±SD)进行统计描述;对于多组资料符合正态分布的数据采用单因素方差分析,多重两两比较采用LSD 法(方差齐)或邓尼特T3 法(方差不齐)检验。以P<0.05 为差异有统计学显著性。采用GraphPad Prism 8.0软件进行图表制作。
结 果
1 改良置管法造模过程心电图表现
OM 组大鼠心电图ST 段可在数分钟内迅速显著抬高,并持续至缺血30 min,偶发严重室性心动过速或心室颤动,造模存活12只,造模成功12只,存活率80%,模型成功率为80%。TM 组大鼠心脏结扎10 min 后,心电图ST 段开始逐渐抬高,并在缺血30 min内持续抬高,较少出现室性心律失常,造模存活14只,造模成功9 只,存活率93%,造模成功率为60%。在各造模时点,OM 组心电图ST 段抬高幅度均较TM组更显著,且迅速达到峰值,见图2。
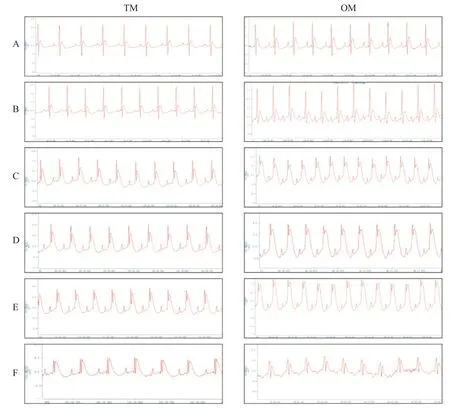
Figure 2. Comparison of electrocardiograms of different modeling methods. A:after anesthesia;B:after endotracheal intubation;C:10 min after ligation;D:20 min after ligation;E:30 min after ligation;F:reperfusion for 90 min.图2 不同造模方法的心电图比较
2 改良置管法对大鼠心肌梗死面积的影响
各组非蓝区域比例无显著差异,表明结扎定位稳定且一致性良好;TM 组和OM 组大鼠心梗面积比例均显著高于sham 组(P<0.01),且OM 组心梗面积比例显著高于TM组(P<0.01),见图3、4。

Figure 3. The optimized method(OM)increased myocardial infarction area in rats. The representative images of Evans blue/TTC staining in myocardial tissues(scale bar=2 mm).图3 大鼠心脏伊文思蓝/TTC染色

Figure 4. Comparison of cardiac ischemia/infarct size of rats in each group. A:the ratio of area at risk(AAR)/left ventricule(LV);B:the ratio of infarction area(IA)/AAR. Mean±SD. n=3.**P<0.01 vs sham group;##P<0.01 vs TM group.图4 各组大鼠心脏缺血/梗死面积比较
3 改良置管法对大鼠血清LDH、CK-MB和cTnI的影响
TM 组和OM 组血清心肌酶学指标水平(LDH、CK-MB、cTnI)均较假手术组升高(P<0.01),且OM组上述心肌酶学指标水平均显著高于TM组(P<0.05),见图5。

Figure 5. The optimized method(OM)increased the levels of myocardial injury markers in rats. A:the level of serum lactate dehydrogenase(LDH);B:the level of serum creatine kinase isoenzyme MB(CK-MB);C:the level of serum cardiac troponin I(cTnI). Mean±SD. n=6.**P<0.01 vs sham group;#P<0.05,##P<0.01 vs TM group.图5 各组大鼠血清心肌酶水平比较
4 改良置管法对大鼠心脏组织损伤的影响
HE染色结果显示,sham 组显示心肌细胞纤维排列整齐、肌节清晰紧密,大小一致,形状规则;TM 组可见部分心肌细胞紊乱、心肌纤维断裂,间质水肿和白细胞浸润;OM组上述病理损伤较TM组严重,大部分心肌细胞肿胀变形,肌丝断裂,组织间隙水肿和白细胞浸润较明显,见图6。
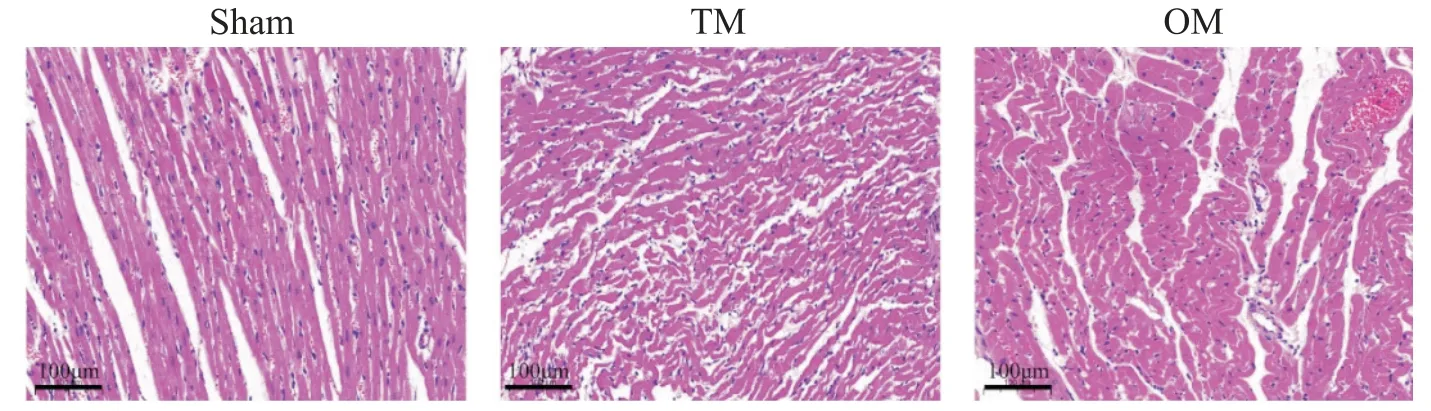
Figure 6. The optimized method(OM)increased the extent of myocardial tissue injury. The representative images of HE staining in cardiac tissues(scale bar=100 μm).图6 大鼠心肌组织HE染色
5 改良置管法对大鼠心脏组织细胞凋亡的影响
TM 组和OM 组心肌组织细胞凋亡率均显著高于sham 组(P<0.01),且 OM 组 平 均 细 胞 凋 亡 率(35.86%)显著高 于 TM 组(26.48%;P<0.01),见图7。

Figure 7. The optimized method(OM)aggravated the apoptosis of myocardial tissue in rats. The representative images of TUNEL staining in heart tissues(scale bar=100 μm;blue showed the nuclei of total cells)and the calculation of apoptotic rate.Mean±SD. n=6.**P<0.01 vs sham group;##P<0.01 vs TM group.图7 大鼠心肌组织TUNEL染色
讨 论
MIRI疾病动物模型在MIRI研究中至关重要,虽然使用大型哺乳动物如小型猪、比格犬等进行MIRI模型制作似乎更类似人类发病及其病理生理过程,但大鼠、小鼠等啮齿类动物不仅与人类基因高度同源,且价格相对低廉、易获得,故成为MIRI 造模的首选动物类别。目前,大鼠MIRI 造模方法可分为体内模型和离体心脏模型(Langendorff 体外循环模型),由于体内模型受到整体内分泌、神经、免疫等系统调节的影响而更贴近实际损伤情况,故多被采用。常规大鼠MIRI 造模过程包括:气管切开插管接小动物呼吸机辅助通气,切开皮肤,剪断3、4 肋骨开胸,定位结扎部位,使用相应针线钩起左前降支结扎,一段时间后松开结线以实现再灌注[2]。在此过程中主要难点有:机械通气、开胸创口、结扎定位和结扎线松紧程度。
1 机械通气
常规采用气管切开插管进行辅助通气,这种做法创伤大,造模后易因气管缝合困难而发生呼吸困难或严重感染。目前有方法选择气管内插管,虽然其创伤较小,但顺利进行气管插管仍有一定困难,盲插易导致大鼠气管损伤、反复缺氧甚至气胸窒息[4]。甚至有方法不需要进行机械通气,采用外挤心脏方式结扎,利用极短的开胸及关胸的时间差进行冠脉结扎,这对操作者的熟练程度要求相当高,技术操作难度大[5]。本实验借助新生儿咽喉镜,在咽喉镜直视下联合颈外光源照透,见声门开启即迅速将气管导管插入,此法方便、快捷、无创伤且一次成功,极大地减少了因气管插管所造成的干扰[6-8]。
2 开胸创口
开胸操作的质量可对研究结果造成直接影响[9]。传统方法多采用纵向切开方式,剪断胸大肌、肋间肌并至少2 根肋骨以较大创口暴露心脏并极易损伤动脉。本研究采用1.0 cm横向切口并钝性分离肌肉、肋间肌,只需剪断第3 肋骨并借助小动物开胸器即可完整暴露心脏,缩小了手术创口,最大程度避免肋间动脉损伤而造成出血并增加了关胸时组织缝合的紧密度。
3 冠脉左前降支定位
MIRI 模型组的心脏需要有显著的梗死区域,同时也不能导致缺血区内心肌完全死亡。因为如果模型组心肌梗死面积比例非常小或非常大,那么任何干预措施的挽救范围和实现心脏保护的可能性都微不足道[10]。在一定缺血再灌注时间内诱导相对足够心肌梗死区域的结扎策略对于心脏保护药物的研究较为关键。有文献报道冠状动脉常伴行静脉,沿静脉下往宽处结扎即可,但因冠状动脉走形变异性较大,此法常难以定位准确。虽然大鼠冠状动脉常隐藏于心肌浅肌层下难以识别,但往往从肺动脉圆锥和左心耳之间发出,故结扎部位常选择在左心耳和肺动脉圆锥间往下2~4 mm处[11-12]。本研究进针后轻提起心肌可见白色细条线状血管,若扎下第一个十字结可见其下供血的心肌发白,心电图ST 段抬高,则表明冠脉左前降支结扎定位准确。
4 结扎方式
常规MIRI 造模常因结扎打死结而再灌注时使用手术尖刀挑线难免伤及心肌组织造成大出血,或因拉扯结线切断冠状动脉而造成永久梗死无法再通。而垫管或垫线结扎法则是为避免再灌注时因解开结线损伤心肌而设,有报道显示其成模率80%~90%左右[11,13-15]。但实际操作过程中需要长期积累手感,常因结扎松紧程度难以精确把握,或活结没扎紧,或扎有软管、鱼丝线、棉线等线结易随心脏搏动而出现松动等情况,导致造模效果不确切,梗死区域难以统一或达到研究要求。
本方法参考 Kim 等[3]关于小鼠 MIRI 的造模方法并进行调整,采用穿管法将线两端穿过一长约0.5 cm 的聚乙烯管并将线两端经过胸壁肌肉穿出皮外,采用滑轮、拉钩吊起使软管上端顶住胸壁而下端压向心脏造成冠脉血流中断,因为有持续的外部拉力,在心脏缺血过程中不易因线结松动而造成结扎效果不确切。本方法相较于熟练的垫线结扎法,心电图ST段短时间内即可抬高至峰值并保持不回落且心梗面积范围更大,可见其缺血效果确切;在心肌损伤效果上,本方法心肌酶学指标水平较TM 组更高,且心肌组织损伤更明显,心肌细胞凋亡率达到35.86%,显著高于TM 组的26.48%,表明采用本方法进行大鼠MIRI 造模可获得更充分可靠的缺血再灌注损伤效果。
然而,本方法仍有其难点或不足之处:(1)聚乙烯管的穿出胸壁的位置需要调整好以确保牵拉时软管下端能垂直压向心脏,从而直接压迫冠脉造成缺血;(2)牵拉的强度不能太大,一般为5 个装满水的2 mL 离心管的重力,强度太大易诱发室性心律失常;(3)若观察牵拉后未出现ST 段抬高,若冠脉左前降支定位无误,则可调整软管下端位置使其垂直压向心肌,否则应重新定位;(4)MIRI 时由心脏交感神经激活触发的室性心律失常与心肌梗死程度有关[16-17],本方法的致死性室性心律失常的发生率稍高,考虑可能与其相对严重的心肌梗死和组织损伤有关。如借助其他仪器如光纤氧测量系统检测局部心肌氧含量变化,则有助于模型缺血程度的监测和定量化[18]。
总之,采用改良置管法进行MIRI 造模采提高了技术操作的简易性,减少了心脏外组织损伤及相关干扰因素,提高了模型的稳定性和可靠性,值得在MIRI模型中应用推广。

