sirtuins对心肌能量代谢影响的研究进展*
聂 彤 , 王 笑 ,2, 倪晶宇
(1天津中医药大学,天津 301600;2天津中医药大学第一附属医院,国家中医针灸临床医学研究中心,天津 300380)
心血管疾病是造成我国居民死亡的主要原因,约占总死亡人数的40%[1],并且由于我国人口老龄化程度日益加剧,心血管疾病的患病率将会呈现逐年增加的趋势[2]。随着对心血管疾病病理机制研究的不断深入,临床用于心血管疾病的药物和方法也逐渐增加,但心血管疾病的发病率和入院率仍然居高不下,因此现阶段仍需要更加深入探索心血管疾病的发生发展机制并发展新的治疗策略。自2004 年提出心肌能量代谢重构的概念后[3],改善心肌细胞能量代谢被认为是治疗心血管疾病的关键环节,领域内研究者对此开展了诸多有益探索。唐斌等[4]对大鼠进行腹主动脉缩窄手术建立心力衰竭模型,给予黄芪甲苷治疗,观察到长链脂酰辅酶A 脱氢酶表达增加,而6-磷酸果糖激酶1 表达下降,黄芪甲苷可能从改善心肌能量代谢障碍方面抑制了慢性心力衰竭的进一步恶化。
sirtuins 是酵母沉默交配型信息调节因子2(silent mating type information regulator 2,Sir2)蛋白在哺乳动物中的同源蛋白家族,是生命体中广泛存在的一类依赖于烟酰胺腺嘌呤二核苷酸(nicotinamide adenine dinucleotide,NAD+)的组蛋白脱乙酰酶,经多条途径直接或间接地参与调节能量代谢[5-6]。近年研究显示,sirtuins 可通过调节脂肪酸代谢和葡萄糖代谢来响应能量水平的变化,是控制能量稳态网络的关键调节器,并且在多种心血管疾病中观察到sirtuins 表达降低。本文就sirtuins 对心肌能量代谢的影响进行综述。
1 sirtuins简介
1.1 sirtuins 的结构及细胞定位 sirtuins 是生命体中广泛存在的一类依赖于NAD+的组蛋白脱乙酰酶,其家族成员从原核生物到真核生物高度保守,都具有高度保守的NAD+结合域和核心催化域,以及长度和序列可变的N 端和C 端。通过X 射线晶体学方法对多种来源sirtuins 的三维结构进行分析,结果显示sirtuins 的三维结构包含一个较大的Rossmann 折叠结构域和一个较小的结构更多样化的锌结构域,将两个域连接起来的辅助因子结合环在大小结构域之间形成一个裂口,NAD+和其它底物结合于裂口中[7]。小结构域的多样性可能在调节蛋白质相互作用中发挥作用,对底物特异性、酶定位和酶活性的调节都很重要。除催化核心域外,sirtuins 的N 端和C 端在长度、序列和二级结构上均不相同,它们之间的差异也影响着其结合底物、定位和活性。
哺乳动物体内共有7 种sirtuins(即SIRT1~7),分布在不同亚细胞层中,每种sirtuin 蛋白都包含有助于其细胞定位的初级氨基酸信号序列。SIRT1、SIRT6 和SIRT7 的核定位信号使它们主要在细胞核中表达;SIRT3、SIRT4 和 SIRT5 含有 N 端线粒体靶向序列,被认为定位于线粒体基质;SIRT2 主要存在于细胞质,但其亚细胞定位不固定或不在固定表达的位置发挥作用,这可能取决于细胞类型、应激状态和分子间相互作用[8](图1)。

Figure 1. Celluar localization of sirtuins(by Figdraw). There are 7 isoforms of sirtuins in mammals,SIRT1 to SIRT7.SIRT1,SIRT6 and SIRT7 are mainly expressed in the nucleus. SIRT3,SIRT4 and SIRT5 contain N-terminal mitochondrial targeting sequences,which are located in the mitochondrial matrix. SIRT2 is predominantly found in the cytoplasm. They remove acetyl(Ac)from acetylated proteins.图1 sirtuins的细胞定位(由Figdraw绘制)
1.2 sirtuins 酶活性 sirtuins 是底物特异性的蛋白质脱乙酰酶,它们通过一种独特的酶促机制从底物蛋白靶点赖氨酸残基ɛ-氨基上去除乙酰基,得到去乙酰化的蛋白产物、烟酰胺和2-O-乙酰基-ADP-核糖[8]。哺乳动物sirtuins 中被研究最多的成员是SIRT1,其脱乙酰酶活性较强且蛋白靶点较多,如过氧化物酶体增殖物激活受体γ 辅激活因子1α(peroxisome proliferator-activated receptor γ coactivator-1α,PGC-1α)[9]、叉头框蛋白 O1(forkhead box protein O1,FoxO1)[10]、叉头框蛋白 O3(forkhead box protein O3,FoxO3)[11]、p53[12]、核因子 κB(nuclear factor-κB,NF-κB)[13]、缺氧诱导因子1α(hypoxia-inducible factor 1α,HIF1α)[14]等;SIRT2 和SIRT3 的脱乙酰酶活性也较强,而SIRT4、SIRT5、SIRT6和SIRT7的脱乙酰酶活性较弱或检测不到,SIRT4主要表现为核糖基转移酶活性[15]。除脱乙酰酶活性外,SIRT5还具有去甲基化酶活性和去琥珀酰化酶活性,SIRT6 和SIRT7 还具有核糖基转移酶活性;随着研究的深入,也检测到SIRT7的去琥珀酰化和去戊二酰化酶活性[16],但其功能还有待探索。sirtuins通过多种途径延缓心血管疾病的发展,例如减轻氧化应激[17]、调节线粒体的生物合成[18]、调控转录和翻译[19]等,进而维护心脏的正常功能。
2 sirtuins对心血管疾病能量代谢的影响
心脏能量代谢最显著的特征是应对各种刺激时表现出的代谢灵活性,即心脏可以利用不同的底物,包括碳水化合物(主要是葡萄糖)、脂肪酸、氨基酸和酮体等,在慢性病理生理条件下,重塑代谢途径,以保障心肌能量供应和维持收缩功能[20-22]。在正常情况下,心脏所需ATP 主要由线粒体氧化磷酸化提供,其主要代谢底物为脂肪酸[20-21];当心血管疾病发生时,心肌线粒体动力学剧变和功能障碍[22-26],导致其氧化代谢能力降低,发生代谢重编程,代谢底物由脂肪酸转向葡萄糖以及其它代谢底物[22,27]。研究显示在疾病早期增加糖酵解对心脏具有保护作用,但糖酵解分支代谢途径也会增多,长此以往,造成氧化还原应激增加,加剧左心室扩张和心功能障碍等[27]。而sirtuins可以调节底物利用,激活多种代谢途径,改善线粒体功能,从而发挥防治心血管疾病的作用。
2.1 sirtuins 影响心肌底物摄取 心肌细胞摄取代谢底物是心脏能量代谢的第一步,摄取和代谢失衡会导致底物代谢不完全和有害代谢产物堆积,进而造成心肌损伤和收缩功能障碍。因此,影响代谢底物摄取是调控心肌能量代谢的重要环节。心肌细胞摄入游离脂肪酸和外源性葡萄糖需借助相应的转运蛋白载体,运载游离脂肪酸和葡萄糖进入心肌细胞,因此影响相关转运蛋白载体的含量或活性可以调控心肌底物摄取,进而影响细胞能量代谢[28-29]。心脏中AMP/ATP 比值增加能激活AMP 活化蛋白激酶(AMP-activated protein kinase,AMPK)-SIRT1 信号途径,使PGC-1α 蛋白乙酰化水平降低,进而促进过氧化物酶体增殖物激活受体α(peroxisome proliferatoractivated receptor α,PPARα)进入细胞核,使脂肪酸转位酶CD36移位到细胞膜,从而促进游离脂肪酸摄取[30]。用棕榈酸(palmitic acid,PA)诱导H9c2 心肌细胞脂毒性和能量代谢失衡,CD36 和葡萄糖转运蛋白4(glucose transporter 4,GLUT4)代谢途径蛋白表达减少;经白藜芦醇激活SIRT1,并用蛋白激酶Cζ(protein kinase Cζ,PKCζ)的小干扰RNA(PKCζ 可激活GLUT4运载葡萄糖进入心肌细胞)处理H9c2细胞24 h,结果显示CD36 代谢途径相关蛋白表达显著增加,GLUT4 代谢途径相关蛋白表达降低,证明了SIRT1可以作为调节代谢通路开关的关键点,影响心肌能量代谢重塑,从而达到提高心脏代谢效率的目的[30](图 2)。
2.2 sirtuins 对心肌底物利用的影响 心脏对能量的需求极其严格,需要源源不断的ATP 维持其正常功能,一旦缺血缺氧,导致底物和氧气供应不足,抑制心脏氧化代谢,并激活糖酵解以节省有限氧气的使用[31]。当心肌缺血再灌注(ischemia reperfusion,I/R)时,缺血导致代谢异常甚至停止,再灌注过程快速激活代谢途径,从而造成代谢紊乱。缺血45 min 后再灌注6 h[32],观察到葡萄糖氧化代谢逐渐活跃,但过量的葡萄糖氧化代谢会导致活性氧(reactive oxygen species,ROS)产生增加和还原剂NAPDH 减少,引起氧化损伤,导致ATP 供应不足,加重心肌组织损伤[33];同时,NOD 样受体蛋白 3(NOD-like receptor protein 3,NLRP3)炎症小体以ROS 依赖的方式被激活,诱导心肌细胞焦亡,造成心脏功能障碍。SIRT1激动剂可降低丙酮酸脱氢酶(pyruvate dehydrogenase,PDH;控制葡萄糖氧化代谢速率的酶)活性,降低葡萄糖氧化代谢能力,减少ROS 和NLRP3 产生,从而保护心脏免受I/R 损伤。由此可见,SIRT1 可以在病理状态下平衡代谢变化,减少心肌损伤(图2)。
心脏内外血管的完整性、灌注和功能有赖于不同类型细胞的相互作用,除心肌细胞外,心肌成纤维细胞、炎症细胞及内皮细胞等非心肌细胞也起到了重要作用。其中内皮细胞是心脏间质细胞中数量最多的细胞类型,在心血管疾病发生发展过程中发挥了重要作用[34]。采用内皮细胞SIRT3敲除小鼠和主动脉缩窄(transverse aortic constriction,TAC)诱导心衰小鼠探究SIRT3 对心脏功能的影响[35],结果显示内皮细胞SIRT3缺失会加重心肌肥厚和收缩功能障碍,并导致GLUT1、GLUT4 及糖酵解酶表达减少;在内皮细胞SIRT3缺失的情况下,血管新生功能受到损害,促血管新生因子apelin增加心肌血管生成并缓解心力衰竭的作用被抵消;由此可见,内皮细胞SIRT3表达增加可提高心肌葡萄糖代谢效率,改善心脏功能(图2)。
2.3 sirtuins 对心肌线粒体功能的影响 线粒体为心脏持续产生ATP 提供了保障,约占心肌细胞总体积的45%[36]。病理状态下,线粒体结构和功能会出现异常[16-19]:(1)线粒体肿胀、线粒体嵴密度降低等;(2)与呼吸链和ATP 合成相关的线粒体功能逐渐下降,例如电子传递链解偶联、ROS 产生增加、细胞ATP 池的消耗,以及广泛的细胞损伤和心肌细胞凋亡;(3)线粒体自噬系统出现故障,导致功能障碍的线粒体积累,促进疾病的发展。因此,维持线粒体系统稳定性,使其氧化代谢功能正常,持续供给心脏ATP,是保障心脏收缩功能正常的必要条件。在脂多糖处理心肌细胞后[37],降低SIRT3表达能使AMPK失活,线粒体生物发生钝化,造成线粒体氧化代谢能力降低,线粒体生成ATP 减少,ROS 产生增加,最终导致心肌细胞受损和收缩功能障碍;相反,过表达SIRT3 会增加AMPK 活性,改善线粒体生物发生,从而维持线粒体功能。除此之外,SIRT3作为表达在线粒体中的脱乙酰酶,可通过去乙酰化而影响线粒体DNA修复相关基因的表达,降低心肌I/R期间的线粒体凋亡[38],阻止线粒体裂变等[39]。SIRT1作为线粒体完整性的主要调节器,它可直接调控PGC-1α[40-41],与核因子 E2 相关因子 1/2 相互作用[42],促进线粒体的生物发生。人参皂苷Rc 是SIRT1 的激活因子,可以通过激活SIRT1-PGC-1α 通路,在不增加ROS 生成的情况下,促进线粒体生物合成,进而改善心脏功能[43](图2)。
线粒体活性由细胞核DNA 和线粒体DNA 编码的蛋白质共同控制。线粒体稳态的一个关键调节器为SIRT7[44],它的缺失导致小鼠多系统线粒体功能障碍,表现为血乳酸水平升高、运动能力降低、心功能障碍等。SIRT7 通过去乙酰化核编码线粒体基因的主要调节因子GA 结合蛋白(GA-binding protein,GABP)β1,促进其与GABPα 形成复合物,进一步激活GABPα/GABPβ 异四聚体转录,从而维持线粒体结构和功能的稳定(图2)。
3 总结与展望
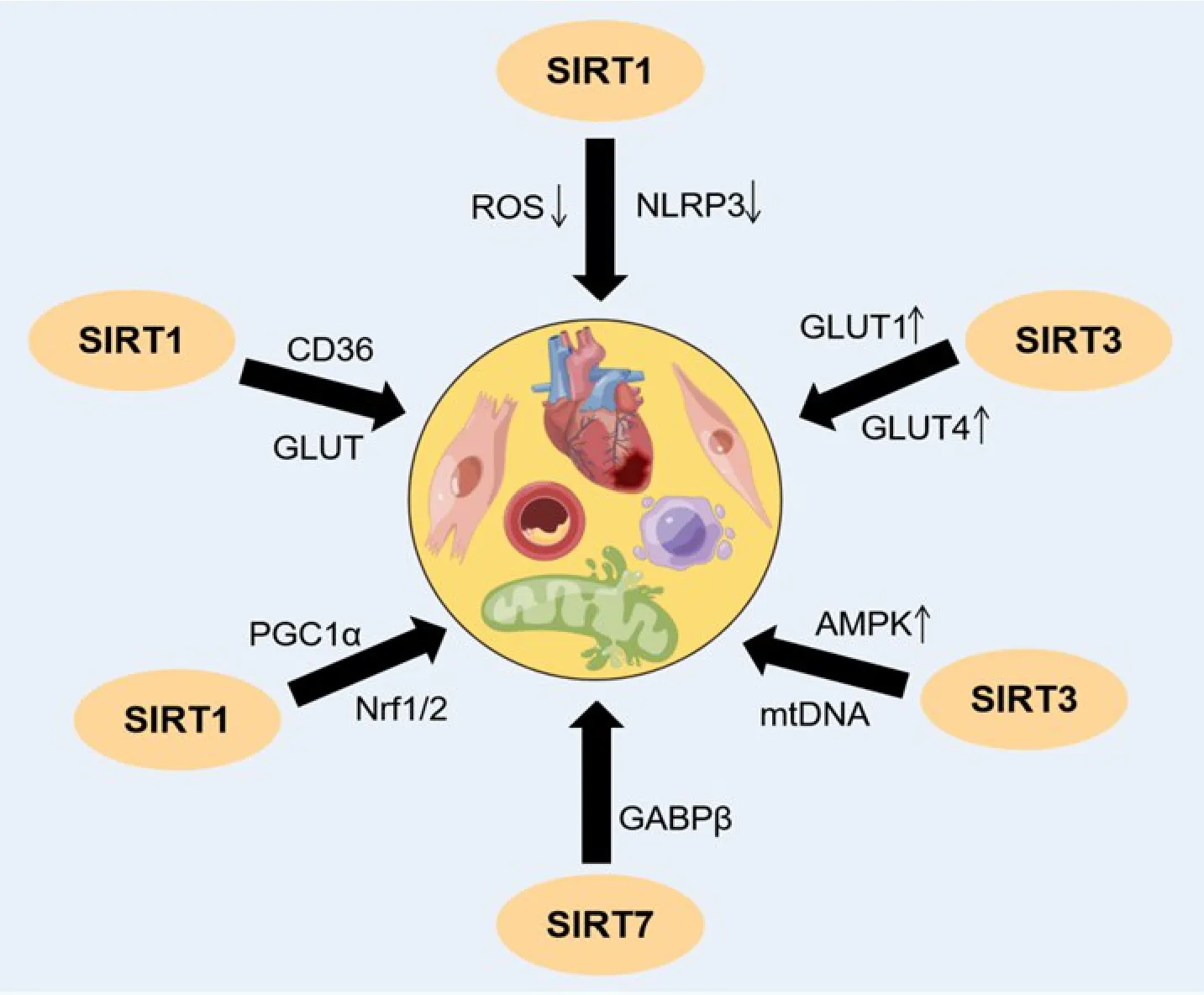
Figure 2. Effects of sirtuins on myocardial energy metabolism(by Figdraw). SIRT1 regulates metabolic pathway switch,CD36 and glucose transporter 4(GLUT4),to improve myocardial lipotoxicity and energy metabolism imbalance. It protects the heart from ischemia-reperfusion injury by reducing pyruvate dehydrogenase(PDH)activity,glucose oxidative metabolism,and reactive oxygen species(ROS)and NOD-like receptor protein 3(NLRP3)production. SIRT3 increases AMP-activated protein kinase(AMPK)activity and improves mitochondrial biogenesis,thereby maintaining mitochondrial function. Endothelial SIRT3 mediates the increased expression of GLUT1,GLUT4 and glycolytic enzymes,which can improve cardiac efficiency. SIRT1 directly regulates peroxisome proliferator-activated receptor γ coactivator-1α(PGC-1α)and interacts with nuclear factor E2-related factor 1/2(Nrf1/2)to promote mitochondrial biosynthesis without increasing ROS production.SIRT7 deacetylates GA-binding protein β1(GABPβ1)to promote its complex formation with GABPα,further activates GABPα/GABPβ heterotetramer transcription,and maintains the stability of mitochondrial structure and function.图2 sirtuins对心肌能量代谢的影响(由Figdraw绘制)
sirtuins 的结构现已清晰,其细胞定位也随着研究的深入被确定,但仍存在一定的争议,例如SIRT7被普遍认定为表达于核仁,但在细胞质中也可以检测到其存在。sirtuins 因其延缓衰老的作用而被重视,而心血管疾病又多发于老年群体中,这推动着科研工作者对sirtuins 在心血管疾病方面作用的探索,并观察到:(1)sirtuins可以通过改善心肌能量代谢延缓心血管疾病的发展;(2)能够减轻心脏氧化应激带来的不良反应[45-46](包括ROS 产生增加和抗氧化剂减少);(3)降低蛋白乙酰化水平,增强它们与DNA结合的能力,诱导抗氧化剂基因表达[47];(4)可通过维持转化生长因子β(transforming growth factor-β,TGF-β)信号通路促进心肌组织修复[48]。sirtuins 虽被观察到具有调节心肌能量代谢的作用,但相关研究有待进一步深入。此外,sirtuins具有多种酶活性,在心脏组织当中的表达也大不相同,为检测工作增加了一些复杂性,但随着科技的进步,这些困难也将迎刃而解。
综上所述,sirtuins 影响心肌能量代谢的多个环节,维持线粒体系统稳定性,并减轻心血管疾病发生发展过程中带来的其它不良影响,揭示了其家族调节心肌能量代谢的潜力。

