M2型巨噬细胞通过CCL22-CCR4信号促进肺泡上皮细胞EMT*
王 璐, 徐婷贞, 周林水, 朱渊红
[浙江中医药大学附属第一医院(浙江省中医院),浙江 杭州 310006]
肺纤维化(pulmonary fibrosis,PF)是一类由多种病因引起的,以成纤维细胞增殖、细胞外基质(extracellular matrix,ECM)沉积为特征,并伴有炎症损伤、组织结构破坏的肺实质性病变。近些年来,由于环境因素的影响和治疗手段的限制,人群中肺纤维化的发病率和死亡率呈逐年上升趋势,为社会经济和医疗卫生事业发展带来了巨大的负担[1]。
PF 发病机制复杂,至今尚未完全阐明。目前认为上皮-间充质转化(epithelial-mesenchymal transition,EMT)是引起PF 的重要因素[2];与此同时,越来越多的证据提示巨噬细胞极化所产生的不同微环境可影响EMT 的发生[3-4]。研究显示,巨噬细胞有M1和M2 两个免疫功能明确的亚群,M1 型被称为经典活化巨噬细胞,通常由LPS、IFN-γ 诱导,具有极强的吞噬功能和促炎作用;M2 型即替代活化巨噬细胞,由IL-4、IL-13 诱导分化,主要发挥抗炎、促修复的作用[4-6]。目前研究显示无论是体内抑或是体外PF 模型中,均存在巨噬细胞亚群失衡的情况,M2 型巨噬细胞过多可直接影响EMT、纤维细胞激活、胶原沉积,以及病理性重塑等环节[3-4,7],但具体机制尚未完全阐明。
C-C 基序趋化因子 22(C-C motif chemokine 22,CCL22)是一类C-C 趋化因子,又称巨噬细胞衍生趋化因子(macrophage-derived chemokine,MDC),主要由M2 型巨噬细胞释放;C-C 基序趋化因子受体4(CC motif chemokine receptor 4,CCR4)是 CCL22 的受体。此前,已有研究指出在肺纤维化疾病中,存在CCL22 和 CCR4 的差异表达[8-10],但这些研究并未将CCL22和CCR4作为整个信号轴进行研究,并且对于效应细胞和影响PF的具体分子机制均未有阐述。
本研究关注不同表型巨噬细胞,通过将无生物学特性的M0、促炎性质的M1 和抑炎性质的M2 型巨噬细胞分别与肺泡上皮细胞进行共培养,旨在明确M2型巨噬细胞可否通过CCL22-CCR4途径引起肺泡上皮细胞EMT,为进一步阐述PF 机制提供参考资料。
材料和方法
1 主要材料
人外周血的单核细胞系THP-1 和肺泡上皮细胞A549 细胞购自武汉普诺赛生命科技有限公司。1640 培养液、DMEM 培养液购自 HyClone;胎牛血清(fetal bovine serum,FBS)、PBS、胰酶和青-链霉素双抗购自Gibco;脂多糖(lipopolysaccharide,LPS)和佛波酯(phorbol ester,PMA)购自Sigma;rhIFN-γ、rhIL-4和 rhIL-13 均 购 自 PeproTech;CCR4 受 体 抑 制 剂AZD2098 购自上海陶素生化科技有限公司;CCK-8试剂购盒购自北京碧云天科技有限公司;Annexin VFITC/PI 检测试剂盒购自南京凯基生物有限公司;CCL22/MDC ELISA 试剂盒购自 Bio-Swamp;Trizol 试剂购自Invitrogen;逆转录试剂盒、实时定量PCR试剂购自ABI;引物由明琛志远生物技术(北京)有限公司合成;所有抗体购自Affinity、Abcam、Sigma-Aldrich或CST。CO2培养箱(Thermo);荧光显微镜(Olympus);酶标仪(Thermo);荧光定量PCR 仪(ABI);蛋白电泳分离、转膜和成像系统(Bio-Rad)。
2 方法
2.1 细胞培养 THP-1 和A549 细胞分别使用含有10%FBS 的1640培养液(内含1%青-链霉素双抗)和含有10% FBS 的DMEM 培养液(内含1%青-链霉素双抗),放置于37 ℃、5%CO2、饱和湿度条件下培养,隔天更换培养液,按1∶3的比例传代。
2.2 巨噬细胞亚群诱导 取处于对数生长期,生长状态良好的THP-1 细胞,以每孔5×105个接种于细胞培养6孔板中的Transwell小室,37 ℃、5%CO2培养箱中培养过夜;更换含PMA 的1640 培养液进行诱导。单核细胞组:THP-1 细胞不进行任何处理;M0 组:THP-1 细胞经 PMA(150 nmol/L)处理 72 h;M1 组:THP-1 细胞经PMA(150 ng/L)处理72 h,再经10 ng/L LPS 和 20 μg/L rhIFN-γ 处理 24 h;M2 组:THP-1 细胞经 PMA(150 nmol/L)处理 72 h,再经 20 μg/L rhIL-4和20 μg/L rhIL-13处理72 h[11-12]。
2.3 实验分组 待巨噬细胞分化成功后,实验分为5 组:正常对照(A549)组:只进行A549 细胞培养;M0共培养(A549+M0)组:上室加入M0,下室加入A549细胞;M1 共培养(A549+M1)组:上室加入M1,下室加入A549 细胞;M2 共培养(A549+M2)组:上室加入M2,下室加入 A549 细胞;M2+CCR4 抑制剂共培养(A549+M2+AZD2098)组:上室加入 M2,下室加入A549 细胞及 10 μmol/L AZD2098[13-14],根据不同实验,培养0、24、36、48或72 h。
2.4 CCK-8 检测 按照分组,取处于对数生长期,生长状态良好的A549 细胞,以每孔5×104个接种于培养板(培养液体积500 μL),放置于37 ℃、5% CO2培养箱中培养过夜;将已贴有巨噬细胞(M0、M1、M2)的Transwell 小室挪至A549 培养板中。培养24、36、48 和72 h 后,取出小室。收集细胞培养液,每100 μL 培养液加入 10 μL CCK-8 反应液,继续于培养箱内孵育1 h。收集细胞上清,用酶标仪检测各孔在波长450 nm 处的吸光度(A)值。以时间为横坐标,A450值为纵坐标,绘制细胞生长曲线。
2.5 划痕实验 使用记号笔在细胞培养板背后,均匀划横线;接种A549 细胞于37 ℃、5%CO2培养箱中培养;待细胞密度达到60%左右,铺满6 孔板底部,用200 μL吸头垂直于背后的横线划痕;PBS洗细胞3次,去除悬浮的细胞,加入无血清培养液,同时拍取0 h照片;按照分组,将贴有巨噬细胞(M0、M1、M2)的小室挪至A549细胞培养板中共培养,24和36 h后分别拍照。
2.6 Annexin V-FITC/PI双染法检测细胞凋亡 按照CCK-8 实验步骤,完成A549 细胞接种、共培养。48 h后,取出上室,用不含EDTA的0.25%胰酶消化细胞,终止消化后收集A549细胞。按照说明书,离心,清洗细胞后,加入500 μL 结合缓冲液,重悬细胞;加入5 μL AnnexinV-FITC 和 5 μL 碘化丙啶(propidium iodide,PI),混匀;室温避光反应10 min;上流式细胞仪检测。
2.7 ELISA检测细胞上清CCL22水平 共培养48 h后,收集下室培养液,离心后小心吸取细胞上清,使用人CCL22/MDC ELISA 试剂盒检测CCL22 表达水平。每个样品重复3次,取平均值,实验重复2次。
2.8 RT-qPCR 实验 使用 Trizol 提取各组 A549 细胞的总RNA,测定RNA 浓度及纯度后,采用反转录试剂,将RNA 反转录成cDNA。以此cDNA 为模板,进行 PCR 扩增:95 ℃ 45 s,60 ℃ 60 s,72 ℃ 1 min,共进行44 个循环。RT-qPCR 引物序列见表1。以18S为内参照,采用2-ΔΔCt法计算各组目的基因的相对表达水平。

表1 RT-qPCR引物序列Table 1. The sequences of the primers for RT-qPCR
2.9 Western blot 检测蛋白表达 共培养48 h 后收集A549 细胞,使用RIPA(含磷酸酶抑制剂和蛋白酶抑制剂cocktail)置冰上将细胞充分裂解,并用BCA法检测蛋白浓度;变性离心后取上清进行蛋白上样。按照Western blot 实验常规操作流程进行电泳-转膜-封闭-Ⅰ抗孵育-Ⅱ抗孵育-显影曝光。抗体信息如下:精氨酸酶1(arginase-1,Arg-1)、诱导型一氧化氮合酶(inducible nitric oxide synthase,iNOS)及CCR4抗体(Affinity),E-cadherin 抗体(Abcam),Smad2/3 和p-Smad2/3 抗体(Cell Signaling Technology),1∶1 000;α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)抗体(Sigma-Aldrich),1∶3 000;GADPH 抗体(Proteintech),1∶5 000。ImageJ 软件分析蛋白条带灰度值,计算目的蛋白的相对表达量。
3 统计学处理
采用GraphPad Prism 7 软件进行分析。计量资料用均数±标准误(mean±SEM)表示。组间均数比较采用单因素方差分析及LSD-t检验。以P<0.05 为差异有统计学意义。
结 果
1 巨噬细胞表型鉴定
光镜下观察THP-1 及各组巨噬细胞形态变化。如图1A 所示:未经处理的THP-1 细胞为圆形的悬浮细胞,不贴壁;经过PMA 处理72 h 后的M0 型巨噬细胞细胞贴壁,有小触角;经PMA 和LPS、IFN-γ处理的M1 型巨噬细胞细胞贴壁,触角长;先后经PMA 以及IL-4、IL-13处理的M2型巨噬细胞细胞贴壁,触角短,与M0组形态相近。
随后提取4 组细胞总RNA 及蛋白,进行RT-qPCR反应和Western blot检测。结果显示,与正常组相比,M0 组细胞 iNOS、IL-12β、Arg-1 和 IL-10 mRNA 表达均无显著变化;M1 组细胞 iNOS 和IL-12β mRNA表达增加(P<0.05),而Arg-1 和IL-10 mRNA 表达无显著变化;M2 组细胞则主要表现为Arg-1 和IL-10 mRNA 表达显著增加(P<0.01),见图 1B。Western blot结果同样显示了M1、M2组分别以iNOS、Arg-1蛋白显著升高为特点的改变(P<0.05),见图1C。因此,可认为M1、M2型巨噬细胞诱导分化成功。

Figure 1. Identification of macrophage phenotype. A:cell morphological changes(scale bar=50 μm);B:iNOS,IL-12β,Arg-1,and IL-10 mRNA levels were measured by RT-qPCR;C:the protein levels of iNOS and Arg-1 were assessed by Western blot. Mean±SEM. n=3.*P<0.05,**P<0.01 vs THP-1 group;#P<0.05,##P<0.01 vs M0 group.图1 巨噬细胞表型的鉴定
2 巨噬细胞对肺泡上皮细胞增殖、迁移和凋亡的影响
分别将 M0、M1、M2 型巨噬细胞与 A549 进行共培养。CCK-8 结果显示,与M0、M2 型巨噬细胞共培养 36、48 或 72 h 后,A549 细胞活力与正常对照 A549细胞无显著差异,但与M1 型巨噬细胞共培养后,A549 细胞活力显著降低(P<0.01);与M1 共培养组相比,M2 组的细胞活力显著提高(P<0.05),见图2A。根据细胞生长速度,划痕实验选择了与巨噬细胞共培养24和36 h时点,观察各组A549细胞迁移能力,结果显示:与正常对照组细胞相比,M1 共培养组的细胞迁移能力显著减退(P<0.01),而M2型巨噬细胞则可促进A549 细胞迁移(P<0.05),见图2B。凋亡实验以共培养48 h 为终点,结果显示,共培养48 h,M1 型巨噬细胞可显著诱导A549 细胞凋亡(P<0.01),而M2 型巨噬细胞则可抑制细胞凋亡(P<0.01);M0 型巨噬细胞对A549 细胞凋亡影响较小,与正常组相比无显著差异,见图2C。
3 巨噬细胞对肺泡上皮细胞形态学及EMT 表型的影响
结合CCK-8、划痕和凋亡实验结果,该实验进一步观察了共培养48 h 时A549 细胞形态学以及EMT表型的变化。如图3A 所示,光镜下,单独培养的A549 细胞为上皮样形态,细胞紧密性高;而经过巨噬细胞共培养后,细胞发生形态变化,其中以M2 共培养组变化最为显著,细胞呈细长梭形伴有间隙增大。Western blot 结果显示,与正常A549 细胞相比,M1 组E-cadherin 蛋白表达未见差异,M2 组则显著降低(P<0.01);同时,M1 组α-SMA 表达较对照组显著降低(P<0.01),而M2 组α-SMA 表达则无显著变化,见图 3B。RT-qPCR 结果显示,当 A549 细胞与 M2 型巨噬细胞共培养时,其E-cadherin mRNA 表达较正常对照细胞显著下调(P<0.01),而fibronectin mRNA 表达上调(P<0.05),见图3C。

Figure 2. Effect of different phenotypes of macrophages on the viability,migration and apoptosis of A549 cells. A:CCK-8 assay was used to detect the viability of A549 cells;B:scratch wound healing assay was used to assess the migration capacity of A549 cells(scale bar=100 μm),and the relative rates of wound closure at 24 and 36 h were shown;C:Annexin V-FITC/PI assay was used to determine the cell apoptosis,and the apoptosis rates of A549 cells co-cultured with M0,M1 and M2 macrophages for 48 h were shown. Mean±SEM. n=3.*P<0.05,**P<0.01 vs A549 group.图2 不同表型巨噬细胞对A549细胞活力、迁移和凋亡的影响
4 M2 型巨噬细胞对CCL22-CCR4-Smad2/3 通路的影响
ELISA结果显示:与正常上皮细胞组相比,M2组A549 细胞上清中CCL22 的表达量有显著升高(P<0.01)。RT-qPCR 和 Western blot 结果显示,与其余 3组相比,M2 组上皮细胞具有更高的CCR4 mRNA 水平(P<0.05)。与此同时,M2 组的CCR4 蛋白表达也显著增高,以及Smad2/3蛋白的磷酸化激活水平也上调(P<0.01),见图4。
5 抑制CCR4 后M2 型巨噬细胞对A549 EMT 的影响
Western blot 结果显示,当M2 共培养组加入CCR4 抑制剂 AZD2098 时,其CCR4 表达显著减少(P<0.01),而 EMT 表型的变化较 M2 共培养组显著逆转,即E-cadherin 的蛋白表达升高,而α-SMA 的表达降低(P<0.01),并伴有Smad2/3 磷酸化信号的显著下调(P<0.01),见图5。
讨 论
趋化因子是一类由细胞分泌的可以引起趋化反应的小分子细胞因子或信号蛋白。近些年几项转录组测序研究结果显示,趋化因子在巨噬细胞介导的PF 中占据了重要作用,例如 CCL2、CCL3(MIP-1)、CCL5、CCL17、CCL18、CCL22等[15-17]。CCL22,又称为STCP-1(刺激T 细胞趋化蛋白1),是一种新的人类CC趋化因子,表达于巨噬细胞、T细胞及NK细胞,因其主要由M2 型巨噬细胞释放,又被视为M2 型巨噬细胞标志物[18]。

Figure 3. Effects of different phenotypes of macrophages on the morphological changes and EMT of A549 cells. A:morphological changes of the cells(scale bar=100 μm);B:Western blot analysis for E-cadherin and α-SMA protein expression;C:RT-qPCR analysis for E-cadherin and fibronectin mRNA expression. Mean±SEM. n=3.*P<0.05,**P<0.01 vs A549 group.图3 不同表型巨噬细胞对A549肺泡上皮细胞形态及EMT的影响
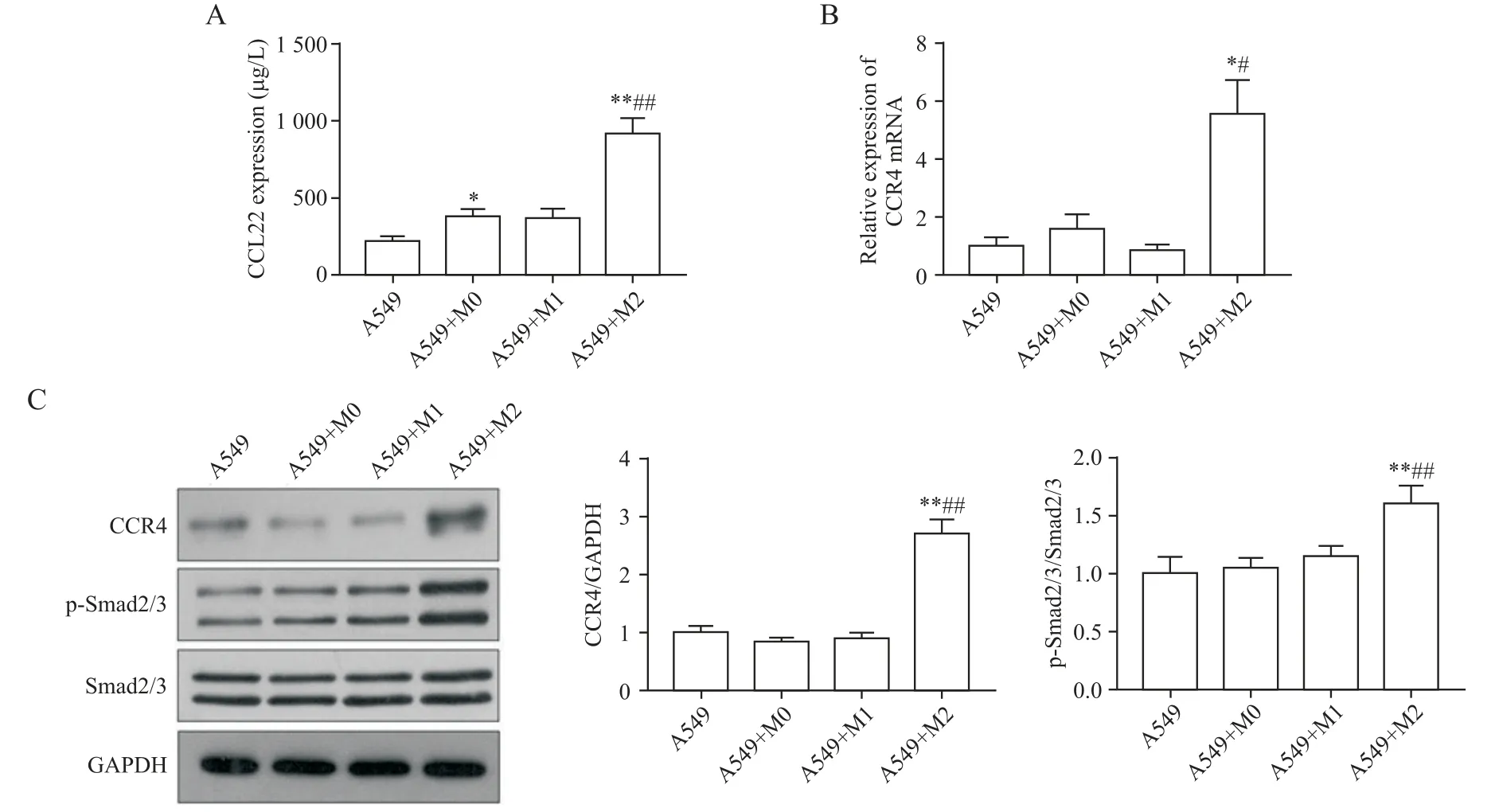
Figrure 4. The activation of CCL22-CCR4 axis and Smad2/3 signaling pathway in A549 cell co-cultured with different phenotypes of macrophages. A:ELISA analysis for the concentration of CCL22 in cell supernatants;B:RT-qPCR analysis for CCR4 mRNA expression;C:Western blot analysis for CCR4,Smad2/3 and p-Smad2/3 protein levels. Mean±SEM. n=3.*P<0.05,**P<0.01 vs A549 group;#P<0.05,##P<0.01 vs A549+M0 group.图4 不同表型巨噬细胞对A549细胞CCL22-CCR4-Smad2/3信号通路激活水平的影响

Figrure 5. The effect of CCR4 inhibitor AZD2098 on CCL22-CCR4 axis and Smad2/3 signaling pathway activation. A:Western blot analysis for CCR4,E-cadherin and α-SMA protein expression;B:Western blot analysis for Smad2/3 and p-Smad2/3 protein levels. Mean±SEM. n=3.**P<0.01 vs A549 group;##P<0.01 vs A549+M2 group.图5 CCR4抑制剂AZD2098对A549细胞CCL22-CCR4-Smad2/3信号通路活化水平的影响
关于CCL22 与肺纤维化的研究可追溯到20 世纪初期,当时就有专家指出CCL22 可能在PF 疾病中发挥作用,并在特发性肺纤维化、结节病、放射相关性肺纤维化的患者肺组织、肺泡灌洗液标本以及大鼠模型中得到了验证[8-9];另一方面,CCR4 作为CCL22 的受体,也被多次在肺纤维化临床及基础研究中观察到有差异表达,例如在特发性肺纤维化、囊性纤维化患者以及博来霉素诱导的肺纤维化小鼠中,均显示了 CCR4 水平的上调[9-10,19]。但这些研究只是简单指出了CCL22 和CCR4 在肺纤维化疾病中存在差异,并未对其作用机制及具体的效应细胞进行阐述,因此我们的研究是这部分内容的扩展。
与此同时,越来越多的证据显示,CCL22-CCR4轴在肿瘤类疾病和自身免疫相关性疾病[18,20]的EMT进程中发挥了作用,并且该过程受M2型巨噬细胞调控。例如,在多种鳞状细胞癌和新月体肾小球肾炎的研究中,学者们观察到M2 型巨噬细胞衍生的CCL22 可通过CCL22-CCR4 反应轴,有选择的趋化T淋巴细胞募集,参与疾病调控[21-22]。在肝癌的研究中,专家们也观察到CCL22 作用于肝癌细胞受体CCR4 后,可进一步激活Smad 信号通路,进而促进肿瘤细胞发生EMT,这一途径被视为M2型巨噬细胞影响肝癌转移的新机制[18]。从这些研究受到启发,我们从CCL22-CCR4 轴的角度探讨了M2 型巨噬细胞促进EMT 的分子过程,并且关注于公认的肺纤维化经典信号通路——Smad信号通路[23-24]。
我们的结果显示,与无生物学特性的M0型巨噬细胞和促炎作用为主的M1型巨噬细胞相比,当肺泡上皮细胞与M2型巨噬细胞共培养后,其上皮细胞表型逐渐向间充质表型转变,并且细胞生长、迁移能力显著提高,而凋亡水平则下降,并且纤维化相关信号通路Smad2/3 有显著激活;当我们使用CCR4 抑制剂后,可以看到伴随着Smad 信号通路的下调,EMT 过程被抑制,该研究结果较好验证了我们的设想,也是对先前研究的补充。值得指出的是,有研究表明,CCL22 虽主要由M2 型巨噬细胞分泌,但CCL22 反过来也会促进IL-13 的产生,进一步促进M2 型巨噬细胞合成[4],尽管本研究中未涉及该部分内容,但我们认为这条途径也可能是M2 型巨噬细胞共培养模型引起EMT的另一途径;同时,如果能使用博来霉素诱导的小鼠肺纤维化模型进行研究,可能对于潜在机制的阐述更有意义。
综上所述,我们的体外研究提示M2型巨噬细胞可增强肺泡上皮细胞活力、迁移能力,并抑制其凋亡,最终促进EMT,其机制可能与CCL22-CCR4-Smad2/3信号通路的激活有关。

