岩藻多糖对酒精依赖小鼠肠黏膜屏障功能及神经行为学的作用*
张 楠 , 薛美兰▲, 高海琪, 党 凯, 李捷锐 , 梁 惠
(1青岛大学基础医学院,山东 青岛 266071;2青岛大学公共卫生学院,山东 青岛 266071)
饮酒与健康是全世界人们广泛关注的热点问题,长期或过量的饮酒对身体是有害的,影响着全世界数以百万计的人,并造成巨大的经济和社会负担。酒精中毒(alcoholism)包括酒精滥用和进一步诱导的酒精依赖,是仅次于心血管疾病和恶性肿瘤居第三位的公共健康问题,常表现出对酒精无法自控,对社会功能造成严重损害。中枢神经系统作为酒精最敏感的靶点,受到酒精显著抑制。酒精可以自由通过血脑屏障,影响神经系统结构和功能。越来越多的研究证明,酒精依赖患者常表现出抑郁和认知障碍的症状[1-2]。在中枢神经系统中,过量饮酒会导致大脑氧化应激,改变神经免疫反应,损害神经再生,诱发神经炎症,导致认知衰退、运动功能障碍[3-5]。另外,海马区和大脑皮层容易受到酒精滥用影响,可能造成焦虑、抑郁、失眠和癫痫发作以及记忆和学习能力受损[6]。越来越多的研究显示,过量饮酒会使肠道微生物菌群失调,肠道通透性增加进而损伤肠黏膜屏障[7-8]。肠黏膜屏障是一个多层系统,长期和反复的酒精刺激致使肠上皮细胞之间的claudin、ZO-1等紧密连接蛋白表达降低,进而破坏肠黏膜屏障[9-10]。肠黏膜通透性增加时,细菌转移到外部肠道部位,包括血液、脾脏和肝脏,这可能导致内毒素血症[11]。血液中的脂多糖(lipopolysaccharide,LPS)可以穿过血脑屏障进入大脑,影响小胶质细胞的激活与极化,进而刺激产生促炎细胞因子,最终导致中枢神经系统炎症[12]。
岩藻多糖是一种复杂的硫酸化碳水化合物,来源于棕色海藻和一些海洋无脊椎动物的组织中。岩藻多糖富含褐藻多糖与硫酸基,并且由于其分支和单糖的不同而显示出多种功能,已经证实岩藻多糖具有广泛的药理作用,如抗氧化、免疫调节、抗凝血等多种生物活性[13-14]。另外,岩藻多糖作为一种可口服的天然海藻活性物质,其安全性已在动物和临床研究中得到证实[15-16]。据报道,岩藻多糖可有效抑制Aβ 诱导的SH-SY5Y 细胞和原代皮层神经元凋亡,并促进神经突起再生,证明岩藻多糖具有良好的神经保护作用[17]。另外,研究证明岩藻多糖处理可以减少小胶质细胞的激活和氧化应激,对海马区神经元发挥保护作用,进而可作为一种预防短暂性脑缺血损伤的有益药物[18]。有研究报道,岩藻多糖可能作为一种有益的膳食补充剂调节肠道微生态,保护肠黏膜屏障功能,进而减轻宿主的炎症反应[19]。前期研究结果显示[20-21],岩藻多糖可以通过改善肠道屏障功能对乳腺癌大鼠发挥保护作用;在酒精暴露小鼠模型中,岩藻多糖通过调控肠道微生态抑制酒精诱导的小鼠脂肪变性和胆汁酸代谢紊乱,进而对酒精性肝损伤发挥保护作用。鉴于岩藻多糖的神经保护作用以及与肠道屏障的密切关系,我们推测岩藻多糖能够通过改善酒精依赖小鼠的肠黏膜屏障功能对小鼠的神经行为学发挥保护作用。因此,本实验通过自由饮用15%乙醇溶液构建酒精依赖小鼠模型,以岩藻多糖为干预物,旨在探究岩藻多糖对酒精依赖小鼠神经行为学的保护作用及机制。
材料和方法
1 动物
无特定病原体级C57BL/6J小鼠36只(雄性,8周龄),体质量为20~25 g,由维通利华实验动物技术有限公司(北京)提供,动物生产许可证号为SCXX(京)2016-0006。
2 主要试剂
岩藻多糖提取自墨角藻,95%纯度,分子量220~260 kD,购于Sigma。将岩藻多糖粉用生理盐水稀释成300 mg/kg悬液保存备用。
血清5-羟色胺(5-hydroxytryptamine,5-HT)、脑源性神经营养因子(brain derived neurotrophic factor,BDNF)、神经肽 Y(neuropeptide Y,NPY)、多巴胺(dopamine,DA)、白细胞介素1β(interleukin-1 beta,IL-1β)、IL-18、肿瘤坏死因子α(tumor necrosis factorα,TNF-α)、单核细胞趋化蛋白1(monocyte chemotactic protein 1,MCP-1)、细菌内毒素、二胺氧化酶(diamine oxidase,DAO)、D-乳酸(D-lactic acid,D-LA)和脂肪酸结合蛋白2(fatty acid binding protein 2,FABP2)等ELISA 试剂盒由南京建成生物工程研究所提供。β-actin 抗体购自 Abcam;ZO-1 和 claudin 2抗体购自Cell Signaling Technology。56%酒精溶液由北京红星股份有限公司提供。
3 主要方法
3.1 动物分组及模型建立 适应性喂养1 周后,将36 只雄性C57BL/6J 小鼠随机分为3 组(每组12 只):对照组,模型组和岩藻多糖(300 mg/kg)干预组。课题组前期研究显示,岩藻多糖使用剂量为200~400 mg/kg 时,小鼠均无不良反应,因此本研究选取300 mg/kg作为实验剂量[21-22]。在模型组和岩藻多糖干预组中,通过自由饮用15%乙醇溶液的方式建立酒精依赖模型[23]。模型组和岩藻多糖组动物于每周一至周五的上午8时至下午4时自由饮用新鲜自来水,然后自由饮用15%乙醇溶液至第2 天上午8 时。对照组的小鼠从周一到周五自由饮用自来水。在周六所有组的小鼠切断一切水源进行戒断,周日全天自由饮用新鲜自来水。岩藻多糖干预组小鼠于每天中午12:00 灌胃给予岩藻多糖(300 mg/kg)溶液。同时,对照组和模型组小鼠每日灌胃等体积生理盐水。实验持续10周。最后1周戒断酒精1 d后,所有小鼠进行蔗糖偏好实验(sucrose preference test,SPT)、悬尾实验(tail suspension test,TST)、强迫游泳实验(Forced swimming test,FST)、Y 迷宫实验、高架十字迷宫(elevated plus maze,EPM)实验等行为学测试。
3.2 小鼠摄食量和体重检测 在干预开始前,称量小鼠体重和摄食量作为第0 周(week 0)数据,干预后每周称量1 次体重和摄食量,即week 1、week 2、week 3、week 4、week 5、week 6、week 7、week 8、week 9、week 10各称量1次,共计11次。
3.3 蔗糖偏好实验 动物禁食禁水24 h 后,进行蔗糖偏好实验。参考文献[24],测试期间普通饮用水和1%蔗糖溶液各500 mL称重后给予小鼠(左右随机放置),每隔1 h 对瓶子位置进行互换,避免位置偏向。5 h后,重新称量瓶子。糖水偏好度=(总蔗糖摄入量/总液体摄入量)×100%。
3.4 悬尾实验 参考文献[25],用不粘胶将小鼠悬挂于距离台面50 cm 的支架边缘上,使其呈倒悬状态,不粘胶黏贴在距小鼠尾尖1.5 cm 处,腹部对准摄像头。小鼠为了能够克服不正常体位而进行挣扎,但在活动的一段时间内出现间断性不动,表现出失望心理状态。摄像记录6 min,适应2 min,统计后4 min小鼠累计不动时间(s)总和,即小鼠放弃挣扎,呈僵直状态,或仅有细小的肢体运动。
3.5 强迫游泳实验 参考文献[26],将小鼠被放置在一个开放的有机玻璃缸中(25 cm×10 cm)。缸内水深10 cm,温度(23±1)℃。每只小鼠游泳6 min,摄像头记录游泳的最后4 min。当小鼠停止挣扎并漂浮在水中时视为静止不动,小鼠不动时间的增加被认为是其处于绝望状态的一个指标。在测试过程中,使用摄像机(Handycam,Sony)记录每只小鼠的行为,并使用视频跟踪系统(SMART V3.0,Panlab Harvard instruments)计算不动时间。测试结束后,用毛巾将小鼠擦干。
3.6 Y-迷宫实验 参考文献[27],小鼠的空间记忆和工作记忆通过Y-迷宫实验进行检测,Y-迷宫由三个等间距的手臂(120°,50×32×16 cm)组成。其中一只手臂为起始臂,每只小鼠起初都被放在起始臂处,其余两只手臂中一只被挡住了,称为新奇臂,另一只手臂则为交替臂。首先小鼠探索起始臂和交替臂5 min,然后将小鼠拿出。2 min 后,将其重新放回起始臂,开放新奇臂,自由探索3个手臂5 min。每次测试后,用75%酒精溶液擦拭各手臂,去除先前测试小鼠留下的气味线索。用摄像机和视频跟踪系统自动收集小鼠的行为数据。记录最后5 min 内小鼠的以下各项指标:①总进臂次数(total number of entries):动物进入迷宫臂的次数(以小鼠四肢均进入臂为标准进臂一次);②轮流(交替)一次(an alternation):依次连续进入Y 迷宫全部三个臂一次,称为有效进臂;③大轮流次数(number of maximum alternations):总进臂次数-2。计算每只小鼠的有效进臂率,有效进臂率=总轮流次数/大轮流次数×100%。
3.7 高架十字迷宫实验 高架十字迷宫是一个十字形状的装置,高出地面50 cm,为避免反光,装置表面为哑光白色。装置由四个相对的臂组成,其中两个相对的臂向周围开放称为开放臂(50×10×0.5 cm),另外两个相对的臂闭合称为闭合臂(50×10×30 cm)。四个手臂相互连接,在中心形成一个开放区域(10×10 cm)。参考文献[28],小鼠被放置在中心,面对一处开放臂,每只小鼠在迷宫中测试5 min。每次测试后,用75%酒精溶液擦拭整个迷宫装置,去除先前测试小鼠留下的气味线索。用摄像机和视频跟踪系统自动收集小鼠的行为数据。记录以下各项指标:进入开放臂时间;进入开放臂次数,即以小鼠四肢均进入到臂内为准,中途一个爪子从该臂中完全退出则视为该次进入活动完成。
3.8 实验样本指标检测 行为学测试后,小鼠禁食不禁水12 h。通过眼球取血分离得到上清,放于-80 ℃下保存,以备后续指标检测。随后小鼠被迅速斩首分离大脑和回肠组织。
3.8.1 免疫荧光染色 大脑组织用10%多聚甲醛固定过夜,石蜡包埋。将组织切片,用5%正常山羊血清在PBS 中封闭30 min。所有切片分别用CD68(1∶200)和GFAP(1∶200)抗体在4 ℃下孵育过夜。PBS冲洗3次,使用与Ⅰ抗对应种属的荧光Ⅱ抗室温下避光孵育1 h,滴加含有DAPI 的抗荧光衰减封片剂封片,最后在荧光显微镜下观察。
3.8.2 ELISA 大脑组织 5-HT、BDNF、NPY 和 DA水平检测采用ELISA 试剂盒。脑组织在冰上用0.02 mol/L 冰磷酸盐缓冲液(pH 7.0-7.42)进行匀浆。1 010×g离心15 min后,检测上清液中上述神经递质以及神经性营养因子的表达水平。脑组织IL-1β、IL-18、TNF-α 和 MCP-1 等炎性因子水平;血清内毒素、DAO、D-LA 和FABP2 等肠黏膜屏障指标同样均采用ELISA 试剂盒检测。操作步骤严格按照试剂盒说明书进行。
3.8.3 Western blot 使用组织蛋白提取试剂盒(Beyotime)从回肠组织中提取总蛋白,并使用BCA蛋白检测试剂盒(Beyotime)进行定量。将等量的蛋白样品(20 μg)通过8%~10% SDS-PAGE 分离,然后转移到聚偏二氟乙烯(PVDF)膜上。5%脱脂牛奶室温封闭 1 h 后,用 TBST 溶液洗膜 3 次每次 10 min,随后分别加入不同I 抗在4 ℃孵育过夜。上述方法洗膜后,加入与Ⅰ抗对应种属的Ⅱ抗(稀释,1∶800)室温孵育1 h。
3.8.4 回肠超微结构观察 参考前期发表文献[29],提取回肠组织放入3%戊二醛固定液中固定,4 ℃冷藏过夜。磷酸缓冲液漂洗后,1%锇酸溶液于3 ℃再固定1 h,进行第2 次漂洗。采用不同浓度丙酮进行梯度脱水。环氧树脂包埋剂固化后,将样本取出,使用切片机将其切成60 nm 的切片。醋酸双氧铀-柠檬酸铅进行组织染色。使用透射电镜对小鼠回肠组织超微结构进行观察拍摄。
3.8.5 小肠渗透性示踪分析(intestinal permeability analysis,IPA) 同样参考文献[29],取回肠组织2 cm,将一端结扎,采用小鼠灌胃针从另一端缓慢注入2 g/L 荧光生物素(EZ-link Sulfo-NHS-Biotin)后结扎。室温孵育5 min 后,用多聚甲醛固定4 h。将样品用石蜡包埋并切成60 nm切片后,加入链霉亲和素避光孵育30 min。荧光显微镜观察荧光生物素在肠道中的分布情况。
4 统计学处理
使用GraphPad Prism 5.0 进行统计分析。数据均采用均数±标准差(mean±SD)表示,多组间比较采用单因素方差(one-way ANOVA)分析,t检验分析两组间的差异,以P<0.05为差异有统计学意义。
结 果
1 岩藻多糖对酒精暴露小鼠的摄食量及体重的影响
各组小鼠均自由饮食,每周测定1 次摄食量和体重。干预开始前,所有组小鼠的摄食量和体重均没有显著差异(P>0.05)。干预10 周后,酒精依赖模型组小鼠的摄食量和体重下降,均显著低于正常对照组(P<0.05)。岩藻多糖干预治疗组小鼠摄食量增多,明显高于酒精依赖模型组(P<0.05),见表1。
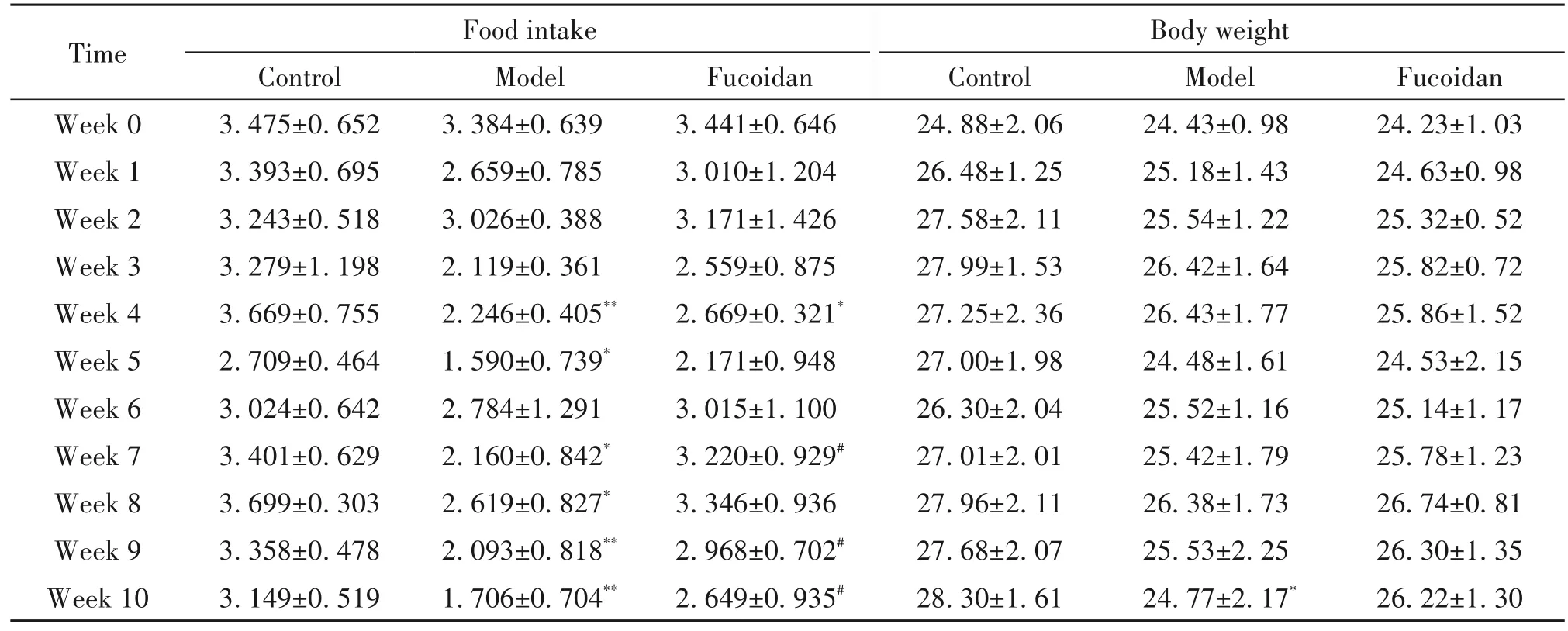
表1 小鼠体重及摄食量检测情况Table 1. Detection of body weight and food intake in mice(g. Mean±SD. n=12)
2 岩藻多糖对酒精暴露小鼠的行为学影响
通过 SPT、TST、FST、EPM 实验和 Y 迷宫实验确定岩藻多糖是否能缓解酒精暴露小鼠的认知行为障碍和抑郁样行为。SPT 结果显示,与正常对照组相比,酒精依赖模型组小鼠对蔗糖溶液的偏好显著降低(P<0.01),岩藻多糖干预可缓解这一下降趋势(P<0.05)。TST 结果显示,与正常对照组相比,酒精依赖模型小鼠的不动时间显著增加(P<0.01),岩藻多糖干预后小鼠的不动时间显著降低了40.1%(P<0.05)。FST结果显示,与正常对照组相比,酒精依赖模型组小鼠静止不动时间显著延长(P<0.05)。但与模型组相比,岩藻多糖治疗组小鼠的不动时间减少,但差异无统计学意义。Y 迷宫实验显示,与正常对照组相比,酒精依赖模型组小鼠有效进臂率显著下降49.79%(P<0.05),岩藻多糖干预后使小鼠有效进臂率有一定提高。此外,EPM 结果显示,与正常对照组相比,长期酒精暴露导致小鼠进入开放臂停留的时间和次数分别下降了52.97%和50%(P<0.05),岩藻多糖干预后小鼠停留时间显著延长了87.09%(P<0.05)。见图1。
3 岩藻多糖对脑组织神经递质以及神经性营养因子表达水平的影响
酒精依赖模型组小鼠脑组织中NPY、DA、BDNF和5-HT 水平均低于正常对照组(P<0.05);通过添加岩藻多糖干预能够改善这一情况,其中BDNF 和5-HT 水平较模型组显著升高48.49%和45.73%(P<0.05),见图2。
4 岩藻多糖对脑组织炎性细胞因子水平的影响
酒精暴露可引起小鼠脑组织中炎性细胞因子TNF-α、IL-1β、IL-18 和 MCP-1 水平均高于正常对照组(P<0.05);经岩藻多糖干预后,TNF-α、IL-1β 和MCP-1 水平分别较模型组降低45.05%、42.36%和41.07%(P<0.05),见图3。
5 岩藻多糖对大脑小胶质细胞和星形胶质细胞活化的影响
免疫荧光结果显示对照组CD68 染色较弱说明小胶质细胞活化标志物CD68蛋白表达水平较低,而酒精依赖模型组CD68 染色较强说明小胶质细胞活化标志物CD68 蛋白表达水平较高;与模型组相比,岩藻多糖干预组CD68 染色减弱说明小胶质细胞活化标志物CD68蛋白表达水平降低。类似地,对照组GFAP染色较弱说明星形胶质细胞活化标志物GFAP蛋白表达水平较低,而酒精依赖模型组GFAP染色较强说明星形胶质细胞活化标志物GFAP 蛋白表达水平较高。与模型组相比,岩藻多糖干预组GFAP染色减弱说明星形胶质细胞活化标志物GFAP 蛋白表达水平降低,见图4。
6 岩藻多糖对血清内毒素、DAO、FABP2 和D-LA水平的影响
酒精依赖模型组小鼠血清中内毒素、DAO、FABP2和D-LA水平均高于正常对照组(P<0.05);岩藻多糖干预治疗后,D-LA 和FABP2 水平较酒精依赖模型组显著降低(P<0.05);此外,岩藻多糖能显著降低酒精暴露小鼠血清中内毒素水平(P<0.05),见图5。
7 岩藻多糖对酒精暴露小鼠肠黏膜屏障的影响
肠道示踪实验结果显示,对照组小鼠肠道的绿色荧光生物素主要分布在肠细胞膜外侧,并且生物素未渗透出肠黏膜,而酒精依赖模型组小鼠肠道的绿色荧光生物素渗透进细胞缝隙;经岩藻多糖干预后,小鼠肠道的绿色荧光生物素大部分聚集在肠细胞膜外侧,仅有少量生物素渗漏。
透射电镜观察结果显示,对照组小鼠的小肠结构完整。酒精依赖模型组小鼠小肠微绒毛排列杂乱无章,细胞链接松弛,间隙增宽;经岩藻多糖干预后,小鼠小肠微绒毛排列逐渐整齐,细胞连接缝隙减小。此外,酒精依赖模型组小鼠小肠绒毛长度显著低于正常对照组(P<0.01);岩藻多糖干预治疗后,小肠绒毛长度较酒精依赖模型组显著增加(P<0.05),见图6。
8 岩藻多糖对酒精暴露小鼠小肠组织紧密连接蛋白表达的影响

Figure 1. Cognitive and behavioural performance of the mice. SPT(A),TST(B),FST(C),Y-maze test(D)and EPM test(E)were performed to determine whether fucoidan could improve depression behaviors and cognitive function of mice induced by alcohol. Mean±SD. n=12.*P<0.05,**P<0.01 vs control group;#P<0.05 vs model group.图1 小鼠的认知和行为表现
与对照组相比,酒精依赖模型组和岩藻多糖干预组小鼠的ZO-1 和claudin 2 蛋白的表达水平均显著降低(P<0.01)。与模型组相比,岩藻多糖干预组小鼠的ZO-1 和claudin 2 蛋白的表达水平显著升高(P<0.05)。此外,对照组小鼠回肠组织中ZO-1 和claudin 2 蛋白免疫荧光染色较强说明蛋白表达水平高,而酒精依赖模型组和岩藻多糖干预组小鼠回肠组织ZO-1 和claudin 2 蛋白染色均较弱说明蛋白表达水平低;与模型组相比,岩藻多糖干预后小鼠回肠组织ZO-1 和claudin 2 蛋白染色增强说明蛋白表达水平升高。见图7。
讨 论
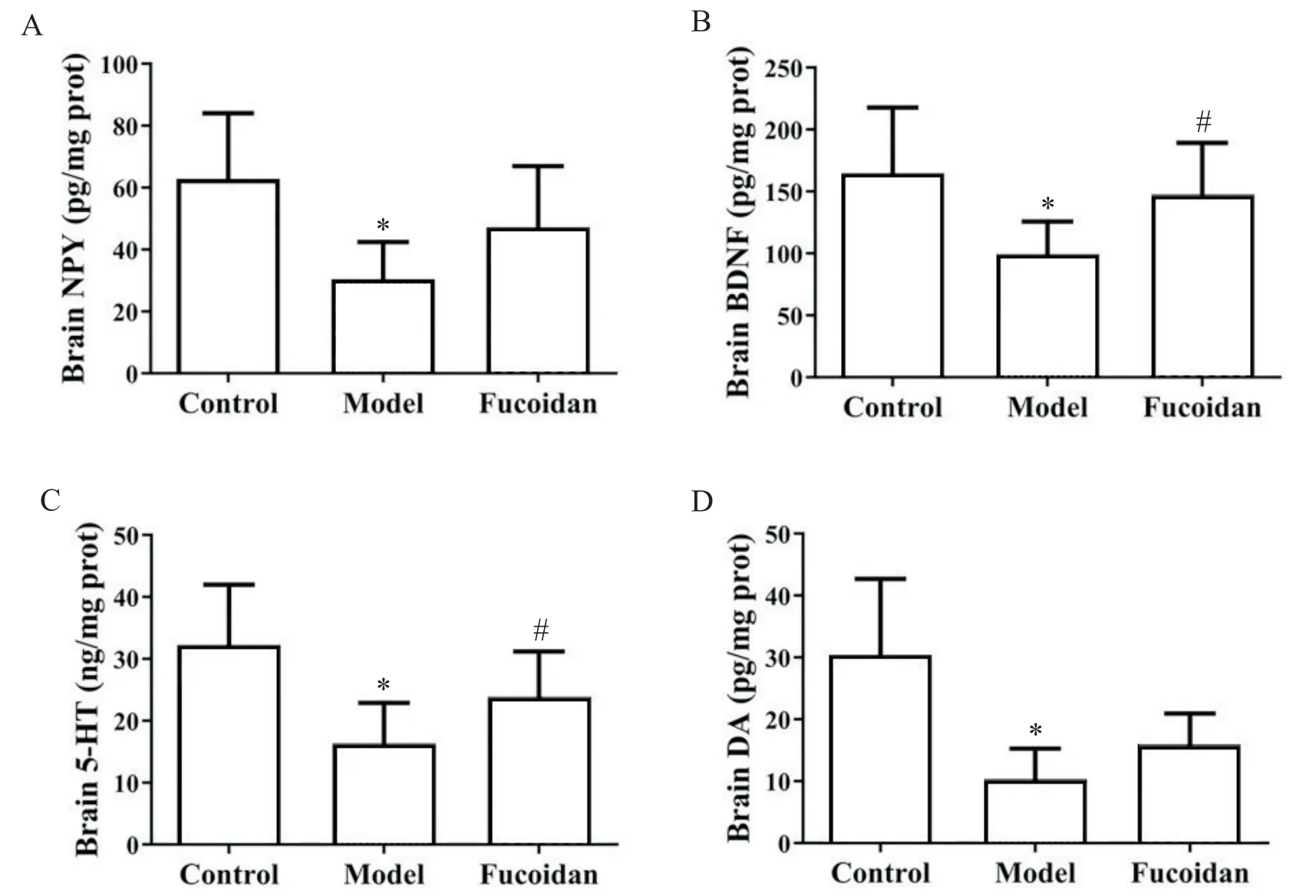
Figure 2. Expression levels of neurotransmitters and neurotrophic factors in the brain of mice. The levels of NPY(A),BDNF(B),5-HT(C)and DA(D)were detected by ELISA kits. Mean±SD. n=12.*P<0.05 vs control group;#P<0.05 vs model group.图2 小鼠脑组织神经递质以及神经性营养因子的表达水平
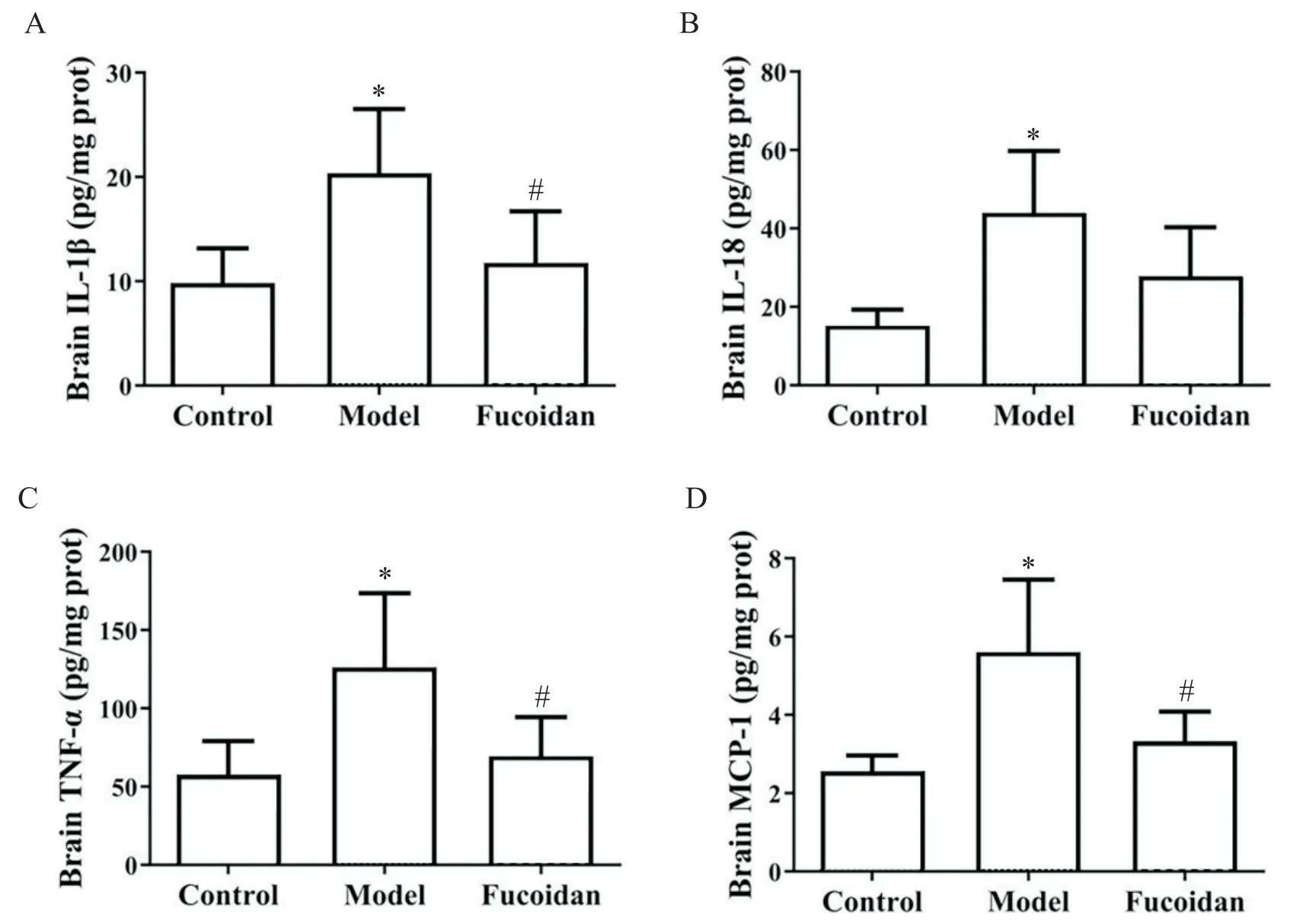
Figure 3. Expression level of inflammatory factors. The levels of IL-1β(A),IL-18(B),TNF-α(C)and MCP-1(D)were detected by ELISA kits. Mean±SD. n=12.*P<0.05 vs control group;#P<0.05 vs model group.图3 小鼠脑组织炎性因子的表达水平
酒精是最常被滥用的药物之一,每年都有数百万人死于酒精使用障碍,给家庭和社会带来巨大危害。持续过量饮酒可诱导酒精依赖,而酒精戒断综合症通常在反复饮酒后发生,在情绪上主要表现为抑郁和焦虑[30]。有文献报道,在反复束缚应激诱导的抑郁样大鼠模型中,岩藻多糖可缓解大鼠的行为认知障碍及抑郁样行为[31]。本实验结果显示,通过自由饮用15%乙醇溶液构建的酒精依赖模型小鼠,其认知行为障碍及抑郁样行为明显增加,这与以往的研究结果相一致[32-33]。岩藻多糖干预治疗后,行为学实验结果显示较酒精依赖模型组有明显改善,提示岩藻多糖可缓解酒精诱导的小鼠抑郁样行为,改善小鼠的记忆和认知功能。
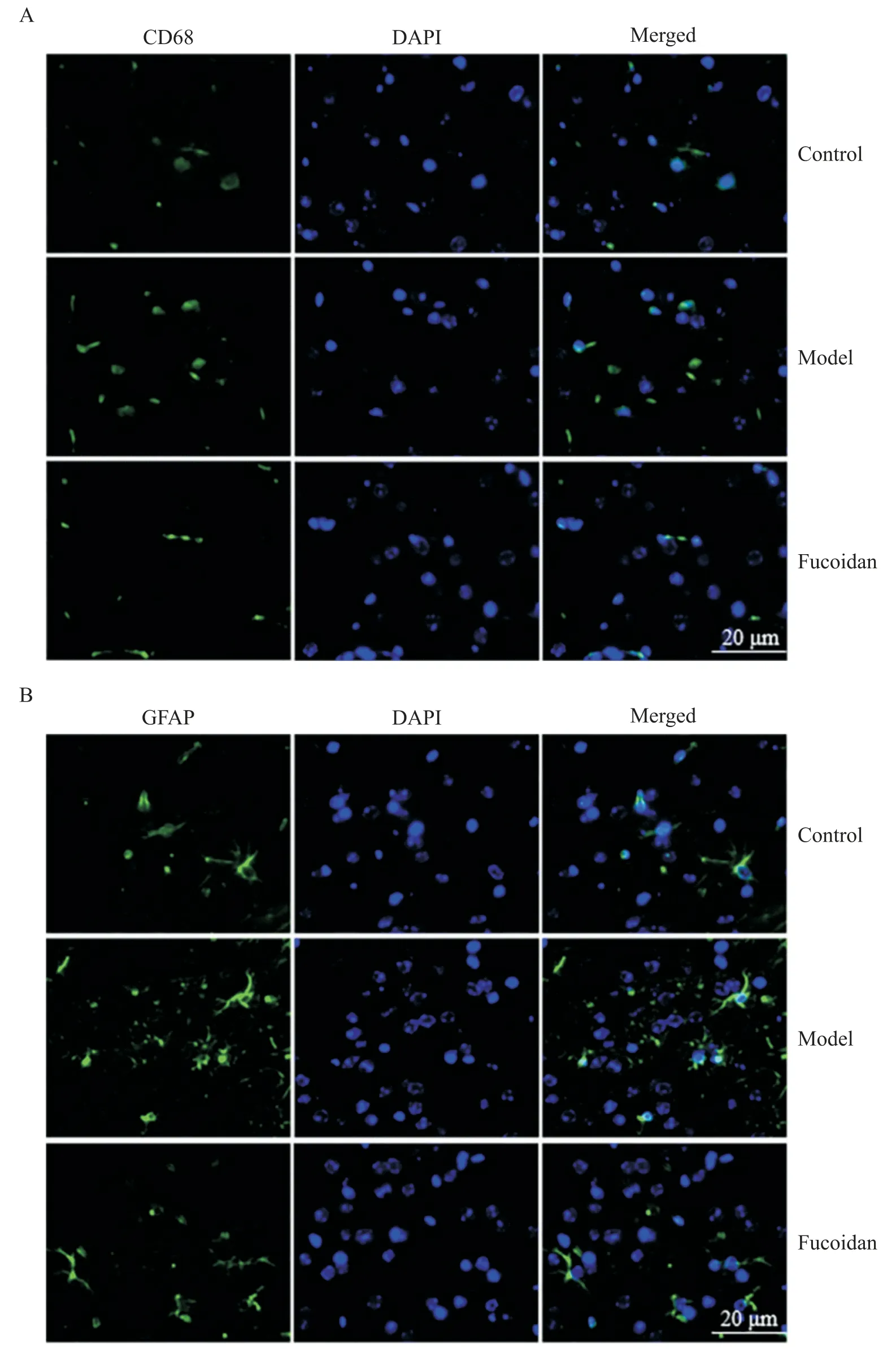
Figure 4. Changes of activation levels of microglia(CD68)and astrocytes(GFAP)in hippocampus of mice(scale bar=20 μm).图4 小鼠海马区小胶质细胞和星形胶质细胞活化水平的变化
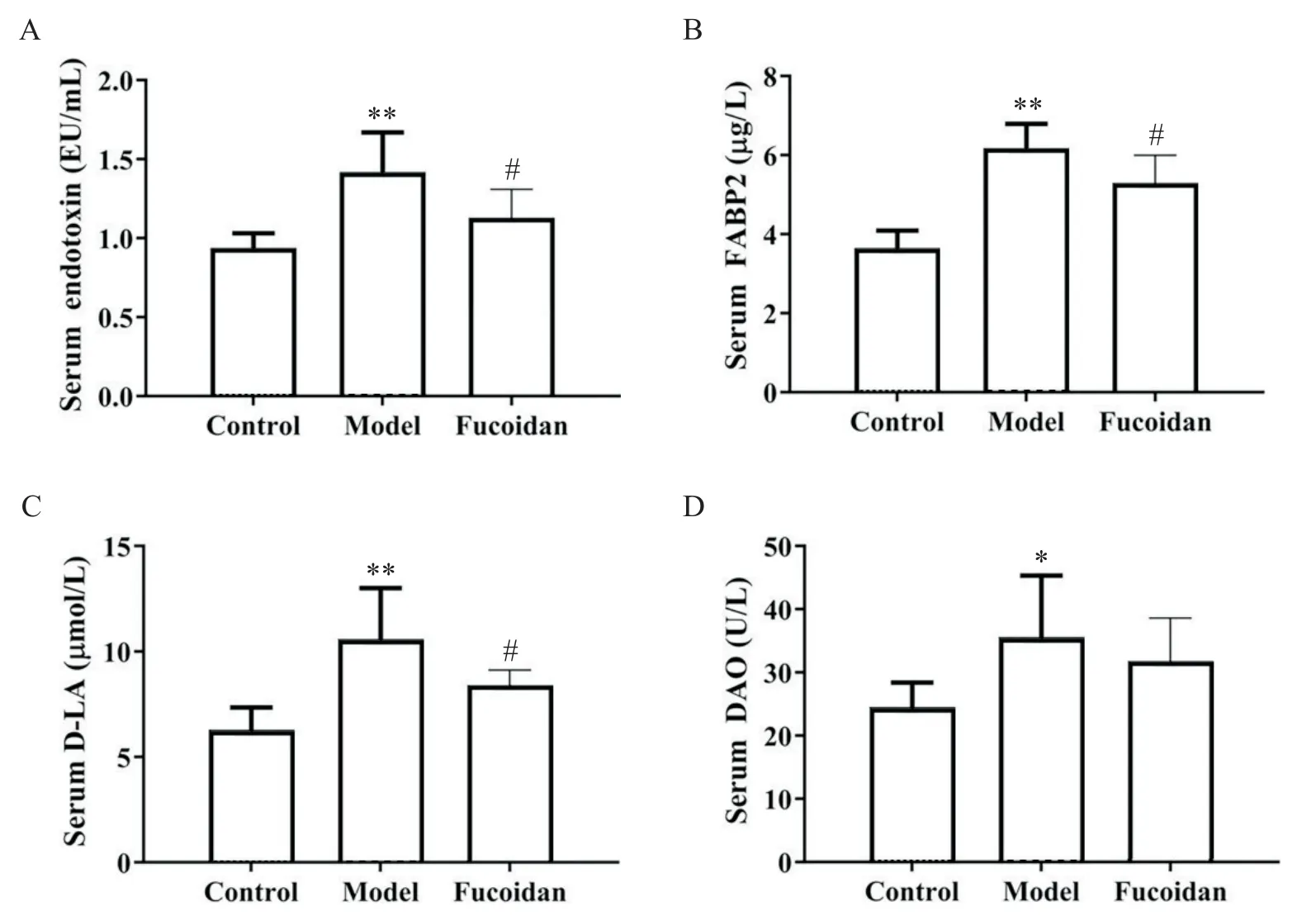
Figure 5. Changes of main biochemical indexes of intestinal mucosal barrier in mice. The serum levels of endotoxin(A),FABP2(B),D-LA(C)and DAO(D)were detected using ELISA kits. Mean±SD. n=12.*P<0.05,**P<0.01 vs control group;#P<0.05 vs model group.图5 小鼠肠黏膜屏障主要生化指标变化
酒精依赖与中枢神经系统疾病的发生有密切关系,发病时常伴随各种神经因子发生一系列病理变化。NPY 是内源性抗焦虑、抗癫痫活性物质,可有效抑制酒精戒断过程中的肌肉、精神症状[34]。5-HT 是调节精神和情绪的重要神经递质,研究显示5-HT 循环通路的功能与酒精依赖的形成关系密切[35]。酒精对BDNF 水平具有调节作用,而BDNF 水平与酒精对靶组织的短期和长期影响有关,如情绪异常、认知能力下降和神经细胞死亡[36]。DA 是一种大脑中的神经传递素,研究显示DA 水平降低与抑郁症发生有直接关系[36]。一项人群试验报道[37],以酒精依赖患者与健康志愿者为试验样本,酒精依赖患者血浆BDNF水平明显高于健康志愿者。近期研究报道[38],在脂多糖和慢性束缚应激诱导的两种抑郁样小鼠模型中,岩藻多糖均可升高其血清中BDNF 水平减轻神经炎症进而发挥抗抑郁作用。此外最新研究显示[39],岩藻多糖可在鱼藤酮诱导的帕金森病大鼠模型中升高其血清中DA 水平,发挥神经保护作用。本实验结果显示,经岩藻多糖治疗后NPY、5-HT、BDNF和DA 水平的降低程度有所减轻,这与行为学检测结果相一致,提示岩藻多糖可以改善酒精暴露小鼠的行为认知能力。
星形胶质细胞和小胶质细胞是介导中枢神经系统神经炎症最重要的两类胶质细胞,负责维持中枢神经系统内环境平衡和应对病理损伤[40]。酒精暴露激活胶质细胞[41],胶质细胞活化后释放多种促炎细胞因子。有研究报道[42],岩藻多糖可降低脂多糖诱导的 BV2 小胶质细胞中的 IL-1β、TNF-α 和 MCP-1 水平。本实验结果显示,岩藻多糖治疗组小鼠脑组织中TNF-α、IL-1β、IL-18 和MCP-1 水平均有所下降,提示岩藻多糖可以发挥抗炎作用从而减轻胶质细胞活化导致的神经炎症。CD68 是活化小胶质细胞的理想标记物,有研究报道,CD68 水平在选择性神经损伤诱导的抑郁样大鼠模型中有所上升[43],而GFAP特异地表达于中枢神经系统星形胶质细胞胞质内,可作为星形胶质细胞特异性标志物[44]。本实验结果显示,岩藻多糖干预处理可以减弱酒精暴露诱导的小胶质细胞和星形胶质细胞的活化,抑制炎性细胞因子释放进而减轻神经炎症。
中枢神经系统的多种病理反应与肠道黏膜屏障之间也存在密切联系[45]。正常生理状态下,D-LA、FABP2和DAO血浆水平较低,肠黏膜屏障受损时,DLA、FABP2 和DAO 释放入血,导致血浆中三者水平升高[46-47]。此外,肠黏膜屏障受损还会使肠道菌群失调导致血浆中LPS 水平升高,LPS 跨越血脑屏障,最终造成中枢神经系统炎症[47]。紧密连接蛋白是肠黏膜屏障的核心部分,包括闭合蛋白、咬合蛋白和带状闭合蛋白3种跨膜蛋白。前期研究结果显示[48],在乳腺癌大鼠模型中,岩藻多糖可通过降低血浆中D-LA与DAO的水平以及促进紧密连接蛋白的表达改善肠黏膜屏障功能。本实验结果显示,岩藻多糖干预治疗后小鼠血清中D-LA、FABP2、DAO和内毒素水平得到明显降低,紧密连接蛋白表达明显升高,提示岩藻多糖可有效减轻肠黏膜屏障损伤。近期研究报道[49],在环磷酰胺损伤小鼠小肠黏膜模型中,岩藻多糖干预处理后小鼠小肠组织形态得到明显改善,小肠绒毛长度有不同程度的增长。在本研究中,透射电镜观察和小肠渗透性示踪实验结果均显示岩藻多糖能改善肠黏膜通透性以及组织形态,进而减轻肠黏膜屏障损伤,与上述实验结果一致。此外,最近一项人群试验报道[50],以酒精依赖患者与健康志愿者为试验样本,酒精依赖患者组与健康志愿者组相比,肠道紧密连接蛋白表达降低,肠道通透性增加,肠黏膜屏障受损。该人群试验与本动物实验结果均显示酒精暴露造成肠黏膜屏障损伤,而本实验结果提示岩藻多糖可减轻小鼠肠黏膜屏障损伤并进一步推测对小鼠中枢神经系统发挥保护作用。

Figure 6. Structural changes of intestinal mucosal barrier in mice. A:intestinal permeability analysis(IPA). If the function of intestinal mucosal barrier is normal,green fluorescent biotin will not permeate the intestinal mucosa. On the contrary,when the intestinal mucosal barrier is damaged,green fluorescent biotin permeates into the cell gap(scale bar=50 μm). B:transmission electron microscopic(TEM)observation:the structure of the small intestine of the control group was intact,while the small intestinal microvilli of the model group were arranged disorderly and the intercellular space was broadened(arrow indication). Scale bar=500 nm. C:villus length. Mean±SD. n=12.**P<0.01 vs control group;#P<0.05 vs model group.图6 小鼠肠黏膜屏障结构变化
综上所述,在本研究中,我们检测了口服岩藻多糖对慢性酒精暴露和戒断小鼠的神经保护作用及其机制。结果提示,口服岩藻多糖能有效缓解酒精依赖小鼠的认知行为功能障碍及抑郁样行为,其机制可能与岩藻多糖对小鼠肠黏膜屏障的保护作用有关。
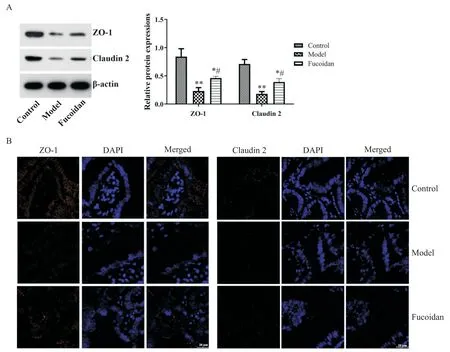
Figure 7. Changes of tight junction protein expression in small intestine of mice. A:Western blot;B:immunofluorescence staining(scale bar=20 μm). Mean±SD. n=12.*P<0.05,**P<0.01 vs control group;#P<0.05 vs model group.图7 小鼠小肠组织紧密连接蛋白表达水平变化

