超分子溶剂液液微萃取-超高效液相色谱法检测萘敏维滴眼液中的防腐剂尼泊金乙酯
粟雯,张丹,吴雅雯,钟奇,蒋旭东,龙浩
(1.邵阳学院 药学院,湖南 邵阳,422000;2.湘西南中药开发利用湖南省工程研究中心,湖南 邵阳,422000)
萘敏维滴眼液是常见的眼用制剂之一,主要在临床上用于治疗结膜充血,眼睛发痒等症状。滴眼液作为一种无菌外用制剂,为防止在使用的过程中被微生物污染,需要添加防腐剂[1-3]。尼泊金乙酯(ethylparaben,EP)的毒害作用小,并无局部刺激作用[4],在合适的浓度范围内可以有效地抑制细菌、真菌等的滋生。但是EP的不当添加,将有可能对眼部造成不同程度的伤害[5],如引起结膜的炎症反应或导致角膜上皮细胞的缺失、甚至引起较严重的干眼症。因此,严格控制萘敏维滴眼液中的EP的含量并进行准确定量显得格外重要。目前,EP的定量分析方法主要有高效液相色谱法[6]、气相色谱法[7]、毛细管气相色谱法[8]、高效液相色谱法-质谱法[9]、气相色谱-质谱法[10]等。然而,由于滴眼液中组分多样,EP的浓度极低,需要先通过一系列前处理过程对其进行富集,再进行定量检测。目前用于萃取富集EP含量的前处理方法有液液萃取(LLE)[7],固相萃取法(SPE)[11]、固相微萃取(SPME)[12-13]、微滴液相微萃取(SDME)[14]等,但传统的样品预处理方法LLE和SPE存在着萃取时间长、有机溶剂消耗量大、不利于高效富集、成本较高等缺点。而SPME和SDME的预处理方法虽然试剂使用量较少,但操作步骤相对复杂。因此,发展操作简单、快速高效、绿色环保、萃取富集效果好的前处理技术是很有必要的。
超分子溶剂是指在水溶液的环境中两亲性化合物通过水相和有机相或分子间自发组装和凝集过程所形成的具有纳米结构的胶束聚集体[15]。超分子溶剂萃取技术是以超分子溶剂作萃取剂的一种新型萃取技术。该技术具有操作简单、绿色环保、成本低、溶剂用量少等优势,并且可以对不同极性的目标物实现高效萃取,已成功应用于环境[16]、食品[17-18]和生物[19]等样品的前处理。目前一般多采用烷基酸或醇与四氢呋喃和水混合的超分子溶剂对化合物进行有效萃取。然而,由于组装成的超分子溶剂的密度低于水,微量萃取相位于上相,较难收集,常需要特制窄口样品装置[20],在一定程度上增加了实验的复杂性和成本。
六氟异丙醇(Hexafluoroisopropanol,HFIP)是一种全氟代醇,它引入了一种强疏水基团-CF3,能够诱导单一或混合两亲性化物质在水溶液中形成超分子溶剂[21]。目前HFIP介导长链烷醇两亲性化合物自组装形成超分子溶剂,并对萘敏维滴眼液中的EP进行萃取和检测还未有报道。
本研究构建了正辛醇-HFIP-水的超分子溶剂,结合涡旋和离心辅助对滴眼液中的EP进行超分子溶剂液液微萃取,在单因素实验的基础上结合正交实验,对正辛醇和HFIP的用量、涡旋时间等参数进行优化,结合超高效液相色谱测定萘敏维滴眼液中EP的含量,为萘敏维滴眼液中的防腐剂的含量测定提供简便、快速、高效、环保的检测方法。
1 材料与方法
1.1 仪器与试剂
ACQUITY超高效液相色谱仪(美国Waters公司);H-1850台式高速离心机(湖南湘仪实验室仪器开发有限公司);QL-901型涡旋混合器(江苏海门其林贝尔仪器制造有限公司);FB223电子分析天平(上海舜宇恒平科学仪器有限公司);数控超声波清洗器(昆山市超声仪器有限公司)。
甲醇(德国默克公司);HFIP(Adamas,上海泰坦科技股份有限公司);EP标准品(Dr:Ehrenstorfer, LGC Standards GmbH);正辛醇(Adamas,上海泰坦科技股份有限公司);萘敏维滴眼液(江西闪亮制药有限公司,批号2108071;沈阳兴齐眼药股份有限公司,批号1A210901;山东博士伦福瑞达制药有限公司,批号21120901);去离子水采用Milli-Q纯水系统制得。
1.2 标准溶液的配制
准确称取5 mg(精确至0.1 mg)EP标准品至50 mL的容量瓶中,用甲醇溶解并定容至50 mL,配制成质量浓度为100 mg/L的标准储备溶液,置于4 ℃冰箱内保存待用。使用时,用去离子水逐级稀释成系列质量浓度的标准工作溶液,现用现配。
1.3 超分子溶剂的制备
准确量取180 μL正辛醇和540 μL HFIP,迅速注入10 mL的离心管中,加入去离子水至9 mL的刻度线,涡旋振荡3 min后,以3 004 r/min离心2 min,体系分成界面清晰的两相透明溶液,用微量注射器取出下相至玻璃瓶中,即得超分子溶剂,4 ℃下密封保存。
1.4 样品处理
精密量取所购买的滴眼液5 mL,用微孔滤膜(0.45 μm)过滤后,取滤液450 μL于1.5 mL离心管中,加入225 μL的超分子溶剂,涡旋振荡3 min后,以6 000 r/min的速度离心3 min,用注射器取出下相于进样瓶中,待超高效液相色谱测定。
1.5 色谱条件
色谱柱为Servo-PT C18 120A(250 mm×4.6 mm×5 μm);柱温为25 ℃;进样量为1 μL;流动相为甲醇(A)∶0.1%醋酸水溶液(B);梯度洗脱程序:0~2.0 min,5%~30% A;2.0~5.0 min,30%~80% A;5.0~7.0 min,80%~100% A;7.0~7.5 min,100%~5% A;7.5~10.0 min,5% A;流速为0.3 mL/min;检测波长为256 nm。
1.6 超分子溶剂萃取条件的单因素优化实验
选取正辛醇/HFIP/水作为超分子溶剂体系,保持总体积为9 mL,HFIP的用量为450 μL,考察了正辛醇的用量分别为135、180、225、270、315 μL时目标物质的峰面积。HFIP是超分子溶剂的重要组成部分,与水完全互溶并对长链烷醇具有很强的溶解能力,使其在水中分散。本研究考察了HFIP用量分别为405、450、495、540和595 μL(保持总体积9 mL)时目标物质的萃取率。随着HFIP的用量增加,EP的萃取率先升高后降低。一般而言,分散剂含量越高,超分子溶剂体积越大,对目标物的富集情况也会减少。在超分子溶剂分散液液微萃取的过程中,涡旋能使目标物与SUPRAS胶束聚集体充分发生作用,从而促进传质过程。本实验考查了涡旋时间分别为1.0、2.0、3.0、3.5和4.0 min时EP的萃取率。在超分子溶剂分散液液微萃取过程中,离心可以促使SUPRAS相与水相更好地分离,有利于对目标物的萃取。
2 结果
2.1 超分子溶剂萃取条件的单因素优化实验
如图1所示,当正辛醇用量位于135~180 μL之间时,随着正辛醇用量的增加,峰面积逐渐增大,萃取率也逐渐升高,当正辛醇用量高于180 μL时,萃取量逐渐达到饱和,由于超分子溶剂体积的增大反而会降低EP的浓度,因此,实验选择的正辛醇的用量设置为180 μL(2%,v/v)。
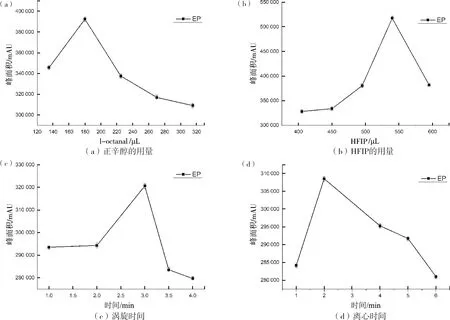
图1 不同因素对EP峰面积的影响Fig.1 Effects of different factor on peak area of EP
2.1.1 HFIP用量的优化
当HFIP的用量为540 μL(6%,v/v)时,EP标准品的萃取效果最好,因此,在后续的研究中540 μL HFIP为最佳用量。
2.1.2 涡旋时间的优化
结果显示,涡旋时间对EP的萃取效果影响不大,但涡旋为3.0 min时,目标物的萃取效率相对最高。因此,选择涡旋3.0 min为最佳条件。
2.1.3 离心时间的优化
离心时间对EP的萃取效果基本没有影响,但离心2 min时萃取效果最好。因此,选择离心2 min为最佳条件。
2.2 超分子溶剂萃取条件的正交优化实验
根据上述单因素分析实验结果,以EP的萃取率为考察指标,采用L9(33)正交设计实验,因素水平表见表1,正交实验结果见表2,方差分析见表3。通过比较表2各个因素对EP萃取率的极差值,可确定影响顺序为A>B>C,得到最佳提取条件为A2B2C2。从表3可看出,A、B因素各水平之间差异有统计学意义(P<0.01)、C因素各水平之间差异有统计学意义(P<0.05)。综合考虑确定最优萃取条件为2%正辛醇、6%HFIP、涡旋3.0 min、离心2 min。

表1 因素水平表(正交设计)
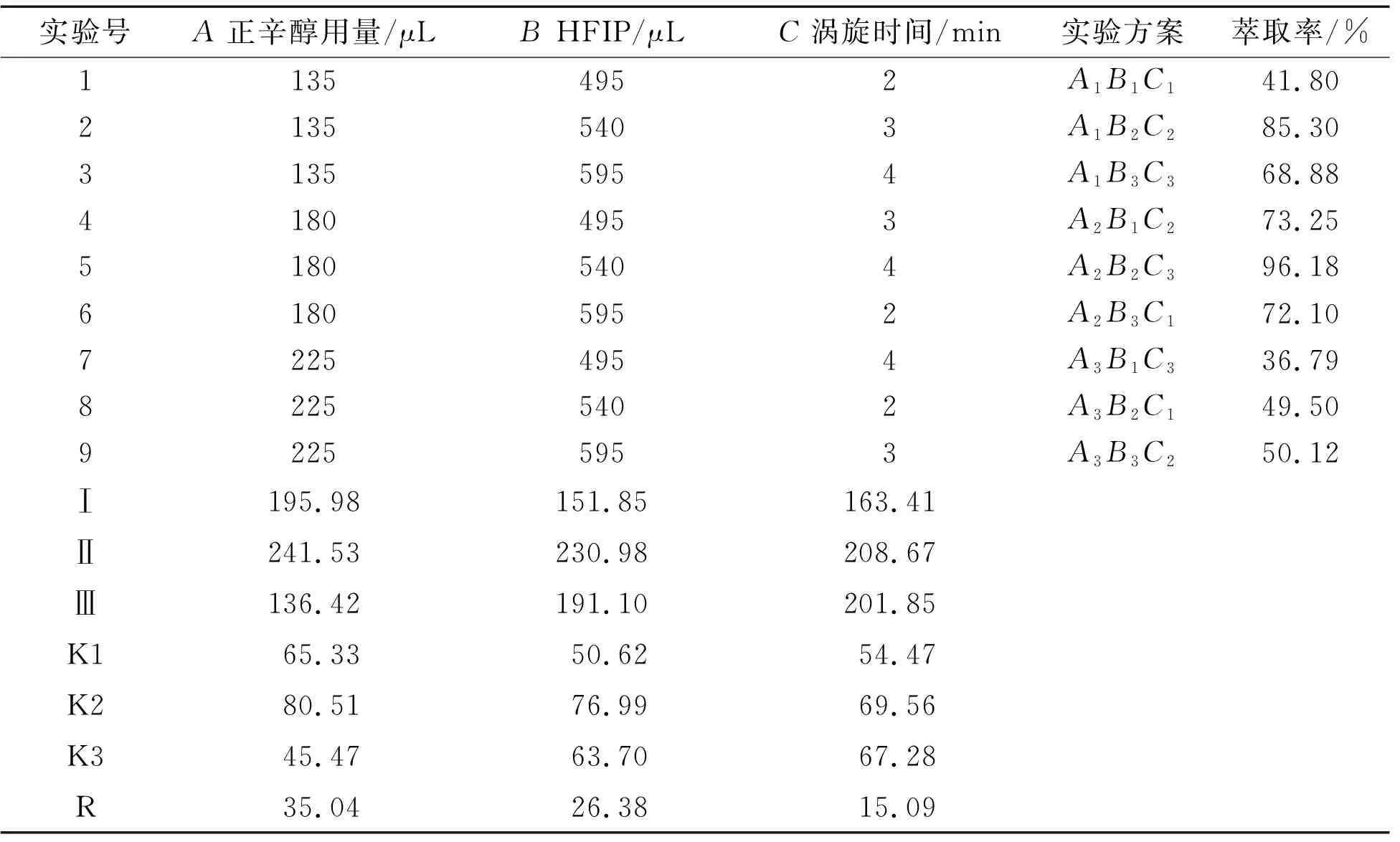
表2 正交设计实验结果

表3 正交实验方差分析
2.3 方法学验证
在最优萃取条件(2%正辛醇,6%HFIP,涡旋3 min,离心2 min)下,测定一系列不同加标水平的样品,对本实验方法进行了评价。结果表明,EP在0.01~50 mg/L范围内线性关系良好(y=2 872x-7 772.4,R2=0.999 1),检出限为1.2 μg/L,定量限为4.0 μg/L。为避免实验过程中的随机因素所造成的影响,对500 μg/L EP标准液做日内和日间精密度实验,日内精密度和日间精密度分别为4.82%和3.21%。
2.4 实际样品的测定
在市场上随机选取了3种不同厂家的滴眼液,对其中的EP的含量进行了测定。在各种滴眼液中EP的含量都低于检测线,即可认为不含EP。对所有待测样品进行加标回收率的考察,见表4。

表4 尼泊金乙酯的回收率和相对标准偏差(n=3)
2.5 与其他方法比较
本文所述的超分子溶剂萃取方法处理过程快速简单,萃取时间少,与其他方法的比较见表5。

表5 超分子萃取方法与其他方法比较
3 讨论
本研究采用正辛醇为萃取剂,水和HFIP为分散剂,制备了新型超分子溶剂,从实验结果来看,此新型超分子溶剂有利于实现极性较大的EP的萃取,在2%正辛醇和6%HFIP的组成下,对目标物涡旋3 min,再离心2 min,可达到最佳萃取效率。
综上所述,本文建立了一种基于HFIP-正辛醇-水为萃取剂的测定滴眼液中EP的新方法。此种超分子溶剂萃取剂可以快速实现对极性目标化合物的高效萃取和富集,与传统的超分子溶剂相比,其位于体系下相,更容易收集和处理。该方法与其他方法相比,前处理过程快速简单,消耗溶剂少,更加绿色环保,回收率及精密度较高,可为滴眼液中其他防腐剂的萃取测定提供一种可行高效的方案。

