IABP应用时机对高危PCI患者血流动力学及近期预后的影响
梁军军,李婷婷
(廊坊市第四人民医院ICU,河北 廊坊,065700)
主动脉内球囊反搏(intra-aortic balloon pump,IABP)是通过球囊充盈和排空增加冠状动脉灌注、减少心脏做功的左室辅助装置,置入后可以迅速改善患者的血流动力学,挽救更多的濒死心肌,已广泛用于危重心脏病的循环支持,而药物治疗很难做到[1]。目前IABP 已成为促进高危冠心病心功能恢复、为经皮冠状动脉介入(percutaneous coronary intervention,PCI)治疗赢得时间的主要手段[2-3]。2011年国际介入治疗指南推荐高危患者应选择性使用IABP[4]。目前IABP在高危冠心病PCI中的应用比例较高[5],但对疗效及预后的影响,IABP 的应用时机还未取得相对一致的研究结果。有研究指出,进行高危PCI术和冠状动脉斑块旋磨术时,尽早应用IABP有助于患者血流动力学的稳定,并且有较好的预后[6];但另有研究认为,IABP 过早应用可能会增加渗血、栓塞、感染、心脏不良事件等发生风险,延迟血运重建时间[7];还有研究显示,PCI术前预防性应用 IABP与术后药物控制失效时应用IABP相比,病死率相当[8]。此外,关于IABP能否减少高危PCI患者的再次PCI率、近期预后及影响患者近期预后的因素等还有待进一步证实。虽然大多数临床医师认可IABP在稳定血流动力学中的积极作用,但由于其有效性的循证医学依据尚不充分,使得各类IABP指南在高危患者中的推荐级别有所降低,仍应根据临床实际选择性使用IABP。本研究通过对高危PCI行IABP辅助病例的回顾性分析,探讨IABP不同应用时机对高危PCI患者近期预后的影响。
1 资料与方法
1.1 临床资料
回顾性分析2018年3月至2022年5月在廊坊市第四人民医院行IABP辅助的96例高危PCI患者的临床资料,所有患者均无严重的主动脉瓣关闭不全、主动脉夹层等IABP 使用禁忌证,IABP应用前知情并签订知情同意书。高危PCI定义[9]为:(1)发生30 d以内的急性ST段抬高型心肌梗死(ST segment levation myocardial infarction,STEMI)和非ST段抬高型心肌梗死(non-ST segment elevation myocardial infarction,NSTEMI)合并左心室射血分数(left ventricular ejection fraction,LVEF)≤40%;(2)心源性休克(cardiogenic shock,CS)、顽固性心绞痛、急性心肌梗死(acute myocardial infarction,AMI)合并机械并发症、室性心律失常(ventricular arrhythmia,VA);(3)左主干狭窄90%以上或左主干病变合并3支冠状动脉血管病变;(4)肺动脉楔嵌压≥15 mmHg,伴终末器官低灌注证据或肺水肿。根据IABP应用时机分为术前组(PCI前置入,n=56)和术后组(PCI后置入,n=40)。本研究经廊坊市第四人民医院伦理委员会批准。
1.2 治疗方案
1.2.1 PCI治疗
两组患者行PCI手术的方案一致,入院后根据个体情况给予阿司匹林、氯吡格雷、血管紧张素转换酶抑制剂(angiotensin converting enzyme inhibitor, ACEI)、β受体阻滞剂、血小板糖蛋白Ⅱb/Ⅲa受体拮抗剂(platelet glycoprotein Ⅱ b/Ⅲ a receptor antagonist,GPI)、硝酸酯、他汀等常规药物治疗。选择右股动脉穿刺路径、按照标准技术进行造影和PCI,根据血管病变特点决定是否对非闭塞血管行PCI,术中使用普通肝素100 U/kg抗凝,术后给予依诺肝素5~7 d。PCI成功标准:病变血管残余狭窄≤30%和正常血流(TIMI 血流分级3级)且无手术严重并发症或紧急搭桥术。
1.2.2 IABP应用时机及置入方法
(1)IABP 应用时机:术前组于PCI前行IABP置入,PCI术后根据个体情况给予血管活性药、利尿药等;术后组于PCI后2 h行IABP置入,血管活性药、利尿药等使用方法与术前组相同。
(2)IABP 置入方法:根据患者身高选择8F 40 mL、7F30 mL IABP 导管。采用 Seldinger 技术于股动脉穿刺将其球囊鞘管顶端置入并延伸至左锁骨下动脉开口以下 2 cm 处,球囊鞘管远端置入肾动脉开口处; 球囊导管置入后连接ARROW ACAT2型IABP机,X 线摄片确定位置后启动反搏治疗(反搏频率设定为 1∶1),模式为心电图R波触发,主动脉球囊体积维持在30~40 mL。IABP 开始后给予低分子肝素持续静脉滴注,使活化凝血酶原检测值维持在 200~250 s。当正性肌力药物用量逐渐减少,血流动力学趋于平稳,尿量增加至>30 mL/h后,逐渐调低反搏频率至1∶4,当生命体征稳定30 min以上后,停止IABP反搏。
1.3 观察指标
(1)收集两组患者年龄、性别、合并疾病、冠心病类型、冠状动脉病变部位、左心室射血分数、LVEF及CS、AMI合并机械并发症、VA等术前临床资料。(2)比较两组患者手术前后平均动脉压(mean arterial pressure,MAP)、心率(heart rate,HR)及尿量。(3)记录两组患者支架置入数、无复流现象(TIMI血流分级≤2级)率、IABP 运转时间、IABP并发症、再次PCI率、院内病死率、术后30 d病死率等。(4)分析患者术后 30 d 死亡的危险因素。
1.4 统计学处理

2 结果
2.1 两组患者一般临床资料比较
术前组糖尿病、高血脂比例、左前降支和左主干病变、STEMI、CS比例均高于术后组(均P<0.05),难治性心绞痛比例低于术后组(P<0.05),见表1。
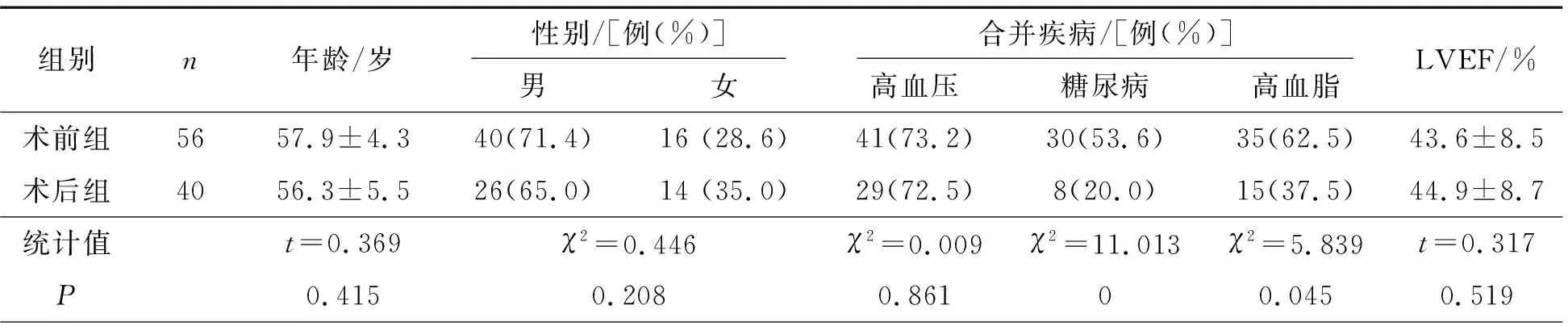
表1 两组患者一般临床资料比较

组别n 病变类型/[例(%)] 病变血管/[例(%)] STEMINSTEMI难治性心绞痛左主干左前降支左回旋支右冠状动脉CS/[例(%)] VA/[例(%)]AMI机械并发症/[例(%)]术前组56 28(50.0)19(33.9)9(16.1)18(32.1)31(55.4)20(35.7)24(42.9) 13(23.2)17(30.4)2(3.6)术后组4010(25.0)13(32.5) 17(42.5) 6(15.0)12(30.0)15(37.5)18(45.0)3(7.5)13(32.5)1(2.5)统计值χ2=6.103χ2=0.021χ2=8.233χ2=3.648χ2=6.091χ2=0.033χ2=0.041χ2=4.140χ2=0.056χ2=0.080P0.0290.5680.0010.0450.0290.4980.5040.0390.4650.307
2.2 两组手术前后血液动力学比较
两组术前MAP、HR、尿量比较差异均无统计学意义(均P>0.05),术后1d MAP、HR、尿量均有明显改善,但术前组改善程度大于术后组(P<0.05),见表2。
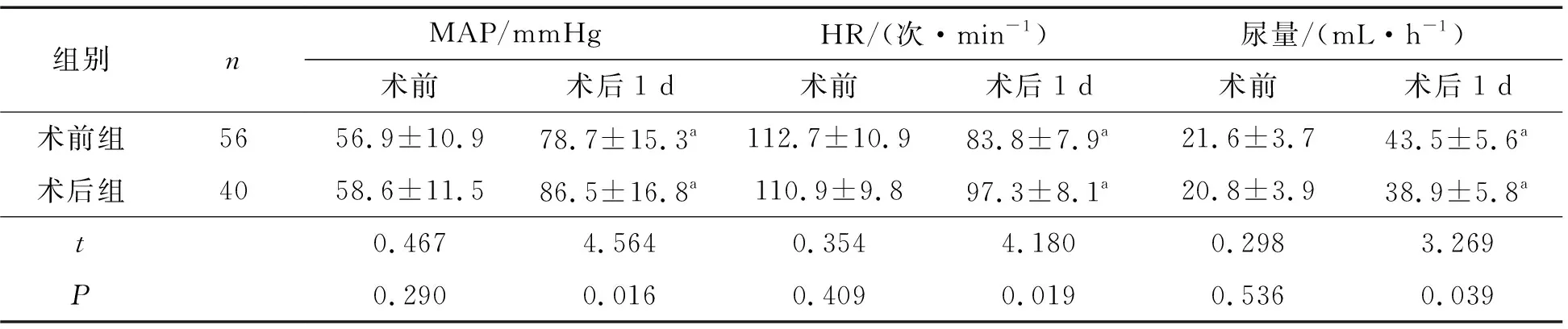
表2 两组手术前后血液动力学比较
2.3 两组术中术后结果
两组IABP并发症、无复流现象率比较差异无统计学意义(P>0.05),术前组IABP运转时间、再次PCI率、院内及术后30 d病死率均低于术后组(均P<0.05),见表3。

表3 两组术中术后结果
2.4 近期预后的多因素回归分析
Logistic多因素回归分析显示糖尿病、STEMI、CS、血小板糖蛋白Ⅱb/Ⅲa受体拮抗剂(GPI)、PCI后应用IABP与高危PCI患者的近期预后有关,而PCI后应用IABP是近期预后的独立危险因素[P=0.001,OR=3.309(1.69~8.45)]。见表4。

表4 近期预后的多因素回归分析
3 讨论
随着PCI技术的不断发展及GPI的应用,高危冠心病的预后得到明显改善,但左心功能降低、左主干及多支冠状动脉血管病变、AMI等高危因素可显著增加PCI的手术风险,已成为影响治疗效果的主要限制因素。因此,提高高危冠心病患者在缺血状态下对血流动力学的耐受性是PCI是否成功的关键。
IABP是国内外指南推荐、目前临床上最为常用的经皮左心室机械辅助装置[10],SHOCK研究发现,高危患者在行溶栓和 PCI 手术前置入IABP 可以迅速稳定病情,有效降低手术风险和恶性心律失常的发生[11]。血流动力学监测能够发现AMI伴心脏泵衰竭行IABP辅助的血流动力学变化[12]。IABP作为一种辅助治疗方式有助于心功能的保护,其与冠状动脉血管重建联合可减少心律失常的发生,提高手术的成功率并明显改善患者的预后[13]。IABP是通过心电或动脉压触发来控制球囊充气与排空的一种循环辅助装置:球囊在心脏舒张期充气,可使主动脉舒张压和冠状动脉压升高,从而增加心肌血流灌注;球囊在心脏收缩期前排气,可使主动脉压和心脏后负荷下降,从而减小心脏射血阻力和心肌耗氧。目前已有大量回顾性研究和病例组报告表明,IABP可常规应用高危PCI患者,并暗示疗效明显[14-16]。
IABP应用于高危 PCI的效果与IABP的置入时机有关,为最大限度地发挥IABP对缺血心肌的保护和抢救作用,IABP应尽早置入[17]。有研究认为,术前预防性置入IABP与术中、术后紧急挽救置入IABP相比,病死率可显著下降[18]。本研究中虽然术前组与术后组血流动力学均有改善,但PCI前置入IABP的术前组改善程度更为明显,原因可能是 IABP 在PCI术后早期不能提供有效的血流动力学支持,尽管PCI 术后心脏状态有所好转,但心肌损伤已经发生、心肌坏死无法逆转,使IABP的效能无法实现[19]。本研究中术前组与术后组相比,病情严重度较高,但术前组院内病死率和术后30 d病死率均低于术后组,表明IABP尽早置入可改善患者的近期预后。多因素回归分析也显示,PCI后IABP置入是术后30 d死亡的危险因素,说明PCI 前预防性置入IABP相对于PCI 后补救性置入IABP可给患者的近期病死率带来更大的收益。原因可能在于,高危PCI患者心肌处于严重缺血、缺氧,甚至坏死状态,心脏泵血功能较差,一旦发生泵功能衰竭,将造成重要脏器灌注急剧下降和严重受损,此时行IABP辅助的临床效果将明显降低。
本研究中高危PCI患者术后30 d病死率高于国外报道[20],可能与纳入病例病情较重有关:患者平均年龄高,合并高血压、糖尿病、高血脂比例高,病变血管中左主干比例高,且术后ST 段回落缓慢等。部分患者IABP置入时间较晚也可能是近期病死率较高的重要原因之一。术前应用IABP可使高危PCI患者再次PCI比例明显减少,表明术前保护性应用IABP的重要性。此外,SHOCK Ⅱ研究中短期随访发现,IABP辅助的高危PCI 患者,其30 d和1年病死率改善不明显,可能与IABP使用时间较短有关[21]。而PERERA等[22]在BCIS-1研究中表明, IABP治疗组5年病死率显著低于对照组。因此,需更长期的随访和高质量的研究来验证IABP对高危PCI患者预后的影响。本研究中IABP并发症发生率较低,未发生严重并发症,与医师IABP规范操作及密切监视有关。医师在IABP植入时选择较轻狭窄侧或无鞘置管方法,严密观察高危患者下肢血供,并行超声检查,发现问题及时慎重处理。此外对于IABP撤除时机,目前临床上还没有统一标准。建议在心脏指数>2.5 L/min·m2、尿量增加至30 mL/h、血管活性药用量减少、血压恢复、呼吸稳定、降低反搏比例时血流动力学稳定,可以考虑撤除。
综上所述,对于高危PCI患者,接受术前IABP置入相比术后IABP置入有更好的近期预后。但仅为非随机回顾性研究,影响因素较多,IABP置入时机对临床预后的影响还需要更多高质量的随机研究来验证。

