限制性因子黏液病毒抗性蛋白Ⅱ对乙型肝炎病毒复制的影响*
代 娟,胡 杰,彭 胡
1.重庆市九龙坡区中医院 检验科(重庆 400080);2.重庆医科大学(重庆 400016);3.泸州市中医医院 检验科(泸州 646000)
乙型肝炎病毒(hepatitis B virus,HBV)感染是重要的全球健康问题之一。据世界卫生组织统计,大约有20亿人感染HBV,其中有2.92亿患者为慢性乙型肝炎(chronic hepatitis B,CHB),每年大约有88.4万HBV患者死于HBV疾病或其并发症,如肝癌、肝硬化[1]。尽管有预防性重组疫苗,但每年仍有约 3 000 万人新发感染HBV[1]。目前治疗CHB获批的药物有Ⅰ型干扰素 (interferon,IFN) 和5种核苷(酸) 类 似 物 (nucleotide analogs,NAs)[2]。NAs能 抑 制HBV复制的逆转录过程,但很难降低血清中的乙肝表面抗原(HBsAg)水平[3],患者需终身治疗。IFN虽然仅适用于小部分患者,但在有限时间(通常为48周)治疗后,可持续抑制HBV的复制[4-5],目前已经鉴定出数百种具有抗病毒作用和免疫反应调节功能的IFN刺激基因[6-7]。
黏液病毒抗性蛋白 (myxovirus resistance proteins,MX) 在先天免疫防御中发挥重要作用,具有抗病毒 活性作用[8-10]。MX属于IFN诱导型GTP酶超家族[11-12], 在脊椎动物中高度保守[13]。人类有2个mx基因,即mx1、mx2,分 别 编 码MX1(又 称MXA)、MX2(又 称MXB)蛋白[14]。MX1具有广谱抗病毒活性,且主要针对RNA病毒[10]。MX2是一种受IFN诱导的能抑制人类I型免疫缺陷性病毒 (human immunodeficiency virus-1,HIV-1)、丙型病毒性肝炎(hepatitis c virus,HCV)和 疱 疹 病 毒(herpes simplex virus-1,HSV-1)感染的病毒限制性因子[15-20]。然而在肝癌HepG2细胞、含有牛磺胆酸钠协同转运肽(sodium taurocholate cotransporting peptide,NTCP)的HepG2细胞(简称HepG2-NTCP细胞)中,MX2对HBV的复制作用报道较少。因此,本研究拟利用IFNα诱导MX2表达,探索MX2对HBV复制的影响,为临床治疗HBV提供一定的实验基础。
1 材料与方法
1.1 材料
HepAD38细 胞、HBV过表达质粒pCH9/3091 genetype D (gtD)由重庆医科大学实验室保存;肝癌HepG2细 胞、HepG2-NTCP细 胞 购 自 美 国ATCC公司;胎牛血清购自美国Corning公司;DMEM培养基、青-链霉素购自美国Hyclone公司;opti-MEM购自美国Gibco公司;IFNα购自美国Proteintech公司;逆转录试剂盒购自日本Takara公司;MX2抗体购自美国Abcam公司;HA抗体购自美国Thermo Fisher Scientific公司;蛋白maker、ECL发光底物购自美国Bio-rad公司;SDS-PAGE凝胶配制试剂盒购自成都生工公司;GAPDH抗体购自上海碧云天公司;β-ACTIN和鼠、兔来源二抗购自北京中杉金桥公司;HBcAg抗体购自丹麦Dako公司;DIG探针标记检测试剂盒、PCR产物纯化试剂盒、Nylon膜、cocktail抑制剂购自美国Roche公司;Lipo3000转染试剂购自美国Invitrogen公司;PVDF膜购自美国Millipore公司;胶片、显影液、定影液购自美国柯达公司;mx2的qPCR引物在重庆擎科生物公司合成。
1.2 方法
1.2.1 质粒构建和细胞培养mx2表达质粒是由cDNA序 列(NM_002463.2)克 隆 到pcDNA3.1载 体上,羧基端带有HA标签; 用1%青-链霉素、10%胎牛血清的达尔贝科极限必需培养液(Dulbecco minimum essential medium,DMEM)培养基培养HepG2、HepG2-NTCP细胞,培养条件为4℃、5% CO2;按照Lipo3000转染试剂说明书转染过表达质粒或者siRNA。
1.2.2 荧光定量PCR检测HepG2、HepG2-NTCP细胞接种至6孔板中,通过不同浓度IFNα(0、100、1 000 U/mL)诱导处理2 d后,用TRIzol法提取细胞总mRNA[21],42℃消化去除基因组DNA,逆转录为cDNA,通过SYBR荧光染料进行荧光定量PCR[22],Bio-rad CFX荧光定量PCR仪检测mx2mRNA水平,HBV 前基因组RNA (pregenomic RNA,pgRNA)水平或者HBV DNA水平,采用2-ΔΔCt法,以actin作为内参,计算mx2mRNA或HBV pgRNA的变化情况;采用绝对定量检测HBV DNA水平:首先加入SYBR荧光染料5 μL,无酶水2 μL,HBV DNA定量上、下游引物0.5 μL,复制中间体样本 2 μL,使用HBV 1.1倍体pCH9/3091 gtD作为标准品,使用浓度为4×107、4×106、4×105、4×104、4×103、4×102拷贝/μL,10倍稀释。使用Bio-rad CFX荧光定量PCR仪进行扩增并检测荧光信号,从而检测HBV DNA水平。
1.2.3 蛋白质印迹技术检测HepG2、HepG2-NTCP细胞通过IFNα诱导、mx2siRNA干扰以及过表达mx2处理相应天数后,用RIPA(含10% cocktail)裂解液裂解细胞,提取蛋白,蛋白上样量为30 μg。10% SDS-PAGE电泳分离后,恒流转膜至PVDF膜上,5%脱脂牛奶室温封闭1 h,TBST洗涤后分别加入MX2、HA及β-ACTIN抗体,于4 ℃摇床孵育过夜。第2天TBST洗涤4次,8 min/次,然后加入山羊抗兔或山羊抗小鼠的二抗室温孵育1 h,TBST洗涤4次,8 min/次,最后采用ECL进行荧光显色,柯达胶片显影。
1.2.4 HBV病毒颗粒收集HepAD38细胞上清收集至50 mL离心管,4 000 r/min,离心半径17 cm,离心5 min,去除细胞碎片,使用0.45 μm的过滤器进一步除去细胞碎片,然后加入已经过滤除菌的PEG8000使其终浓度为5%,富集上清中的HBV病毒颗粒,4 ℃摇床过夜,4 000 r/min,离心半径17 cm,4 ℃ 离心30 min,弃掉上清,使用opti-MEM溶解后,取10 μL用于测定HBV病毒滴度。
1.2.5 HBV病 毒 颗 粒 感 染HepG2-NTCP细 胞将HepG2-NTCP细胞接种至6孔板,细胞贴壁后加入DMSO处理12 h;接着加入HBV病毒颗粒(病毒基因当量为500)进行感染,感染24 h后,更换新鲜培养液继续培养,以待进行蛋白收集、复制中间体提取等处理[23]。
1.2.6 HBV病毒核心颗粒DNA提取采用蔗糖密度梯度离心法提取HBV病毒核心颗粒中的DNA[24]:细胞在处理3~5 d后,PBS洗涤2次,用核心制备裂解缓冲液(10 mmol/L Tris-HCl,1 mmol/L乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA),1% NP-40,2%蔗糖)常温裂解15~20 min,转移至1.5 mL无酶EP管,12 000 r/min,离心半径8 cm,离心5 min,上清液转移至新的1.5 mL EP管,用微管酶37 ℃水浴消化1 h,去除外源DNA,然后在30%蔗糖密度介质中,45 000 r/min,离心半径11 cm,4 ℃超速离心2 h,提取病毒颗粒,蛋白酶K消化得到病毒颗粒,通过酚/氯仿/异戊醇抽提,并用乙醇沉淀得到HBV DNA。
1.2.7 DNA印迹技术检测配制1.2%琼脂糖凝胶,120 V恒压电泳1 h,随后碱变性使DNA成单链,中和后使用SSC转膜至Nylon膜上,紫外交联固定DNA后,采用预杂交液反应1 h,使用地高辛标记的DNA杂交液过夜,反复多次洗膜,使用blocking液封闭,与地高辛抗体反应后显影[23]。
1.3 统计学方法
采用SPSS 20.0统计软件对数据进行分析,定量资料以()表示,多组间比较采用单因素方差分析(One-way ANOVA),检验水准α除特别说明外均设定为0.05。
2 结果
2.1 IFNα对MX2 蛋白的作用
与对照组比较,经1 000 U/mL的IFNα处理后,HepG2、HepG2-NTCP细胞的MX2蛋白及mRNA水平均增加,差异有统计学意义(P<0.05)(图1、表1~2)。
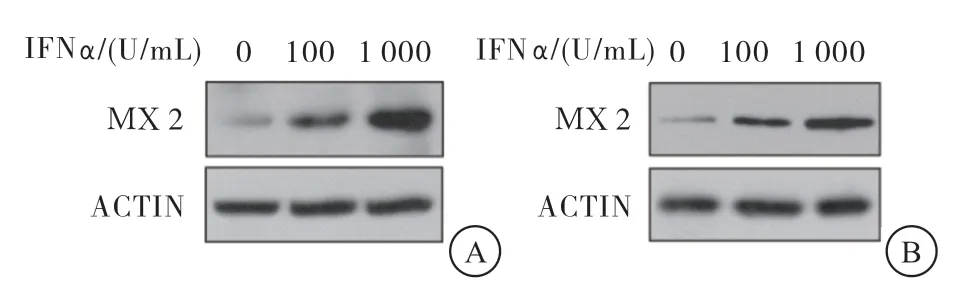
图1 经IFNα处理后,MX2蛋白在不同肝癌细胞中的表达
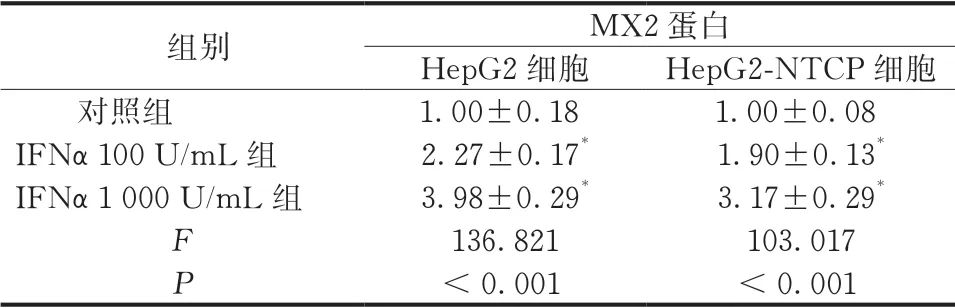
表1 IFNα对MX2 蛋白的作用( ,n=3)
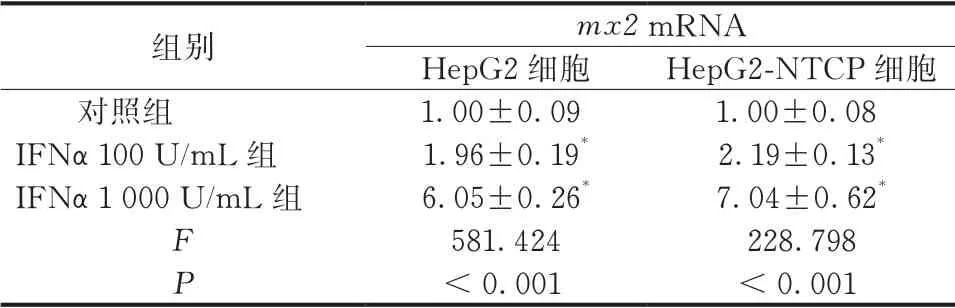
表2 IFNα对mx2 mRNA的作用( ,n=3)
2.2 过表达mx2对HBV DNA复制的影响
与对照组比较,HepG2细胞中过表达0、1、2 μg的HA-mx2后,DNA印迹技术检测结果显示,HBV DNA复制水平呈现梯度依赖性降低;同时蛋白质印迹技术检测结果显示,过表达HA-mx2后,HBcAg蛋白水平也呈现浓度依赖性降低;与对照组比较,在HepG2-NTCP细胞中过表达梯度的HA-mx2后,qPCR检测HBV DNA复制水平呈现梯度依赖性降低(P<0.05)(图2、表3)。

表3 过表达mx2对HepG2-NTCP细胞HBV DNA的影响( ,n=3)
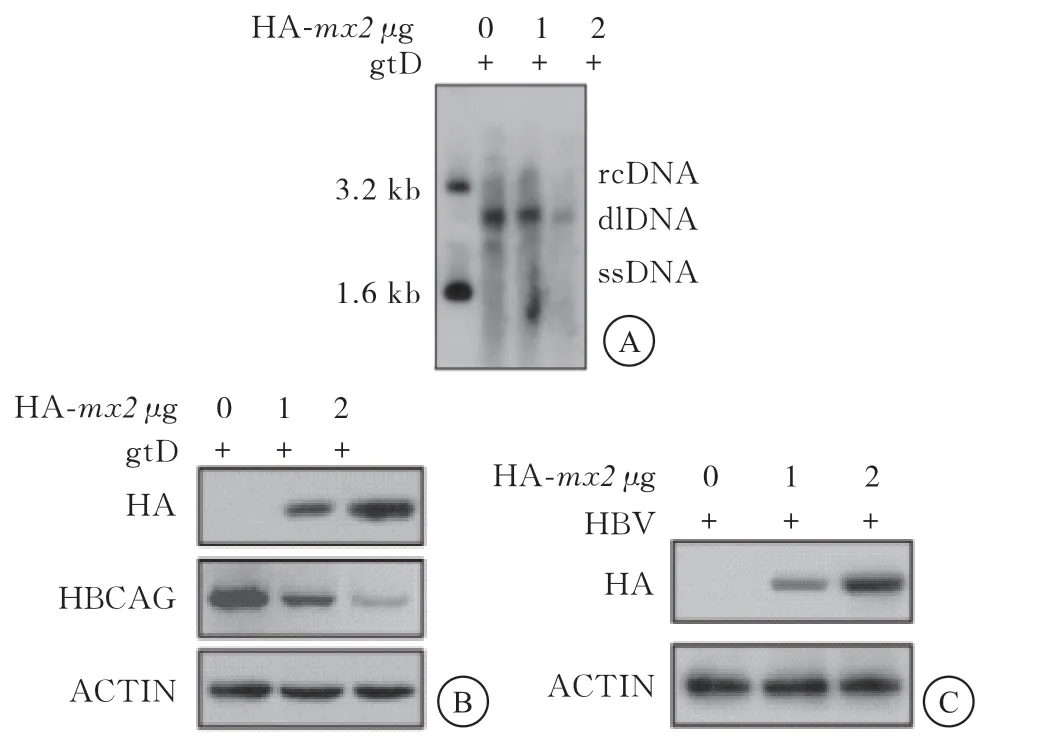
图2 过表达mx2对HBV的影响
2.3 过表达mx 2后对HBV pgRNA表达的影响
与对照组比较,在HepG2细胞中过表达梯度的HA-mx2后,qPCR检测结果显示,HBV pgRNA的水平呈现梯度依赖性降低,差异有统计学意义(P<0.05);与对照组比较,在HepG2-NTCP细胞中过表达梯度的HA-mx2后,HBV pgRNA的水平呈现梯度依赖性降低,差异有统计学意义(P<0.05)(表4)。

表4 过表达mx2对HBV pgRNA表达的影响( ,n=3)
2.4 siRNA敲低mx2后对HBV DNA复制的影响
与siNC组比较,在HepG2细胞中干扰内源性mx2后,HBV DNA复制水平及HBcAg蛋白水平明显升高;qPCR检测结果显示,与siNC组比较,在HepG2-NTCP细胞中干扰内源性mx2后,HBV DNA复制水平升高,差异有统计学意义(P<0.05)(图3、表5)。
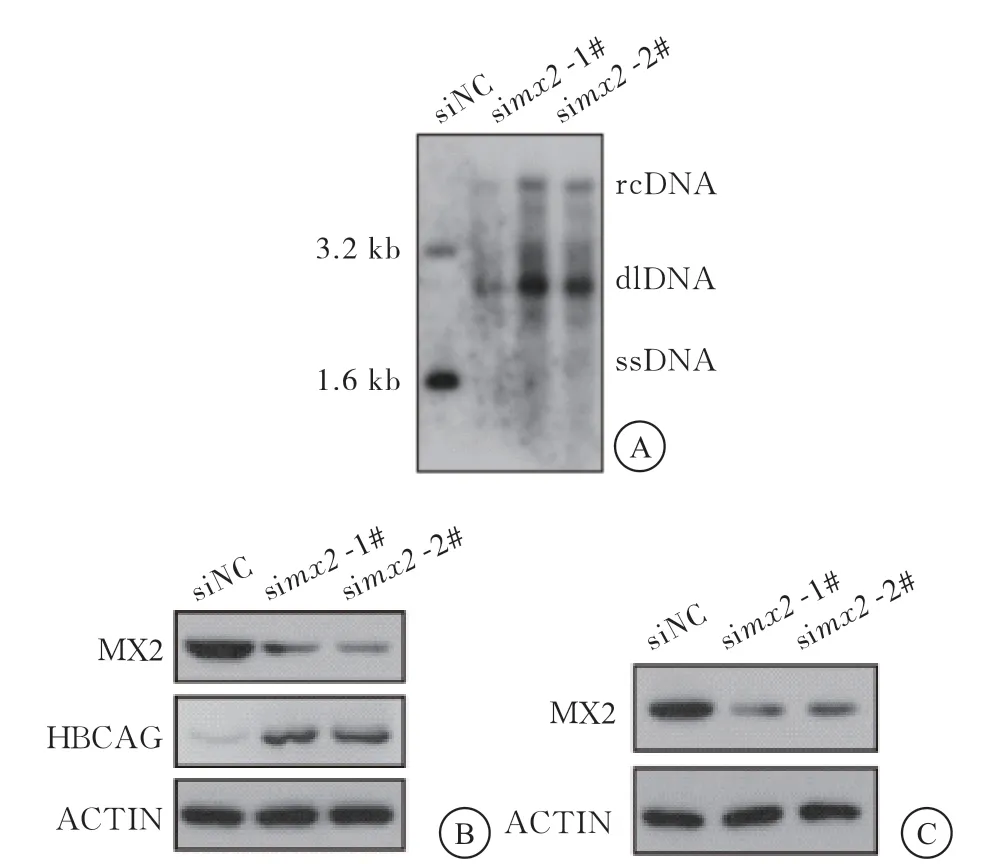
图3 siRNA敲低mx2后对HBV DNA的影响

表5 敲低mx2对HepG2-NTCP细胞HBV DNA的影响( ,n=3)
3 讨论
HBV或HCV病毒可导致病毒性肝炎,严重时可引发患者死亡[25-26]。HCV 在其抗病毒药物出现后便可治愈[27]。CHB在病理生理学及临床治疗方面均取得巨大进展。现阶段可通过抑制HBV病毒复制,从而防止肝病纤维化进展,对有活动性炎症和/或 HBV DNA 水平升高和/或肝损伤的患者进行治疗,以提高患者生活质量和生存率[28]。NAs对HBV病毒具有抑制作用,但CHB患者还不能实现功能性治愈。HBV病毒可通过补充具有半衰期长和完整病毒DNA形式的共价闭合环状 DNA (covalently closed circular DNA ,cccDNA)持续存在于肝细胞核中。
NTCP已被证明是HBV进入肝细胞的功能性受体[29],因此靶向病毒进入受体的新药可作为预防未感染肝细胞的潜在药物。布勒韦肽是从HBV 前S1结构域中获得的合成脂肽,当布勒韦肽与NTCP结合时,可有效阻止HBV在肝细胞中扩散,并阻碍受感染肝细胞中cccDNA池扩增[30-31]。
MX2可有效抑制HIV-1 的早期感染[7,15-17]。研究[16]表明, MX2 是Ⅰ型 IFN 抗 HIV-1 活性的效应物, MX2 通过抑制亚病毒复合物的衣壳依赖性入核来抑制 HIV-1、HCV[18]及HSV-1[19-20]感染。本研究发现,在HepG2和HepG2-NTCP细胞中,IFNα可诱导MX2蛋白和RNA水平升高,这与相关研究[15-16]结果一致。本研究还发现,在HepG2和HepG2-NTCP细胞中过表达HA-mx2后,HBV DNA复制和HBV pgRNA水平均呈梯度依赖性降低;与siNC组比较,使用小干扰RNA特异性敲低内源性mx2的表达后,其蛋白水平明显降低,但是HBV DNA复制水平明显升高。该结果与Wang等[32]研究结果一致,表明MX2能抑制HBV的复制。
综上所述,Ⅰ型IFNα可诱导MX2蛋白和mRNA表达上调,且MX2在HepG2和HepG2-NTCP肝癌细胞中能抑制HBV DNA的复制。本研究不足之处在于未检测细胞cccDNA水平,可在后续研究中验证此HBV指标,以确定MX2是否可通过降低HBV的cccDNA水平来调控HBV的复制。

