牦牛HMOX1基因克隆及生物信息学分析
张雅欣,张雅洁,李睿思,唐甜,吴贝宁,麻俊渊,杨妍梅
(西北民族大学生命科学与工程学院,甘肃兰州 730030)
牦牛是生活在青藏高原地区的珍稀物种,在长期进化 过程中表现出了极强的生态适应性,逐渐适应了高原低氧环境[1]。有大量关于高原动物低氧适应性的研究,目前已发现的有关低氧适应性的基因有缺氧诱导因子(HIF)、血管内皮生长因子(VEGF)、促红细胞生成素基因(EPO)和过氧化物酶体增殖剂激活受体α(PPARα)[2-4]等。张全伟[5]根据基因芯片筛选发现,HMOX1基因也可作为牦牛高原低氧适应性的候选基因之一。
HMOX1属于血红素加氧酶家族,又称为热休克蛋白32,广泛存在于动物体内。HMOX1基因在斑马鱼各组织中均有表达,其中肝脏表达量最高,其次是脾脏、鳃和肾等[6];HMOX1基因在藏绵羊脾脏中高表达,其次是肝脏和肾脏等[7];HMOX1基因在牦牛机体则是肺脏中表达量最高[5]。目前,关于HMOX1基因的低氧适应性在藏绵羊[7]、大鼠[8]、合作猪[9]和斑马鱼[10]等动物中均有研究,但该基因在牦牛低氧适应分子机制上的研究相关性报道较少。本研究以牦牛的HMOX1基因为研究对象,利用PCR技术获得CDS区序列,并进行相关的生物信息学分析,为牦牛HMOX1基因在低氧适应分子机制中的进一步研究以及牦牛的保护利用提供参考。
1 材料与方法
1.1 试验材料
1.1.1 样品采集
牦牛经天祝藏族自治县某屠宰场处死后,采集肺脏组织,立即放入RNA保护液,4℃保存运输,4 h内带回实验室,-80℃保存。
1.1.2 试验试剂
Trizol试剂(武汉塞维尔生物科技有限公司);PrimeScript™RT Master Mix(Perfect Real Time)反转录试剂盒、PrimeSTAR® Max DNA PolymerasePCR试剂盒、2000 bp DNAmarker和PMD18-T载体(TAKARA公司)。
氨苄青霉素、离心柱型通用型DNA纯化回收试剂盒、离心柱型BL21感受态细胞和质粒小提试剂盒(北京天根生化科技有限公司)。
1.2 试验方法
1.2.1 组织总RNA提取、cDNA合成
利用Trizol法提取牦牛肺脏组织总RNA,分光光度仪检 测 总RNA的 浓 度,选 择D260/D280值 在1.9~2.0范围,-80℃保存。根据反转录试剂盒说明书将总RNA反转录合成cDNA,置于-20℃保存。
1.2.2 引物设计及合成
根据NCBI公布的牦牛HMOX1基因序列(XM_005898270.2)的CDS区,利用primer 5.0软件进行引物设计,预期扩增片段长度为870 bp。
引物序列为:HMOX1-F:5'GGAATTCATGGAGCGCCCGCAGCCCGAC3';HMOX1-R:5'CCGCTCGAGTCACATGGCGTAAAGCCCC3'。引物由杨凌天润奥科生物科技有限公司合成。
1.2.3 PCR扩增及克隆
以牦牛肺脏组织cDNA为模板,进行PCR扩增。
反 应 体 系:PrimeScript™RT Master Mix 12.5 μL、cDNA 2 μL、上游引物0.5 μL、下游引物0.5 μL,RNase free ddH2O补足至25 μL。
反应程序为:94℃预变性3 min;94℃变性10 s,68℃退火15 s,72℃延伸60 s,共34个循环;72℃延伸10 min。
PCR扩增产物经2%浓度的琼脂糖凝胶电泳检测后,对目的片段进行切胶回收。
回收产物与PMD18-T载体在16℃条件下连接3 h,转化大肠杆菌BL21感受态细胞,涂布至含50 mg/L氨苄青霉素的LB固体平板上,过夜培养14 h。挑取单菌落进行培养,提取质粒进行PCR验证,并将质粒送至杨凌天润奥科生物科技有限公司进行测序。
1.2.4 牦牛HMOX1基因的生物信息学分析
采用在线软件ProtParam(https://web.expasy.org/protparam/)对牦牛HMOX1蛋白的理化性质进行分析;在线 软 件Protscale(https://www.expasy.ch/tools/pr-otscale.html)对牦牛HMOX1蛋白的疏水性进行分析;在线软件TMHMM(https://www.cbs.dut.dk/service/TMHMM)对牦牛HMOX1蛋白的跨膜结构域进项预测。
采用在线软件SignalIP(http://www.cbs.dtu.dk/services/SignalIP/)对牦牛HMOX1蛋白质信号肽进行预测;PSORTⅡPrediction(http://psort.hgc.jp/form.html)对HMOX1蛋白亚细胞定位进行预测;在线软件NetPhos(http://www.cbs.dtu.dk/services/NetPhos/)对牦牛HMOX1蛋白的磷酸化位点进行预测。
采用在线软件ExPASy-SOPMA(https://npsa-prabi.ibcp.fr/)对牦牛HMOX1蛋白的二级结构进行预测;在线软件SWISS-MODEL(https://swissmodel.expasy.org/)对牦牛HMOX1蛋白的三级结构进行预测;BLAST对HMOX1氨基酸序列进行同源性分析,并使用MEGA11.0构建系统进化树。
2 结果与分析
2.1 牦牛HMOX1基因的克隆及序列测定分析(见图1~图3)

图1 牦牛HMOX1基因PCR扩增检测结果Fig.1 Results of PCR amplification assay of HMOX1 gene in yak
由图1可知,利用Trizol法提取牦牛肺脏组织总RNA,反转录合成cDNA,以cDNA为模板进行pcr扩增后,经2%琼脂糖凝胶电泳检测,得到一条特异性的条带,大小在750~1 000 bp之间,与预期序列长度870 bp相符,初步确定此条带为牦牛HMOX1基因CDS区。
由图2、图3可知,牦牛HMOX1基因编码区长度为867 bp,编码289个氨基酸。本次克隆得到的牦牛HMOX1基因CDS与NCBI上公布的CDS对比发现有两个位点发生碱基突变,核苷酸同源性为99%。其中第622 bp处TTC突变为CTC,导致苯丙氨酸突变为亮氨酸;第822 bp处ACA突变为ACC,为同义突变。

图2 牦牛HMOX1基因CDS区核苷酸序列与克隆结果比对情况Fig.2 Nucleotide sequence of CDS region of HMOX1 gene of yak compared with cloning results

图3 牦牛HMOX1基因氨基酸序列与克隆结果比对情况Fig.3 Comparison of amino acid sequence and cloning results of yak HMOX1 gene
2.2 牦牛HMOX1蛋白的生物信息学分析
2.2.1 牦牛HMOX1蛋白的氨基酸序列及理化性质分析结果(见表1)
由表1可知,HMOX1基因CDS区包含870个核苷酸,编码289个氨基酸,包括35个负电荷氨基酸残基(Asp+Glu)和34个正电荷氨基酸残基(Arg+Lys),分子量为32 876.64,理论等电点为6.68。牦牛HMOX1蛋白的分子式为C1479H2325N401O431S8,组成的原子总数为4 644个。在哺乳动物细胞中的半衰期为30 h,在酵母中的半衰期大于20 h,在大肠杆菌中的半衰期大于10 h。预测该蛋白质的不稳定系数为55.07,表明该蛋白质为不稳定的蛋白质。
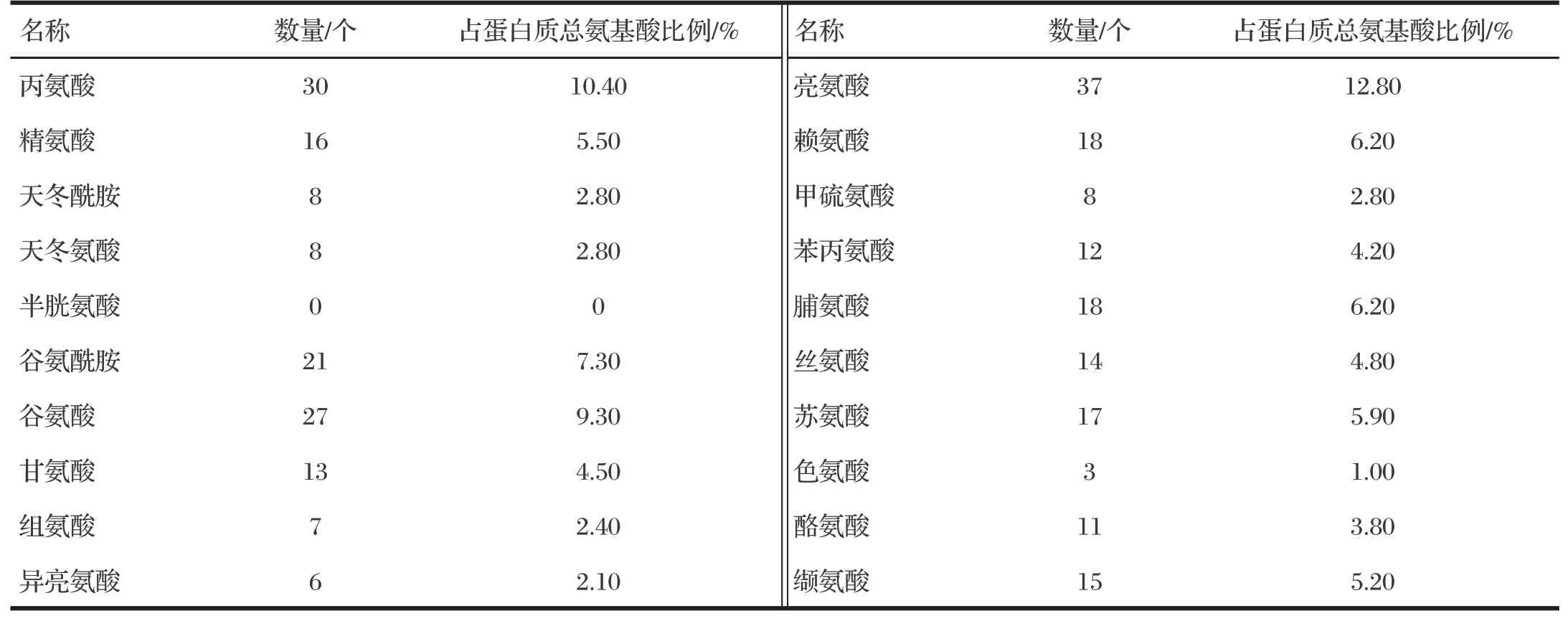
表1 HMOX1基因编码蛋白质的氨基酸组成分析结果Tab.1 Result of amino acid composition analysis of proteins encoded by HMOX1 gene
2.2.2 牦牛HMOX1蛋白的疏水性及跨膜结构域分析结果(见图4、图5)
由图4可知,第276位丝氨酸疏水性最强(+2.544),第67位谷氨酸和第68位精氨酸亲水性最强(-2.767),总平均亲水性为-0.447,表明HMOX1蛋白为亲水性蛋白质。

图4 牦牛HMOX1蛋白疏水性分析结果Fig.4 Result of hydrophobicity analysis of yak HMOX1 protein
由图5可知,牦牛HMOX1蛋白可能存在1个跨膜结构区域,其跨膜螺旋区预测位置在266~288,并且跨膜螺旋氨基酸残基数量的期望值为19.558 37,表明HMOX1蛋白为跨膜蛋白,可能与信号传导有关。

图5 牦牛HMOX1蛋白跨膜螺旋结构区域分析结果Fig.5 Result of analysis of transmembrane helix structure region of yak HMOX1 protein
2.2.3 牦牛HMOX1蛋白质信号肽预测结果(见图6)
由图6可知,C值为0.107,Y值为0.106,S值为0.117。信号肽主要位于分泌蛋白的N端,当S值均大于0.5时属于分泌蛋白,结果表明,牦牛HMOX1基因蛋白N端不存在信号肽,属于非分泌蛋白。
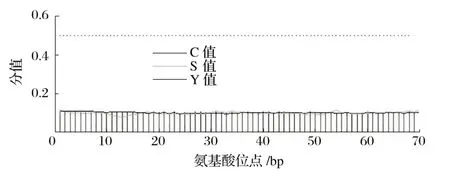
图6 牦牛HMOX1蛋白信号肽预测结果Fig.6 Predicted result of HMOX1 protein signal peptide in yak
2.2.4 牦牛HMOX1蛋白亚细胞定位预测结果(见图7)
由图7可知,牦牛HMOX1蛋白分布在细胞质的可能性为26.10%,在细胞核和分泌系统囊泡的可能性均为17.40%,在线粒体的可能性为13.00%,在浆膜的可能性为8.70%,在细胞骨架、空泡、内质网和高尔基体的可能性均为4.30%,表明牦牛HMOX1蛋白可能为胞质蛋白。
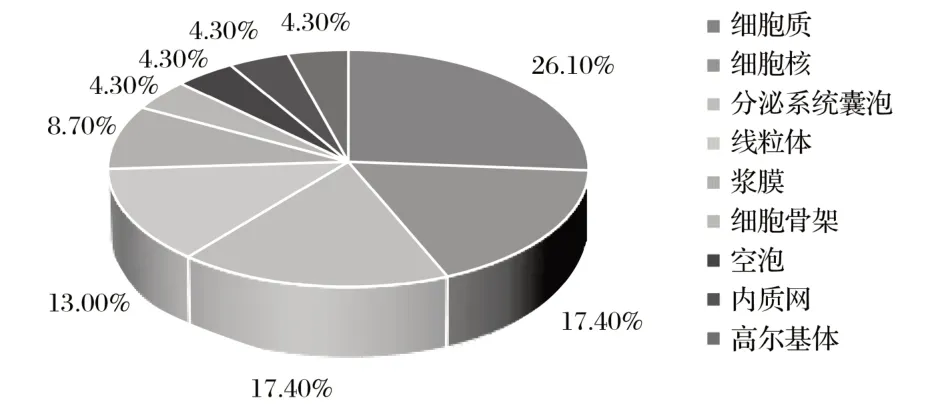
图7 牦牛HMOX1蛋白亚细胞定位预测结果Fig.7 Prediction result of subcellular localization of yak HMOX1 protein
2.2.5 牦牛HMOX1蛋白磷酸化位点预测结果(见图8)
由图8可知,有14个丝氨酸磷酸化位点,分别在第8、9、15、54、143、160、161、175、185、243、254、261、264和276位;有17个苏氨酸磷酸化位点,分别在第22、27、44、76、109、112、125、136、169、177、189、193、206、223、251、274和281位;有11个酪氨酸磷酸化位点,分别在56、59、75、79、98、108、115、135、138、183和287位。

图8 牦牛HMOX1蛋白磷酸化位点预测结果Fig.8 Prediction results of phosphorylation sites of yak HMOX1 protein
2.2.6 牦牛HMOX1蛋白二级结构预测结果(见图9)
由图9可知,有176个氨基酸参与α-螺旋,占比位60.90%;有12个氨基酸参与β-折叠,占比为4.15%;有91个氨基酸参与无规则卷曲,占比为31.49%。由此表明,牦牛HMOX1蛋白二级结构的主要形式为α-螺旋和无规则卷曲。

图9 牦牛HMOX1蛋白二级结构预测结果Fig.9 Prediction results of secondary structure of yak HMOX1 protein
2.2.7 牦牛HMOX1蛋白三级结构预测结果(见图10)
由图10可知,应用于建立该三维模型的氨基酸残基范围为11~224,以4wd4.1.A蛋白为模板,序列同源性为82.99%,GMQE值为0.76,QMEAN值为1.12,模型准确度可信。

图10 牦牛HMOX1蛋白三级结构预测结果Fig.10 Prediction results of tertiary structure of yak HMOX1 protein
2.2.8牦牛HMOX1基因同源性分析及系统进化树
将克隆得到的牦牛HMOX1核苷酸序列和在NCBI数据库中检索得到的牦牛(XM_005898270.2)、野牛(XM_010859613.1)、黄牛(NM_001014912.1)、杂交肉牛(XM_027541841.1)、瘤 牛(XM_019961273.1)、水 牛(XM_045165381.1)、绵羊(MK630326.1)、山羊(NM_001285567.1)、猪(NM_001004027.1)、羊 驼(XM_006207028.3)、野骆驼(XM_032492109.1)、单峰驼(XM_032492109.1)、双 峰 驼(XM_010946133.2)、马(XM_023631135.1)的核苷酸序列通过BLAST在线软件进行同源性比对,利用MEGA11.0构建系统进化树,见图11。
由图11可知,克隆得到的牦牛HMOX1核苷酸序列与牦牛、野牛、黄牛、杂交肉牛、瘤牛、水牛、绵羊、山羊、猪、羊驼、野骆驼、单峰驼、双峰驼和马的氨基酸序列同源性分别为99.77%、99.31%、99.19%、99.19%、99.08%、97.81%、96.19%、96.08%、88.51%、88.36%、88.02%、88.02%、87.90%和85.44%,说明牦牛与牛的亲缘关系最近,与羊的亲缘关系较近,与马的亲缘关系最远,符合实际情况。
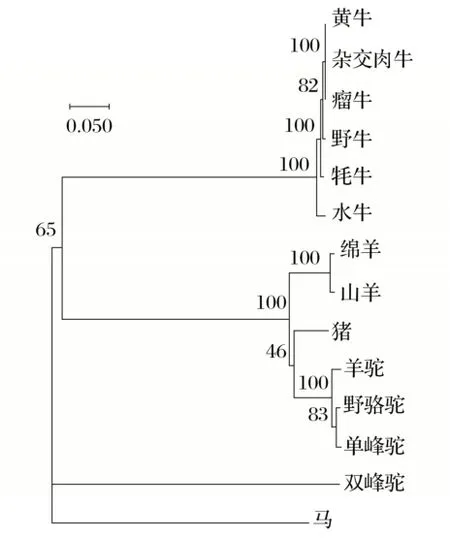
图11 HMOX1基因系统进化树Fig.11 Phylogenetic tree of HMOX1 gene
3 讨论
HMOX1是血红素分解代谢过程中的限速酶,广泛存在于机体组织,能够对低氧、氧化应激等刺激做出应答[11]。血红素具有强促氧化作用,对细胞器有害。当机体受到破坏性刺激时,游离血红素含量提高,促进HMOX1的表达并形成负反馈调节,血红素被分解形成胆绿素,进一步被还原为胆红素[12]。胆红素具有强抗氧化性,能够降低氧化应激引起的损伤,是心血管疾病等的保护因素[13]。
研究表明,HMOX1基因可导致深静脉血栓溶解[14],并通过诱导HMOX1的表达增强抗氧化的能力,减少氧化应激对血管的损伤[15]。宋佳伦等[16]通过质谱筛选,发现低氧诱导使胶质瘤干细胞(GSC)HMOX1基因高表达,可显著抑制GSC的活力。杜嘉祥等[17]研究发现,HMOX1表达下降会引起胞红蛋白(CYGB)表达下降,进而降低牦牛低氧适应能力。上述研究均表明,HMOX1基因对动物氧化应激以及低氧适应具有调控作用。
本试验通过克隆牦牛HMOX1基因CDS区,发现其编码区长度为867 bp,共编码289个氨基酸,该蛋白质的不稳定系数为54.14,大于40,表明HMOX1蛋白质为不稳定蛋白质。HMOX1蛋白为亲水性蛋白,存在一个跨膜结构区域,且二级结构的主要形式为α-螺旋和无规则卷曲,说明该结构是HMOX1蛋白重要的组成构件。
张全伟[5]对天祝白牦牛HMOX1蛋白进行结构与功能分析,发现存在289个氨基酸残基,不稳定系数为55.07,亲水性为-0.447,表明该蛋白为亲水性蛋白,存在一个跨膜结构区域。何建文[18]对藏绵羊HMOX1蛋白进行结构与功能分析,发现存在288个氨基酸残基,不稳定系数为81.04,亲水性为-0.489,表明该蛋白为亲水性蛋白,存在一个跨膜结构区域。本研究结果与上述结论一致。
本研究预测发现,有15个丝氨酸磷酸化位点、17个苏氨酸磷酸化位点和11个酪氨酸磷酸化位点,其中第8位、第161位和第185位丝氨酸磷酸化位点可能性为0.953、0.961和0.962,相对具有较高的可能性。蛋白质磷酸化是调节和控制蛋白质功能的重要机制,对信号转导等具有重要作用[19]。
本研究通过构建系统进化树,表明牦牛与牛的亲缘性最近,与羊的亲缘性较近,血红素加氧酶在进化过程中相对保守。王伟等[9]对合作猪HMOX1基因构建系统进化树,结果发现,合作猪与牛的氨基酸同源性为85.5%,符合进化情况。
4 结论
本试验成功克隆了HMOX1基因CDS区序列,对牦牛HMOX1蛋白进行了理化性质、亲水性、疏水性、跨膜结构域、磷酸化位点、信号肽、卷曲螺旋、二级结构和三级结构的分析,并构建了牦牛与其他品种牛HMOX1基因的进化关系。研究为深入分析牦牛HMOX1基因的生物学功能和对该基因低氧适应机制的深入研究及临床应用提供了一定参考。

