急性呼吸窘迫综合征患儿血清miR-499a-5p、MMP-16 mRNA水平变化及临床意义
宋宇雷,曹建设,王承娟,贺杰,肖政辉,张新萍
急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS)是由肺泡表面活性剂的原发性或继发性减少引起的一种以气体交换异常和急性低氧性呼吸衰竭为特征的呼吸系统疾病,进展快、预后差,是导致儿科重症监护室患儿死亡的重要原因[1-2]。及时评估ARDS患儿病情严重程度和预后对患儿预后改善有重要意义。研究表明,失控性炎性反应和肺泡上皮细胞、毛细血管内皮细胞损伤参与ARDS发生发展[3-4]。微小RNA(microRNA,miRNA)参与多种细胞因子转录调控,在ARDS炎性反应中扮演重要角色[5]。研究报道,上调miR-499-5p表达能抑制脓毒症诱导的肺组织炎性反应[6]。基质金属蛋白酶16(matrix metallopeptidase 16,MMP-16)是一种膜结合型酶,能通过激活MMP2、MMP9参与上皮细胞和毛细血管内皮细胞损伤[7-8]。目前,关于血清miR-499a-5p、MMP-16 mRNA水平与ARDS患儿病情严重程度和预后的关系尚无研究报道,因此现对其进行研究以期为改善ARDS患儿预后提供参考依据,报道如下。
1 资料与方法
1.1 临床资料 选取2019年1月—2022年1月湖南省儿童医院重症医学科收治的ARDS患儿105例作为ARDS组,其中男71例,女34例;年龄1~12(5.68±1.56)岁;体质量12~51(25.47±6.22)kg;ARDS病因:感染54例,创伤22例,肺栓塞24例,其他5例;参考“小儿急性呼吸窘迫综合征:小儿急性肺损伤会议共识推荐”[9]根据氧指数(OI)分为轻度亚组39例(OI 4~<8)、中度亚组42例(OI 8~<16)、重度亚组24例(OI≥16)。并根据ARDS患儿28 d临床结局分为存活亚组88例和死亡亚组17例。另选取同期医院体检健康儿童47例为健康对照组,其中男29例,女18例;年龄1~12(5.74±1.60)岁;体质量12~54(25.42±5.62)kg;2组儿童一般资料比较差异无统计学意义(P>0.05),具有可比性。本研究经医院伦理委员会批准(2019伦字023),受试儿家属或监护人知情同意并签署知情同意书。
1.2 病例选择标准 (1)纳入标准:①符合“小儿急性呼吸窘迫综合征:小儿急性肺损伤会议共识推荐”[9]中小儿ARDS诊断标准;②年龄1~12岁。(2)排除标准:①先天性疾病;②膈疝、表面活性物质、肺腺瘤样畸形等遗传性缺陷;③脑性过度换气;④恶性肿瘤;⑤严重肝肾功能障碍;⑥资料不全。
1.3 观测指标与方法
1.3.1 血清miR-499a-5p、MMP-16 mRNA检测:收集ARDS组入院时、健康对照组入组时受试儿肘静脉血3 ml,离心取上层血清保存于-80℃冰箱中待测。Trizol试剂盒(上海冠泰生物科技有限公司)提取血清总RNA,纯度、浓度合格后使用反转录试剂盒(日本TaKaRa Bio公司)逆转录合成cDNA,反转录体积10 μl:5×PrimeScript RT Master Mix 2.0 μl、RNA 2.0 μl、RNase Free H2O 6.0 μl;反应条件:37℃逆转录反应15 min、85℃逆转录酶失活反应5 s、4℃反应至结束后保存于-20℃冰箱中。按照SYBR®Premix Ex TaqTM试剂盒(日本TaKaRa Bio公司)进行PCR扩增:miR-499a-5p正向引物 5′-ACTGCTTAAGACTTGGAGTGA-3′,反向引物 5′-TACATTGGTGTCGTGGAGTCGGCAA-3′;内参U6正向引物 5′-CTCGCTTCGGCAGCACA-3′,反向引物 5′-AACGCTTCACGAATTTGCGT-3′;MMP-16 mRNA正向引物 5′-AGCACTGGAAGACGGTTGG-3′,反向引物 5′-CTCCGTTCCGCAGACTGTA-3′;内参GAPDH正向引物 5′-GCAAATTCCATGGCACCGT-3′,反向引物 5′-TCGCCCCACTTGATTTTGG-3′。PCR反应体积20 μl:SYBR®Premix Ex Taq 10 μl、正反向引物各0.8 μl、cDNA模板2.0 μl、ROX Reference Dye 0.4 μl、RNase Free H2O 6.0 μl;反应条件:95℃预变性90 s、95℃变性30 s、63℃退火30 s、72℃延伸15 s,循环40次后收集熔解曲线,采用2-ΔΔCT法计算血清miR-499a-5p、MMP-16 mRNA相对表达量。
1.3.2 动脉血气分析:ARDS患儿入儿科重症监护室后首次机械通气时与健康对照组体检时采用丹麦雷度米特ABL9血气分析仪进行动脉血气分析,包括动脉血二氧化碳分压(PaCO2)、动脉血氧分压(PaO2)、血氧饱和度(SaO2)、吸入氧浓度、平均气道压,并计算氧指数(oxygen index,OI)=吸入氧浓度×平均气道压×100/PaO2。
2 结 果
2.1 2组血清miR-499a-5p、MMP-16 mRNA水平比较 ARDS组血清miR-499a-5p、MMP-16 mRNA水平分别为(1.27±0.31)、(3.08±0.62),健康对照组分别为(2.85±0.46)、(1.07±0.37),ARDS组血清miR-499a-5p水平低于健康对照组,MMP-16 mRNA水平高于健康对照组(t=21.349、24.932,P均<0.001)。
2.2 不同亚组间ARDS患儿血清miR-499a-5p、MMP-16 mRNA水平比较 轻度亚组、中度亚组、重度亚组血清miR-499a-5p水平依次降低,MMP-16 mRNA水平依次升高(P均<0.01)。死亡亚组血清miR-499a-5p水平低于存活亚组,MMP-16 mRNA水平高于存活亚组(P均<0.01),见表1。
表1 不同亚组ARDS患儿血清miR-499a-5p、MMP-16 mRNA水平比较
2.3 2组动脉血气分析比较 ARDS组PaCO2、OI高于健康对照组,PaO2、SaO2低于健康对照组(P均<0.01),见表2。
表2 ARDS组与健康对照组动脉血气分析指标比较
2.4 ARDS患儿血清miR-499a-5p、MMP-16 mRNA水平与血气分析指标的相关性 经https://www.targetscan.org/vert_72/网站预测,miR-499a-5p与MMP-16的3′-非翻译区存在结合位点(图1)。Pearson/Spearman相关性分析显示,ARDS患儿血清miR-499a-5p与MMP-16 mRNA水平呈负相关(r=-0.603,P<0.001);ARDS患儿血清miR-499a-5p水平与PaCO2、OI呈负相关,与PaO2、SaO2呈正相关(P均<0.01),MMP-16 mRNA水平与PaCO2、OI呈正相关,与PaO2、SaO2呈负相关(P均<0.01),见表3。

图1 miR-499a-5p与MMP-16结合位点示意图

表3 ARDS患儿血清miR-499a-5p、MMP-16 mRNA水平与血气分析指标的相关性
2.5 血清miR-499a-5p、MMP-16 mRNA水平对ARDS患儿死亡的预测价值 ROC曲线分析显示,血清miR-499a-5p、MMP-16 mRNA水平及二者联合预测ARDS患儿死亡的AUC分别为0.793、0.781、0.888,二者联合预测ARDS患儿死亡的AUC大于单独预测(Z=1.995、2.162,P=0.046、0.031),见表4、图2。
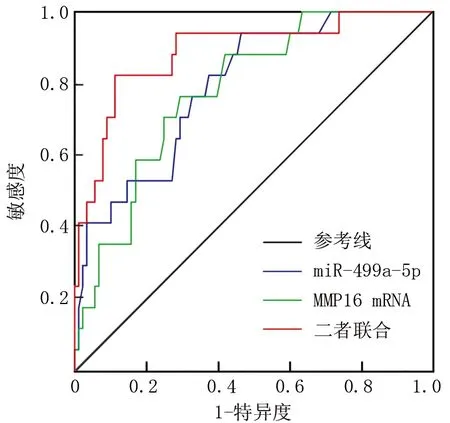
图2 血清miR-499a-5p、MMP-16 mRNA水平单独与联合预测ARDS患儿死亡的ROC曲线
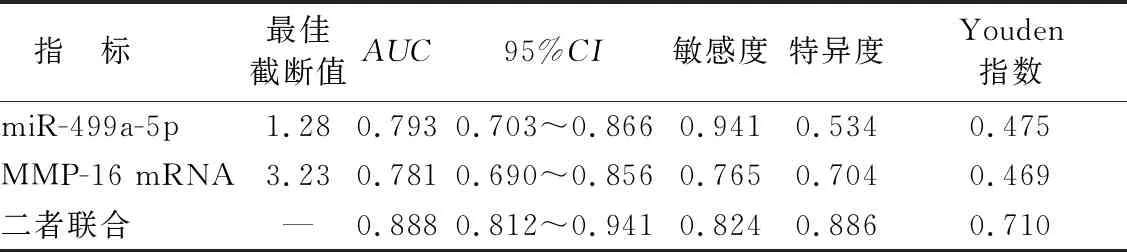
表4 血清miR-499a-5p、MMP-16 mRNA水平及二者联合对ARDS患儿死亡的预测价值
3 讨 论
小儿ARDS是临床常见的危重症,与成人ARDS具备肺容积减少、肺顺应性降低和通气/血流比值失常等相似的病理特征,但在病因、危险因素、合并症和治疗预后方面仍存在较大差异[10]。2015年国际上首次制定了小儿ARDS共识,新共识根据OI或脉氧饱和度指数定义小儿ARDS和病情分级,而非成人ARDS的氧合指数[9-11]。尽管近年来高级呼吸护理、外源性表面活性剂、营养和液体管理、皮质类固醇等方式和药物极大地改善了ARDS患儿预后,但病死率仍高达17.3%~21.2%[2,12]。因此,早期评估其病情严重程度和预后意义重大。
研究表明,失控性炎性反应参与ARDS发生发展,各种病因能直接或间接通过炎性反应破坏肺泡—毛细血管屏障中的肺泡上皮和肺毛细血管内皮,导致肺水肿和血管通透性增加,使肺功能持续恶化[3]。miRNA是一类小非编码RNA分子,通过与mRNA的3′-非翻译区互补配对调控基因表达,进而参与ARDS发生发展[13-14]。如miR-223能靶向NOD样受体热蛋白结构域相关蛋白3抑制肺微血管内皮细胞炎性反应、氧化应激和凋亡[15]。miR-224能靶向抑制p21增加肺微血管内皮细胞损伤[16]。miR-499a-5p是一种高度保守的miRNA,定位于人20号染色体q11.22,既往研究多报道其与恶性肿瘤的关系,近年研究发现,miR-499a-5p还是一个与炎性反应密切相关的miRNA。在脂多糖建立脓毒症心肌功能障碍模型中,上调miR-499a-5p能抑制脓毒症心肌功能障碍发生[17]。Guan等[18]通过氧—糖剥夺建立星形胶质细胞炎性反应发现,上调miR-499a能靶向第10号染色体缺失的磷酸酶抑制星形胶质细胞炎性反应。上述研究提示,miR-499a-5p具有抗炎作用。且近期研究指出,miR-499-5p能靶向SRY-Box转录因子6抑制脓毒症诱导的肺损伤[6]。本研究结果显示,ARDS患儿血清miR-499a-5p水平明显降低,且随着病情加重而降低,说明血清miR-499a-5p水平降低参与小儿ARDS发生发展,分析可能与miR-499a-5p具有抗炎作用有关。段凌霄等[19]研究也报道,在盲肠穿刺构建的ARDS大鼠模型中,上调miR-499a-5p表达能抑制肺泡上皮细胞中白介素-1β、白介素-6、肿瘤坏死因子-α等促炎因子表达,减轻ARDS大鼠肺组织损伤。
肺泡上皮、肺毛细血管内皮和基底膜等构成的肺泡—毛细血管屏障破坏是ARDS发生的核心环节,基底膜降解是肺泡—毛细血管屏障破坏的重要原因之一[20-21]。MMPs是多种组织和细胞产生的一种胶原蛋白水解酶,因其能降解细胞外基质的各种蛋白组分而受到广泛关注,同时MMPs还能导致细胞—基质和细胞—细胞间作用变化,激活多种细胞因子和表面受体,参与炎性反应发生发展[22]。MMP2和MMP9是MMP家族常见成员,近年研究表明,MMP2、MMP9能通过炎性反应和降解细胞外基质破坏肺泡—毛细血管屏障,参与ARDS发生发展[23-25]。MMP-16是MMPs家族中的一种膜结合型酶,也被称为膜型MMP2和膜型MMP3,能通过切割MMP2、MMP9的前结构域促进MMP2、MMP9激活[8]。本研究结果显示,ARDS患儿血清MMP-16 mRNA水平明显升高,且随着病情加重而升高,说明血清MMP-16 mRNA水平升高参与小儿ARDS发生发展,分析可能与MMP-16 mRNA表达上调能促进MMP2、MMP9表达,二者通过炎性反应和降解细胞外基质破坏肺泡—毛细血管屏障参与ARDS发生发展有关。本研究通过TargetScan 7.2数据库预测发现,miR-499a-5p与MMP-16的3′-非翻译区存在结合位点,Pearson相关性分析也显示,二者在ARDS患儿血清中表达呈负相关,提示miR-499a-5p与MMP-16可能共同参与小儿ARDS发生发展。有研究通过荧光素酶报告基因实验证实,上调miR-499a-5p能靶向下调MMP-16表达,降低肺泡中促炎细胞因子表达,减轻ARDS大鼠的肺损伤[19]。进一步证实miR-499a-5p、MMP-16共同参与ARDS发生发展。本研究通过分析血清miR-499a-5p、MMP-16水平与ARDS患儿预后的关系发现,与存活亚组比较,死亡亚组血清miR-499a-5p水平明显降低而MMP-16 mRNA水平明显升高,提示血清miR-499a-5p、MMP-16 mRNA水平还与ARDS患儿预后有关。ROC曲线分析也显示,血清miR-499a-5p、MMP-16 mRNA水平预测ARDS患儿死亡的AUC分别为0.793、0.781,说明二者可作为ARDS患儿预后的辅助预测指标。分析原因可能是血清miR-499a-5p越低和MMP-16 mRNA水平越高反映ARDS患儿肺泡—毛细血管屏障破坏越严重,导致肺功能和结构进一步恶化,因此死亡风险更高。同时本研究ROC曲线分析还显示,血清miR-499a-5p、MMP-16 mRNA水平联合预测ARDS患儿死亡的AUC为0.888,较二者单独预测的AUC显著增加,说明联合检测血清miR-499a-5p、MMP-16 mRNA水平能提升ARDS患儿预后预测价值,有利于指导临床制定治疗对策以改善ARDS患儿预后。
综上所述,ARDS患儿血清miR-499a-5p水平低表达,MMP-16 mRNA水平高表达,二者可能共同参与小儿ARDS发生发展,与ARDS患儿病情严重程度和预后密切相关,可作为ARDS患儿预后预测指标。但本研究样本量较少,还需多中心大样本研究进一步证实;同时关于miR-499a-5p、MMP-16参与ARDS的机制有待进一步研究。
利益冲突:所有作者声明无利益冲突
作者贡献声明
宋宇雷:设计研究方案,实施研究过程,论文撰写;曹建设:课题设计,论文撰写;王承娟:进行统计学分析;贺杰:实施研究过程,资料搜集整理,论文修改;肖政辉、张新萍:提出研究思路,分析试验数据,论文审核

