聚焦2022年高考命题中异彩纷呈的铜
孙 晶
(山东省日照市莒县第四中学)
铜是人类最早发现并广泛使用的金属,铜及其化合物以其悠久的冶炼和应用历史、绚丽多姿的颜色、多元的命题角度(如氧化还原反应、结构分析、配合物理论、催化剂、反应机理等)和多样的转化关系频频活跃在历年高考舞台上,成为高考命题中必不可少的经典元素之一.下面结合近5年全国各地高考有关铜的命题予以剖析,以期帮助学生对铜的命题动向和考查趋势有所了解,使他们在以后的学习过程中能更加有的放矢,事半功倍.
1 近5年高考命题呈现形式
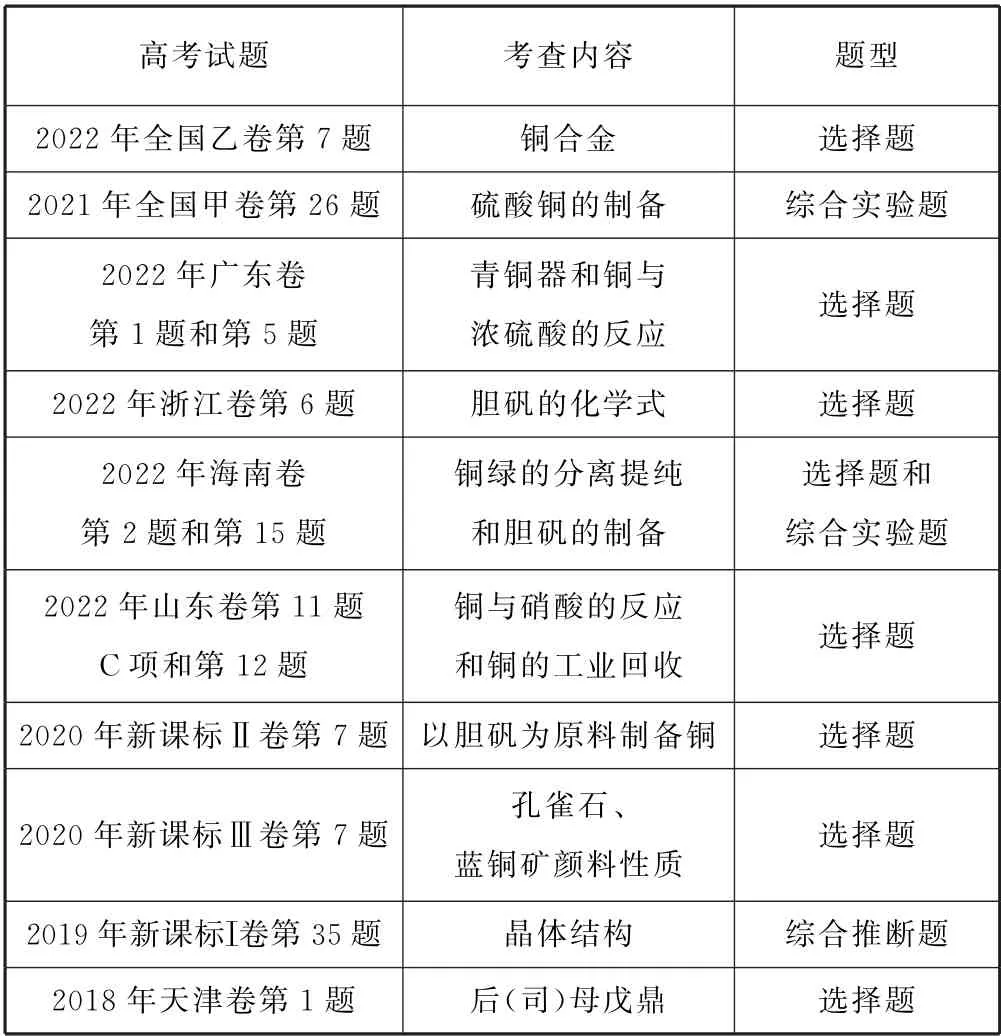
表1
2 高考命题角度展示
2.1 融合STSE考查铜合金
例1(2022年全国乙卷)生活中处处有化学,下列叙述正确的是().
A.HB铅笔芯的成分为二氧化铅
B.碳酸氢钠可做食品膨松剂
C.青铜和黄铜是不同结构的单质铜
D.焰火中红色来源于钠盐灼烧
解析铅笔芯的主要成分为石墨,不含二氧化铅,选项A 错误.碳酸氢钠不稳定,受热易分解产生二氧化碳,能使面团松软,可做食品膨松剂,选项B正确.青铜是在纯铜(紫铜)中加入锡或铅的合金,黄铜是由铜和锌所组成的合金,两者均属于混合物,不是铜单质,选项C错误.钠元素灼烧显黄色,选项D 错误.答案为B.
2.2 融合传统文化考查铜绿提纯
例2(2022年海南卷)《医学入门》中记载我国传统中医提纯铜绿的方法:“水洗净,细研水飞,去石澄清,慢火熬干.”其中未涉及的操作是().
A.洗涤 B.粉碎 C.萃取 D.蒸发
解析铜绿的化学式为Cu2(OH)2CO3,水洗净是指洗去铜绿固体表面的可溶性污渍、泥沙等,涉及的操作方法是洗涤;细研水飞是指将固体研成粉末后加水溶解,涉及的操作方法是粉碎和溶解;去石澄清是指倾倒出澄清液,去除未溶解的固体,涉及的操作方法是倾倒;慢火熬干是指用小火将溶液蒸发至有少量水剩余,涉及的操作方法是蒸发.因此未涉及的操作方法是萃取.答案为C.
2.3 融合实验考查铜与浓硫酸反应
例3(2022年广东卷)若将铜丝插入热浓硫酸中进行如图1(a~d均为浸有相应试液的棉花)所示的探究实验,下列分析正确的是().

图1
A.Cu与浓硫酸反应,只体现H2SO4的酸性
B.a处变红,说明SO2是酸性氧化物
C.b或c处褪色,均说明SO2具有漂白性
D.试管底部出现白色固体,说明反应中无H2O生成
解析铜和浓硫酸反应过程中,生成CuSO4体现出浓硫酸的酸性,生成SO2体现出浓硫酸的强氧化性,选项A 错误.a处的紫色石蕊溶液变红,其原因是SO2溶于水生成了酸,可说明SO2是酸性氧化物,选项B正确.b处品红溶液褪色,其原因是SO2具有漂白性,而c处酸性高锰酸钾溶液褪色,其原因是SO2和KMnO4发生氧化还原反应,SO2体现出还原性,选项C错误.实验过程中试管底部出现白色固体,根据元素守恒可知,其成分为无水CuSO4,而非蓝色的CuSO4·5H2O,其原因是浓硫酸体现出吸水性,将反应生成的H2O 吸收,选项D 错误.答案为B.
2.4 融合工艺流程考查铜粉的制备
例4(2022年山东卷)高压氢还原法可直接从溶液中提取金属粉.以硫化铜精矿(含Zn、Fe元素的杂质)为主要原料制备Cu粉的工艺流程如图2所示,可能用到的数据见表2.

图2

表2
下列说法错误的是().
A.固体X 主要成分是Fe(OH)3和S;金属M为Zn
B.浸取时,增大O2压强可促进金属离子浸出
C.中和调pH 的范围为3.2~4.2
D.还原时,增大溶液酸度有利于Cu的生成
解析CuS精矿(含有Zn、Fe元素的杂质)在高压O2作用下,用硫酸溶液浸取,CuS反应产生CuSO4、S、H2O,Fe2+被氧化为Fe3+,然后加入NH3调节溶液的pH,使Fe3+形成Fe(OH)3沉淀,而Cu2+、Zn2+仍以离子形式存在于溶液中,过滤得到的滤渣中含有S、Fe(OH)3;滤液中含有Cu2+、Zn2+;然后向滤液中通入高压H2,根据元素活动性:Zn>H>Cu,Cu2+被还原为Cu 单质,通过过滤分离出来;而Zn2+仍以离子形式存在于溶液中,再经一系列处理可得到Zn单质.经上述分析可知固体X 的主要成分是S、Fe(OH)3,金属M 为Zn,选项A 说法正确.CuS难溶于硫酸,在溶液中存在沉淀溶解平衡:CuS(s)⇌Cu2+(aq)+S2-(aq),增大O2的浓度,可以消耗S2-,使之转化为S,从而使沉淀溶解平衡正向移动,即可促进金属离子的浸取,选项B 说法正确.根据流程图可知,用NH3调节溶液的pH 时,要使Fe3+转化为沉淀,而Cu2+、Zn2+仍以离子形式存在于溶液中,结合离子沉淀的pH 范围,可知中和时应该调节溶液的pH 范围为3.2~4.2,选项C说法正确.在用H2还原Cu2+变为Cu单质时,H2失去电子被氧化为H+,与溶液中OH-结合形成H2O,若还原时增大溶液的酸度,c(H+)增大,不利于H2还原Cu2+,因此不利于Cu的生成,选项D 说法错误.答案为D.
2.5 融合氧化还原反应考查胆矾制备
例5(2022年海南卷)胆矾(CuSO4·5H2O)是一种重要化工原料,某研究小组以生锈的铜屑为原料[主要成分是Cu,含有少量的油污、CuO、CuCO3、Cu(OH)2]制备胆矾.流程如图3所示.
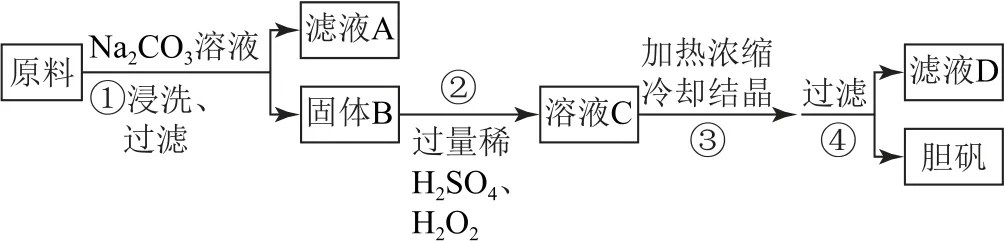
图3
回答下列问题:
(1)步骤①的目的是_________.
(2)步骤②中,若仅用浓H2SO4溶解固体B,将生成_________(填化学式)污染环境.
(3)步骤②中,在H2O2存在下Cu 溶于稀H2SO4,反应的化学方程式为________.
(4)经步骤④得到的胆矾,不能用水洗涤的主要原因是________.
(5)实验证明,滤液D 能将I-氧化为I2.
ⅰ.甲同学认为不可能是步骤②中过量H2O2将I-氧化为I2,理由是________.
ⅱ.乙同学通过实验证实,只能是Cu2+将I-氧化为I2,写出乙同学的实验方案及结果_________(不要求写具体操作过程).
解析由流程图中的信息可知,原料经Na2CO3溶液浸洗后过滤,可以除去原料表面的油污;固体B与过量的稀H2SO4、H2O2反应,其中的CuO、CuCO3、Cu(OH)2均转化为CuSO4,故溶液C为硫酸铜和稀硫酸的混合液,加热浓缩、冷却结晶、过滤后得到胆矾.
(1)原料表面含有少量的油污,Na2CO3溶液呈碱性,可以除去原料表面的油污.
(2)在加热的条件下,铜可以与浓硫酸发生反应生成CuSO4、SO2和H2O,SO2是一种大气污染物,步骤②中,若仅用浓H2SO4溶解固体B,将生成SO2污染环境.
(3)步骤②中,在H2O2存在下Cu 溶于稀H2SO4,反应的化学方程式为
Cu+H2O2+H2SO4(稀)=CuSO4+2H2O.
(4)胆矾是一种易溶于水的晶体,因此,经步骤④得到的胆矾,不能用水洗涤.
(5)ⅰ.H2O2常温下即能发生分解反应,在加热的条件下,其分解更快,因此,甲同学认为不可能是步骤②中过量H2O2将I-氧化为I2.理由是溶液C经步骤③加热浓缩后H2O2已完全分解.ⅱ.I-氧化为I2时溶液的颜色会发生变化;滤液D 中含有CuSO4和H2SO4,乙同学实验方案是除去溶液中的Cu2+,然后再向其中加入含有I-的溶液,观察溶液是否变色.除去溶液中Cu2+的方法有多种,可以加入适当的沉淀剂将其转化为难溶物,如加入Na2S将其转化为CuS沉淀.因此,乙同学的实验方案为取少量滤液D,向其中加入适量Na2S溶液,直至不再有沉淀生成,静置后向上层清液中加入少量KI溶液.实验结果为:上层清液不变色,证明I-不能被除去Cu2+的溶液氧化,故只能是Cu2+将I-氧化为I2.
答案(1)除油污.
(2)SO2.
(3)Cu+H2O2+H2SO4(稀)=CuSO4+2H2O.
(4)胆矾晶体易溶于水.
(5)溶液C经步骤③加热浓缩后H2O2已完全分解;取滤液,向其中加入适量Na2S,使铜离子恰好完全沉淀,再加入I-,不能被氧化.
3 备考策略与解题技巧
3.1 学会构建价类二维图
从物质类别角度和化合价角度掌握铜及其化合物性质,可以分门别类地进行知识梳理,形成知识体系.相同价态的铜的化合物的转化主要涉及复分解反应;不同价态的铜及其化合物的转化涉及氧化还原反应.构建铜及其化合物价类二维图,如图4所示.

图4
3.2 明晰铜及其重要化合物的具体转化
通过具体物质之间的转化图(如图5),可以从类别具体到物质,针对性更强.
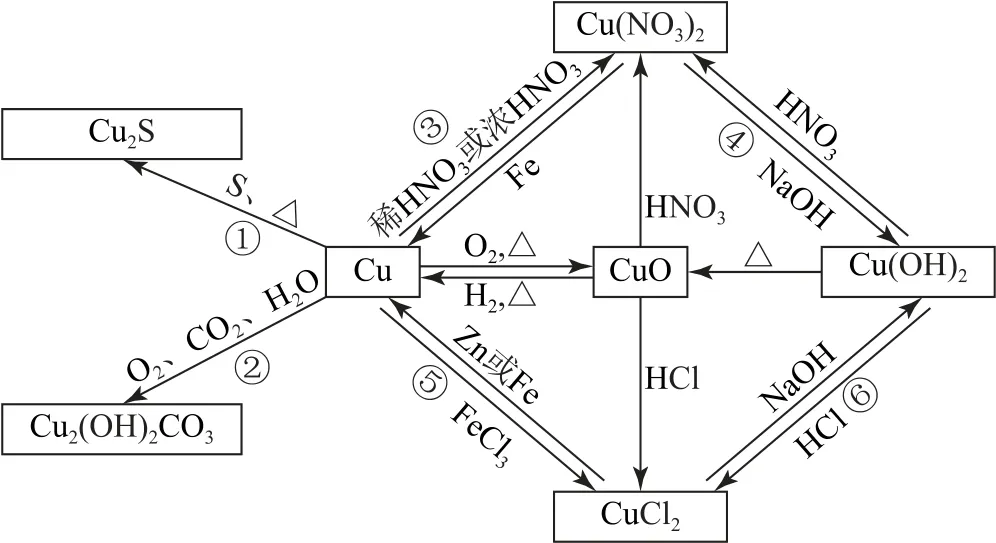
图5
3.3 掌握铜及其化合物的特征颜色与溶解性
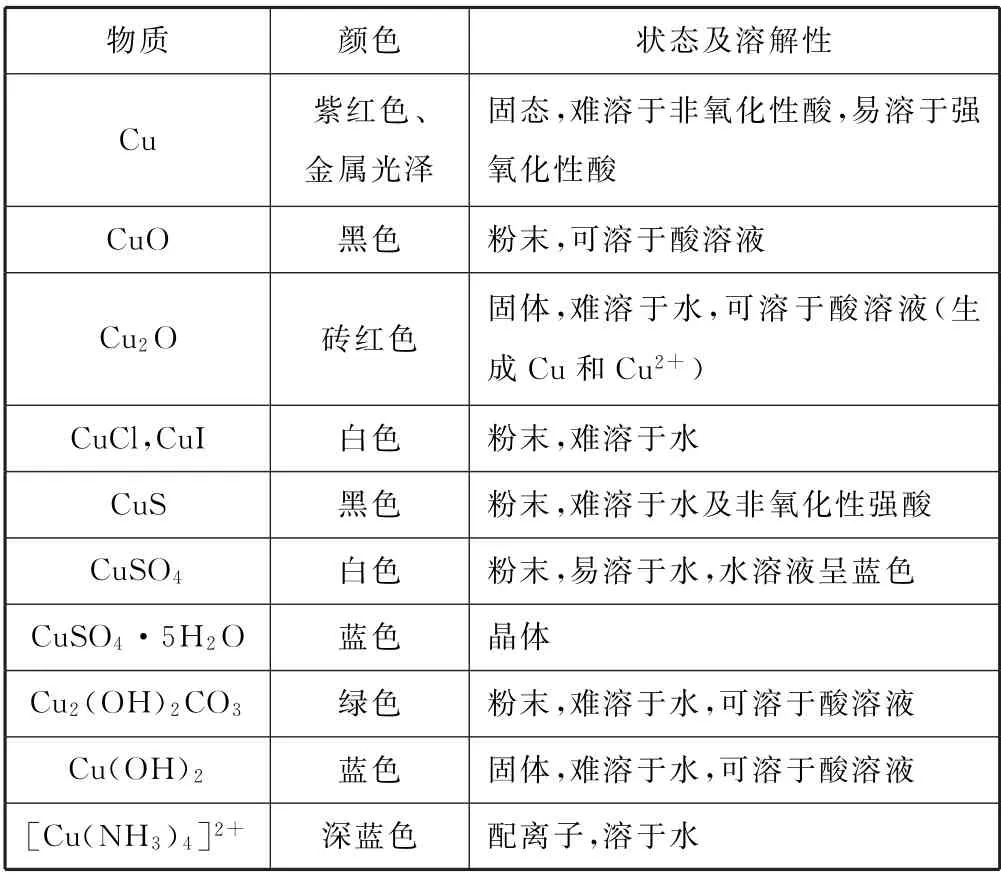
表3
1)氧化亚铜(Cu2O)
b)在空气中易被氧化:2Cu2O+O2=4CuO.
c)在酸性条件下易发生歧化反应:Cu2O +2H+=Cu2++Cu+H2O.
在H2还原CuO 实验中,所得红色固体可能是Cu与Cu2O 的混合物,如何检验含有Cu2O? 向红色物质中加入稀硫酸,若溶液由无色变成蓝色,则该红色物质中含有Cu2O,否则仅为Cu.
d)Cu2O 做还原剂,如下列反应:
Cu2O+6HNO3(浓)=3H2O+2Cu(NO3)2+2NO2↑;
3Cu2O+14HNO3(稀)=6Cu(NO3)2+7H2O+2NO↑.
2)Cu(OH)2
Cu(OH)2有弱氧化性,新制的Cu(OH)2悬浊液能氧化醛基化合物,本身被还原为Cu2O,常用于含醛基化合物的检验:CH3CHO +2Cu(OH)2CH3COOH+Cu2O↓+2H2O.分析化学上利用这个反应测定醛,医学上用这个反应检查糖尿病.
3)CuSO4
a)无水CuSO4(白色)可以遇水变为蓝色的胆矾,同理胆矾受热可失去结晶水变成白色粉末,过热时,CuSO4会进一步分解出CuO.
b)可溶性铜盐与H2S或S2-反应生成黑色的沉淀,常用于Cu2+的检验和H2S的去除.
4)铜的配合物
Cu2+易与NH3形成[Cu(NH3)4]2+配离子.
a)向硫酸铜溶液中滴加氨水,生成蓝色沉淀,方程式 为2CuSO4+2NH3·H2O =(NH4)2SO4+Cu2(OH)2SO4↓.
b)向沉淀后的悬浊液中继续添加氨水,沉淀溶解,得到深蓝色透明溶液,方程式为Cu2(OH)2SO4+
c)实验过程中加入C2H5OH 后可观察到析出深蓝色[Cu(NH3)4]SO4·H2O 晶体.实验中所加C2H5OH 的作用是:降低物质溶解度,加快其析出.
5)CuS
a)制备CuS的反应为CuSO4+H2S=CuS↓+H2SO4.本反应原理是:CuS溶解度极小,因此反应得以发生,同时要注意CuS不能溶解于非氧化性酸,只能用硝酸溶解.
b)与硝酸反应:CuS +10HNO3(浓)=Cu(NO3)2+H2SO4+8NO2↑+4H2O,
3CuS+8HNO3(稀)=3Cu(NO3)2+3S↓+2NO↑+4H2O.
3.4 谙熟铜命题中涉及的其他高频考点
1)冶炼铜的方法有热还原法,湿法炼铜,电解精炼铜.
2)常用灼热的铜粉除去N2中的O2,用灼热的CuO 除去CO2中的CO.
3)Cu和一定量的浓HNO3反应,产生的是NO2和NO 的混合气体,当Cu有剩余,再加入稀H2SO4,Cu继续溶解.
4)重金属离子可使蛋白质变性,因此,可溶性铜盐均有毒.另一方面,可溶性铜盐可作为消毒杀菌剂,做农药,如用于配制波尔多液等.
5)铜的锈蚀:铜在干燥的空气中比较稳定,在水中也几乎不反应,在含有二氧化碳的潮湿空气中铜可生成铜绿:2Cu+O2+CO2+H2O=Cu2(OH)2CO3,铜绿可防止金属进一步腐蚀.铜绿可以溶解于稀硫酸:Cu2(OH)2CO3+4H+=2Cu2++CO2↑+3H2O.
6)铜的原子序数是29,位于元素周期表中第四周期第ⅠB族,其价电子排布式为3d104s1,Cu2+的价电子排布式为3d9,Cu+的价电子排布式为3d10,根据洪特规则可知Cu+结构稳定,即稳定性:Cu2+<Cu+.
(完)

