高浓度CO2和光周期对浒苔幼苗生长和光合生理的影响
周 伟 ,武 卉,黄晶晶,赵希星,王静文,王津果
1. 江苏海洋大学/江苏省海洋生物资源与环境重点实验室/自然资源部滨海盐沼湿地生态与资源重点实验室,江苏 连云港222005
2. 江苏省海洋生物技术重点实验室,江苏 连云港 222005
3. 江苏省海洋生物产业技术协同创新中心,江苏 连云港 222005
自2007年首次暴发以来,浒苔 (Ulva prolifera)绿潮已持续成为中国黄海海域的重大生态自然灾害,其漂浮规模之大、持续时间之长、暴发频率之高、态势发展之恶劣、危害程度之深、治理费用之高,已引起各界的广泛关注[1]。研究其暴发机制及影响因素是防治绿潮暴发的必要前提。中国黄海绿潮藻优势种为浒苔,通常具有营养繁殖、无性生殖和有性生殖3种繁殖方式[2],生活史中的任何一形态均可以单独发育为成熟藻体。其中,四鞭毛孢子、两鞭毛孢子、两鞭毛雌配子、两鞭毛雄配子、合子、显微幼苗以及海水动力学下微观碎片等“微观繁殖体”,构成了庞大的绿潮藻“种子库”[3-5],其在适应能力、生长速率、光合生理、生命周期等方面与绿潮藻成熟藻体间存在潜在差异,是影响浒苔绿潮前期暴发的重要因素。
工业革命以来,随着化石燃料的大量使用,大气中的CO2浓度由280 μatm增加到目前的407 μatm[6],海洋吸收了人类排放CO2量的30%以上,使得表层海水碱性下降,引起海洋酸化[7]。按照这样的趋势,预计在21世纪中下叶,大气中CO2浓度将会达到800~1 000 μatm[8-9],海洋表层pH值下降0.3~0.4,依赖于海水化学环境的大型藻类将受到直接影响。光周期是调节藻类季节性变化的关键因素[10],日照长短会影响藻类对溶解性无机碳和细胞碳需求的亲和力,进而调节藻体的CO2浓缩机制 (CCMs),从而改变藻类生长速率[11-12]。研究表明,光照和CO2浓度是藻类生长和光合作用的重要影响因素[10-13],它们对藻类的影响具有种属差异性[14-20]。绿潮暴发前期阶段,CO2和光周期是浒苔微观繁殖体及其幼苗暴发性生长的重要影响因素,但目前关于CO2浓度和光周期对浒苔幼苗生长和光合生理的影响尚待更深入的研究。本研究选取CO2和光周期两个关键因素,探索其对作为“种子库”重要组成部分的浒苔幼苗生长及光合生理特性的影响,以期揭示浒苔绿潮早期暴发的原因,为未来浒苔绿潮的预警防控提供基础数据和理论支撑。
1 材料与方法
1.1 材料及培养条件
浒苔样品采自浙江宁波象山东部海湾潮间带(121°46'E, 29°33'N),采集后将藻体清洗阴至半干,置于低温保种箱带回实验室,用灭菌海水浸洗干净,挑选颜色鲜绿、生长健康的藻体用于实验。在 25 ℃、光照强度 130~160 μmol·(m2·s)-1、光周期12 L∶12 D、盐度30的条件下预培养。每天定时将藻体置于显微镜下观察生长状况,取长势良好的健康藻体,将其剪成2 cm左右的小段,置于加有Provasoli培养基的过滤灭菌海水中,每3 d更换培养液。待藻段变为黄褐色后,取出置于离心管中,24 h后加入灭菌海水,待藻段颜色变白,取出置于显微镜下观察并收集孢子/配子液。移取1 mL孢子/配子液置于培养皿中,加入20 mL过滤灭菌并添加培养基的海水,轻轻晃动使孢子/配子均匀分布于培养皿中,置于20 ℃、光照强度为100 μmol·(m2·s)-1、光周期为 12 L∶12 D 的培养箱中充气培养,每2 d添加1次培养基,14 d后长成2 cm左右的幼苗,用于后续实验。
1.2 实验设计
选择CO2浓度和光周期2个环境因子,CO2浓度设置2个梯度,分别是正常空气的CO2浓度400 μatm(Lower CO2, LC) 和加富后的 CO2浓度1 000 μatm(Higher CO2, HC),每个CO2浓度下设置10 L∶14 D(短光照, LL)、12 L∶12 D (正常光照,ML)、14 L∶10 D(长光照,HL) 3个不同光周期,即共6个CO2和光周期组合处理组,每个组合设3个平行样。将(0.20±0.01) g的幼苗置于装有过滤灭菌海水并添加Provasoli培养基的500 mL通气培养瓶中,在20 ℃、光照强度 100 μmol·(m2·s)-1的 GXZ-500C型智能光照培养箱中培养,每2 d更换1次培养液。
为了将不同光周期处理下的培养基pH保持在 8.2±0.05 (LC) 和 7.9±0.05 (HC),每 2 d 更换一次培养基。pH的测定采用pH计 (Mettler-Toledo, F2-Standard, Switzerland),总碱度根据Gao滴定法测定[15]。根据总碱度和pH使用CO2SYS软件计算海水中的其他海水碳酸盐系统参数[21]。
1.3 相对生长速率的测定
每2 d测定一次藻体质量,先用镊子取出藻体,用吸水纸轻轻吸干表面水分后,称量湿质量。为减少操作误差,每次称量均由同一个人操作,每次都保持吸水纸层数和吸水时间一致,尽量减少在空气中的干露,以防损伤藻体生理活性[6]。相对生长速率 (RGR, %·d-1)计算公式如下:
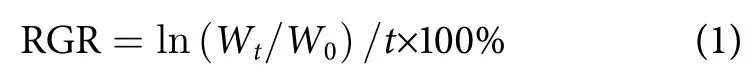
式中:Wt为第t天藻体的质量 (g);W0为藻体初始质量 (g);t为培养天数 (d)。
1.4 叶绿素荧光参数的测定
采用PAM叶绿素手持荧光仪 (AquaPen AP-P 100 Chech) 测定叶绿素荧光参数。测定前,样品在黑暗条件下处理15 min,于培养光强下测定荧光诱导曲线。在8种光化光强度 [0, 10, 20, 50, 100, 200,500, 1 000 μmol·(m2·s)-1] 下测定相对电子传递速率(rETR)、快速光响应曲线 (RLC),计算公式如下:

式中:Y(II) 为光系统II的有效光合量子产率;0.5为光系统II吸收的光量子占总量的比例;PAR为光化光强 [μmol·(m2·s)-1]。
快速光响应曲线根据Eilers等[22]进行拟合,计算公式如下:

式中:a、b、c为拟合参数。
根据拟合参数计算最大相对电子传递速率(rETRmax)、光能利用效率 (α) 及饱和光强 (Ek),计算公式如下:

1.5 净光合速率和呼吸速率的测定
采用液相氧电极 (YSI 5300A,美国) 进行净光合速率和呼吸速率的测定。实验前将藻体剪成1 cm长度的小段,并置于培养条件下适应1 h以上以减少机械损伤。称取约0.01 g藻体置于含8 mL培养基的反应槽中,由恒温循环器 (DHX-2005,中国) 控制温度在20 ℃。暗适应20 min,黑暗条件下反应槽内O2浓度的变化即为呼吸速率 (鲜质量,下同) [Rd, μmol·(g·h)-1],采用卤素灯提供外源光强,通过调整卤素灯和反应槽的距离获得培养光强下的净光合速率 [Pn, μmol·(g·h)-1]。
1.6 色素含量的测定
称取0.05 g藻体置于离心管中,加入5 mL无水乙醇,于4 ℃冰箱中放置12 h,离心,取上清液。分光光度计分别测定提取液在666、653 nm波长处的吸光值。根据以下公式计算叶绿素a(Chla)、叶绿素b(Chlb)、类胡萝卜素 (Cartenoids, Car) 的质量分数 (mg·g-1)[23]:

式中:wChla为叶绿素a的质量分数;wChlb为叶绿素b的质量分数;wCar为类胡萝卜素的质量分数;A666、A653、A470分别为666、653、470 nm波长处的吸光值。
1.7 数据分析
2 结果
2.1 海水碳酸盐系统参数
CO2和光周期均影响海水的碳酸盐系统参数,且存在交互作用。高浓度CO2降低了海水中的CO23-浓度,提高了CO2分压 (pCO2)、溶解性无机碳、HCO3-和CO2浓度。在LC条件下,光照时间延长对碳酸盐系统参数没有影响,在HC条件下,海水的pH、CO32-浓度均在ML处理下达到最高值,pCO2、CO2浓度则在ML处理下出现最低值 (表1)。

表1 不同CO2和光周期水平下海水的碳酸盐系统参数Table 1 Parameters of seawater carbonate system under different CO2 and photoperiod conditions
2.2 CO2和光周期对浒苔幼苗相对生长速率的影响
由图1可以看出,LC条件下,光照时间延长显著促进了浒苔幼苗的生长 (P<0.05),HL条件下相对生长速率高达 (11.50±0.13) %·d-1,比LL条件下的高约40.07%;HC条件下,幼苗的生长趋势与LC条件下相同,随着光照时间的延长幼苗的生长速率增加,HL条件下相对生长速率为LL条件下的近1.6倍。在不同的光周期条件下,HC均呈现出显著促进幼苗生长的现象 (P<0.05),LL条件下,HC处理下相对生长速率为 (9.21±0.27) %·d-1,比LC增加12.18%;ML培养时,LC条件下的相对生长速率为 (9.15±0.20) %·d-1,比HC降低14.41%;HL条件下,HC比LC培养藻体的相对生长速率提高27.91%。CO2、光周期对浒苔幼苗的生长产生了极显著的影响,且交互作用极显著 (P<0.01,表2)。

表2 CO2和光周期对浒苔幼苗相对生长速率的双因素方差分析Table 2 Two-way ANOVA analysis for effect of CO2 and photoperiod on relative growth rate of U. prolifera seedlings
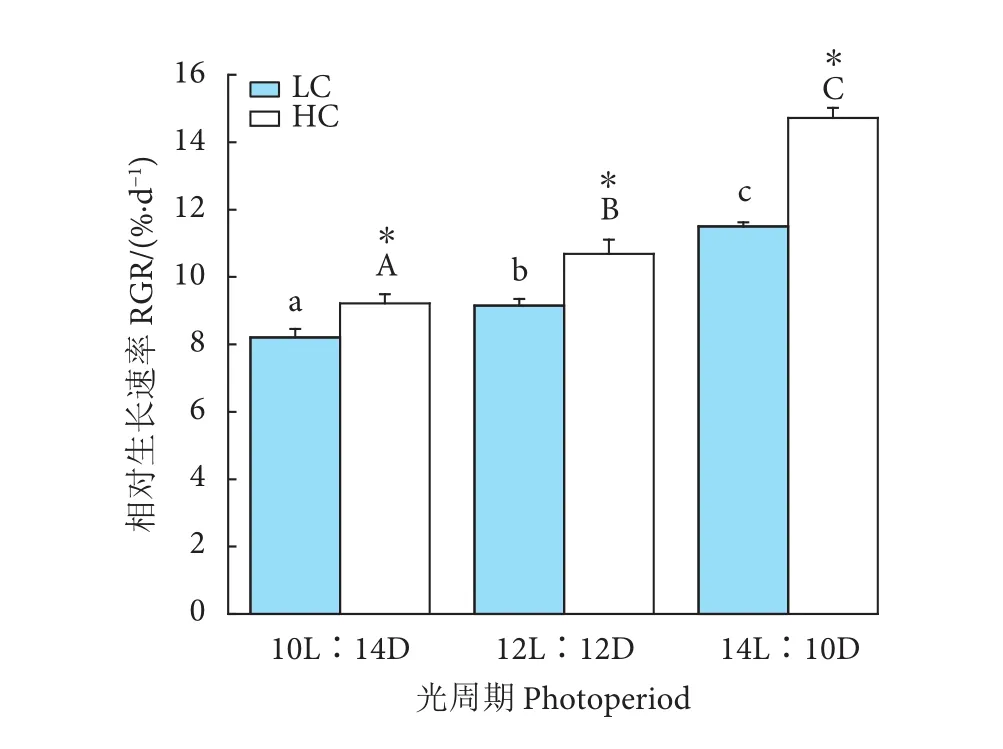
图1 不同CO2和光周期水平下浒苔幼苗相对生长速率变化注:不同小写字母表示在LC条件下不同处理间差异显著(P<0.05),不同大写字母表示在HC条件下不同处理间差异显著(P<0.05);*表示同一光周期下不同CO2水平间差异显著(P<0.05);后图同此。Fig. 1 Relative growth rate of U. prolifera seedlings under different CO2 and photoperiod conditionsNote: Different lowercase letters represent significant difference among different treatments under lower CO2 condition (P<0.05), and different uppercase letters represent significant difference among different treatments under high CO2 condition (P<0.05). Asterisk represent significant difference between low and high CO2 conditions within a photoperiod treatment (P<0.05). The same case in the following figures.
2.3 CO2和光周期对浒苔幼苗光化学参数的影响
在HC处理下,浒苔幼苗的有效光合量子产率随着光照时间的增加而显著升高 (P<0.05,图2),HL培养下,有效光合量子产率达到最大值 (0.68±0.04)。在LC培养下,有效光合量子产率随光照时间的变化呈现增加的趋势,HL条件下,有效光合量子产率为0.51±0.01,和ML条件下的有效光合量子产率 (0.40±0.01) 没有显著性差异 (P>0.05)。在不同光照时间培养下,HC显著提高了培养藻体的有效光合量子产率 (P<0.05)。CO2、光周期极显著影响浒苔幼苗的有效光合量子产率,且有极显著的交互作用 (P<0.01,表 3)。

表3 CO2和光周期对浒苔幼苗有效光合量子产率的双因素方差分析Table 3 Two-way ANOVA analysis for effect of CO2 and photoperiod on yield of U. prolifera seedlings
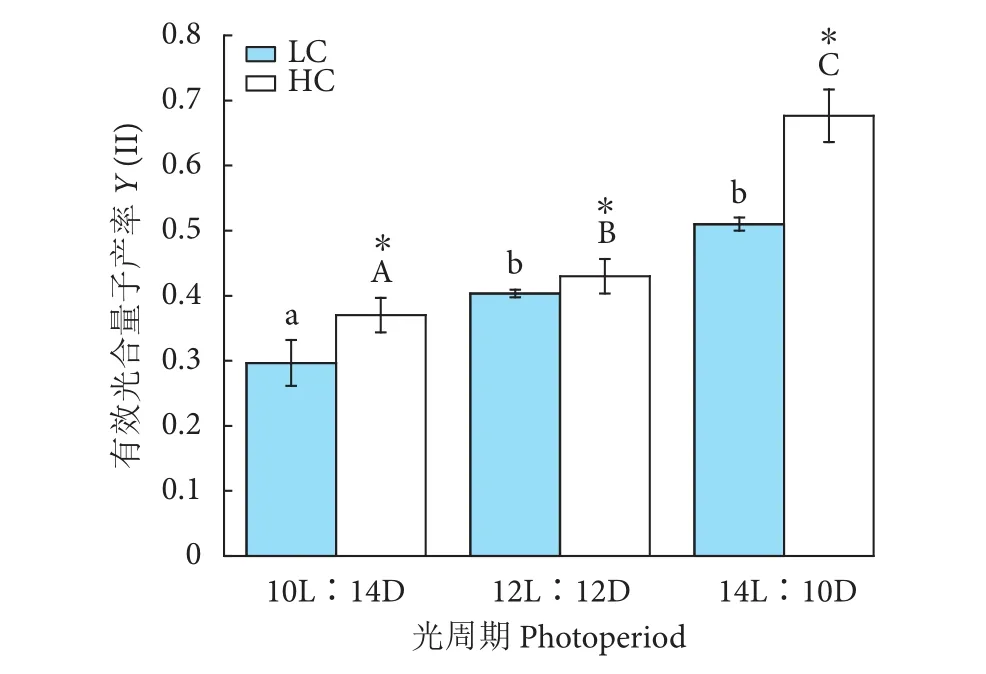
图2 不同CO2和光周期水平下浒苔幼苗有效光合量子产率变化Fig. 2 Variation in yield of U. prolifera seedlings under different CO2 and photoperiod conditions
浒苔幼苗的相对电子传递速率随着光强的增加逐渐上升而后趋于平稳,且在HL条件下较高(图3)。根据图3计算出的最大相对电子传递速率、光能利用效率、饱和光强见表4,饱和光强在不同处理间差异不显著 (P>0.05),但HL对幼苗的最大相对电子传递速率和光能利用效率均有显著的促进作用 (P<0.05)。
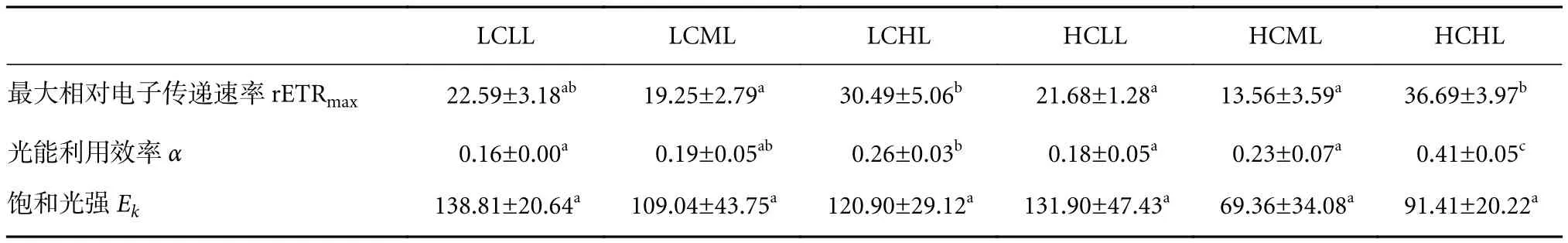
表4 不同CO2和光周期条件下浒苔幼苗的相对电子传递速率 (rETR) 与光强关系的最佳拟合参数Table 4 Best fitted parameters of relationship between rETR and light intensity of U. prolifera seedlings under different CO2 and photoperiod conditions

图3 不同CO2和光周期条件下浒苔幼苗的相对电子传递速率 (rETR)Fig. 3 rETR values of U. prolifera seedlings under different CO2 and photoperiod conditions
通过对不同处理下浒苔幼苗快速光响应曲线最佳拟合参数最大相对电子传递速率、光能利用效率、饱和光强的双因素方差分析可知,光周期的变化会对幼苗的最大相对电子传递速率、光能利用效率产生极显著影响 (P<0.01);不同CO2浓度会对幼苗的最大相对电子传递速率产生极显著影响(P<0.01),且显著影响幼苗的光能利用效率 (P<0.05);光周期和CO2对幼苗的光能利用效率有显著交互作用 (P<0.05),而对最大相对电子传递速率、饱和光强无显著交互作用 (P>0.05,表5)。

表5 CO2和光周期对浒苔幼苗快速光响应曲线最佳拟合参数的双因素方差分析Table 5 Two-way ANOVA analysis for effect of CO2 and photoperiod on best fitted parameters derived from light response curve of U. prolifera seedlings
2.4 CO2和光周期对浒苔幼苗净光合速率和呼吸速率的影响
CO2和光周期对浒苔幼苗的净光合速率和呼吸速率均有极显著影响 (P<0.01),对净光合速率无显著交互作用 (P>0.05),对呼吸速率则有显著交互作用 (P<0.05,表6)。净光合速率随着光照时间的延长逐渐增加 (图4)。在LC条件下,LL和ML光照组的净光合速率无显著性差异 (P>0.05),分别为(189.14±7.24) 和 (201.14±3.57) μmol·(g·h)-1,明显低于HL培养藻体的净光合速率 [(223.77±1.46)μmol·(g·h)-1]。HC 条件下,HL 光照组净光合速率高达 (257.92±7.46) μmol·(g·h)-1,比 LL、ML 时的分别增加26.13%、10.95% (P<0.05)。HC 培养藻体的净光合速率均高于LC培养藻体的,并在ML、HL光照培养时表现出显著性差异 (P<0.05)。
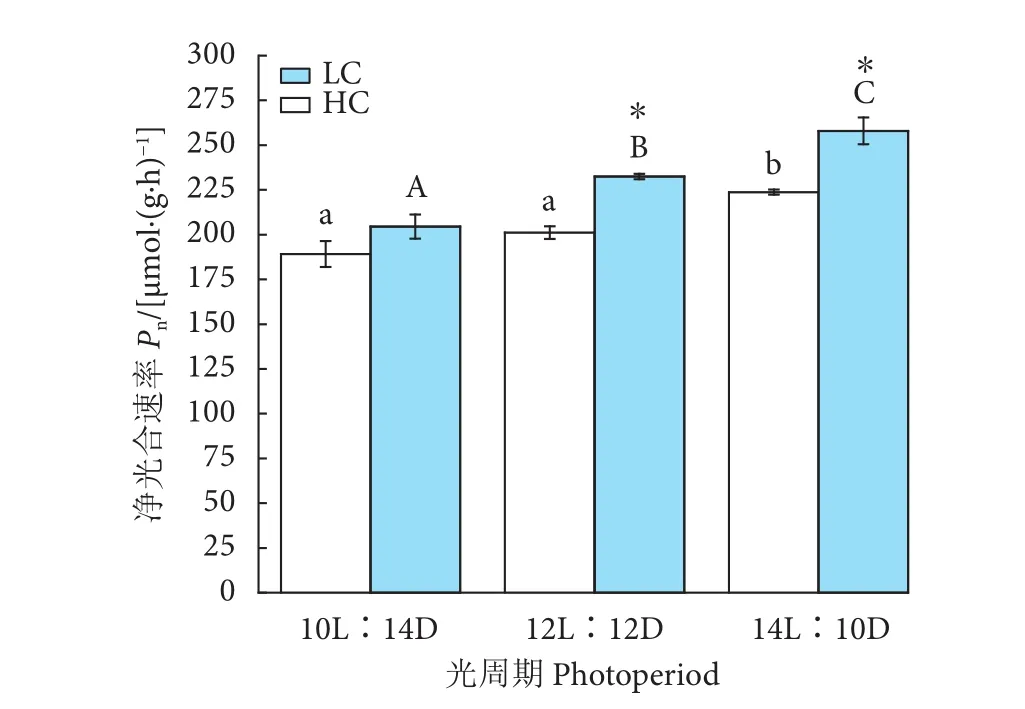
图4 不同CO2和光周期水平下浒苔幼苗净光合速率变化Fig. 4 Net photosynthetic rate of U. prolifera seedlings under different CO2 and photoperiod conditions
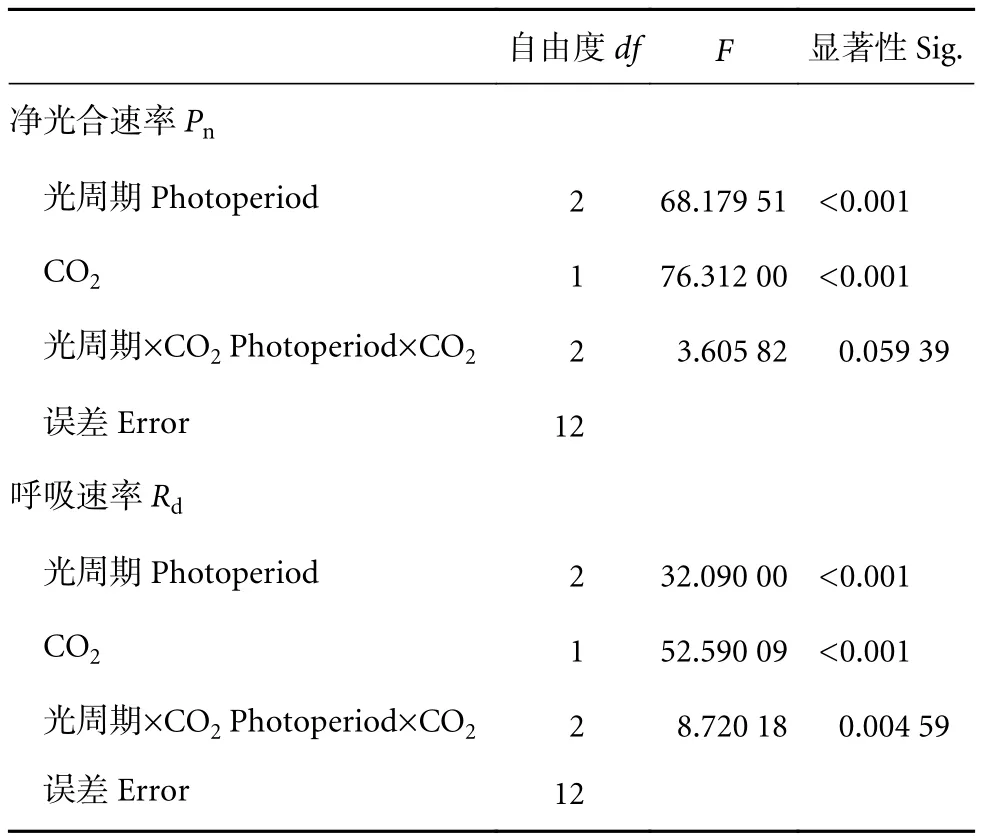
表6 CO2和光周期对浒苔幼苗净光合速率和呼吸速率的双因素方差分析Table 6 Two-way ANOVA analysis for effect of CO2 and photoperiod on net photosynthetic rate and dark respiration rate of U. prolifera seedlings
浒苔幼苗的呼吸速率随光照时间延长及CO2浓度的升高而增加 (图5)。LC培养下,藻体的呼吸速率在不同光周期处理间无显著性差异(P>0.05),最高值出现在HL培养条件下 [(46.19±0.42) μmol·(g·h)-1]。HC 条件下,呼吸速率呈现出相同的变化趋势,在HL处理下达到最大值 [(63.68±1.75) μmol·(g·h)-1],显著高于 ML 的 (47.37±2.93)μmol·(g·h)-1、LL 的 (45.89±1.70) μmol·(g·h)-1(P<0.05)。呼吸速率随着CO2浓度的升高而增加,分别在LL和HL培养时表现出显著性差异 (P<0.05)。
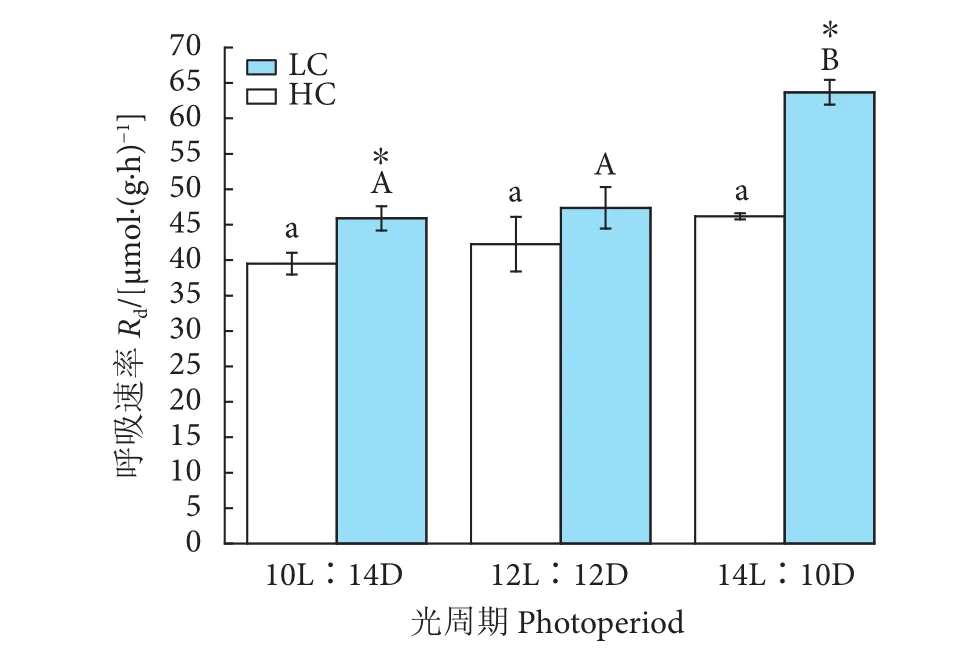
图5 不同CO2和光周期水平下浒苔幼苗呼吸速率变化Fig. 5 Dark respiration rate of U. prolifera seedlings under different CO2 and photoperiod conditions
2.5 CO2和光周期对浒苔幼苗光合色素的影响
浒苔幼苗的Chla质量分数随着光照时间的延长呈现下降趋势 (P<0.05,图6)。LC、HC处理下,Chla质量分数在ML培养时分别为 (0.62±0.09)、(0.33±0.02) mg·g-1,比LL培养的分别增加9%、降低42%,HL培养藻体的Chla质量分数低于LL,分别为 (0.42±0.06) 和 (0.29±0.04) mg·g-1。HC降低了Chla质量分数,且在ML、HL培养条件下差异显著 (P<0.05)。
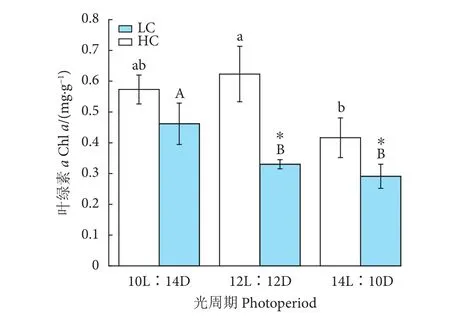
图6 不同CO2和光周期水平下浒苔幼苗叶绿素a质量分数变化Fig. 6 Chl a mass fractions of U. prolifera seedlings under different CO2 and photoperiod conditions
如图7所示,随着光照时间的增加,浒苔幼苗Chlb质量分数总体上呈逐渐降低的变化趋势(P<0.05)。在LC培养条件下,Chlb质量分数最高值出现在 ML 处理组 [(1.16±0.17) mg·g-1],是HL处理组的1.5倍;在HC培养条件下,Chlb质量分数最高值出现在LL处理组 [(0.85±0.13)mg·g-1],是HL处理组的1.6倍。Chlb质量分数在高浓度CO2及长光照处理下显著下降 (P<0.05)。

图7 不同CO2和光周期水平下浒苔幼苗叶绿素b质量分数变化Fig. 7 Chl b mass fractions of U. prolifera seedlings under different CO2 and photoperiod conditions
在LC、HC培养条件下,浒苔幼苗Car质量分数随着光照时间的增加表现出整体下降的变化趋势 (图8),这种下降趋势在LC处理下并不显著 (P>0.05),Car质量分数高低顺序为 LL [(0.21±0.02) mg·g-1]≈ML [(0.21±0.04) mg·g-1]>HL [(0.16±0.03) mg·g-1]。HC处理下的Car质量分数均低于LC处理下的,且在ML培养时表现出显著性差异 (P<0.05)。
在整个实验过程中,浒苔幼苗的光合色素Chla、Chlb和Car含量随着光照时间的延长均呈现逐渐下降的趋势 (图6—图8),这种趋势在HC培养条件下更为明显,且HC降低了光合色素Chla、Chlb和Car含量。光周期和CO2的变化均会对幼苗的光合色素产生极显著影响 (P<0.01);光周期和CO2对幼苗的Chla、Chlb含量均有显著交互作用 (P<0.05),而对Car无显著交互作用(P>0.05,表 7)。

表7 CO2和光周期对浒苔幼苗光合色素 (Chl a, Chl b, Car)的双因素方差分析Table 7 Two-way ANOVA analysis for effect of CO2 and photoperiod on Chl a, Chl b and Car of U. prolifera seedlings
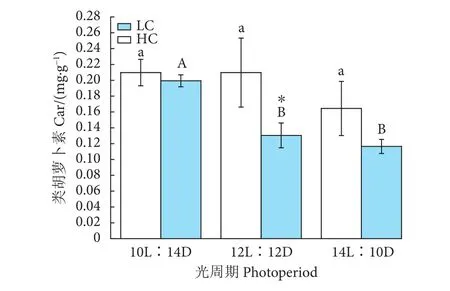
图8 不同CO2和光周期水平下浒苔幼苗类胡萝卜素质量分数变化Fig. 8 Car contents of U. prolifera seedlings under different CO2 and photoperiod conditions
3 讨论
本研究结果显示,随着光照时间的延长,浒苔幼苗的相对生长速率呈增加趋势,这与缘管浒苔(U. linza) 成熟藻体、脐形紫菜 (Porphyra umbilicalis) 的研究结果一致[14,18,20]。已有研究表明,延长光照时间可能会影响无机碳的捕获和固定能力,从而促进藻体生长[24]。本研究中光照时间延长提高了浒苔幼苗的有效光合量子产率,也与之前的研究相一致。另外,在短光照 (8L∶16D ) 培养条件下弯枝藻 (Compsopogon coeruleus) 的相对生长速率最高[19],脐形紫菜在正常光照 (12L∶12D) 和长光照(16L∶8D) 处理下相对生长速率最高[20],20L∶4D比16L∶8D培养的小球藻 (Chlorella vulgaris) 相对生长速率低[25]。由此可见,光周期对藻类的影响具有种属特异性。
在不同的光照时间培养下,高浓度CO2提高了净光合速率,促进了浒苔幼苗的生长。浒苔属物种具有高效的CO2浓缩机制,但是高浓度CO2培养依然会促进其生长[26-29]。这可能是因为CO2浓度升高一方面会提高培养水体中无机碳浓度,促进光合固碳作用,另外一方面会导致藻体无机碳浓缩机制下调,节省的能量则用于藻体生长[28,30-32]。高浓度CO2显著降低了浒苔幼苗的Chla、Chlb和Car的含量,也证实了上述观点。CO2浓度升高导致藻类无机碳浓缩机制下调,色素合成减少,“光合色素经济性”节省的能量则用于其他代谢和生物合成途径,进而促进藻体的生长[32]。例如,高浓度CO2提高了可溶性碳水化合物、可溶性蛋白质含量和硝酸还原酶等活性[6,18]。然而,高浓度CO2在促进浒苔幼苗净光合速率的同时,协同引起呼吸速率的增加,可能是因为海水酸性的增加作为一种环境胁迫,会在一定程度上抑制藻体对光胁迫的耐受能力,增加光抑制,导致呼吸作用增强[28],而对生长的影响取决于CO2浓度升高与酸化“双刃剑”效应的平衡[33]。CO2浓度升高促进呼吸速率的现象在温州羊栖菜 (Hizikia fusiforme)[34]、三角褐指藻 (Phaeodactylum tricornutum)[35]和海洋球石藻 (Emiliania huxleyi)[36]中也有发现。
CO2浓度和光周期对色素含量和光化学参数均具有显著影响,且存在明显的协同作用。在高浓度CO2和长光照 (14L∶10D) 条件下,藻体色素含量下降,色素对能量的利用效率却明显提高。本研究中藻体生长速率加快,可能是光系统II的电子传递速率和光能利用效率随着CO2浓度升高和光照时间延长而明显升高,CO2和光周期的耦合作用提高了色素对能量的利用效率,从而有利于光系统II有效光合量子产率的增加。随着光照时间的延长,藻体最大相对电子传递速率和光能利用效率均呈现逐渐增加趋势,说明浒苔幼苗的生长和光合作用在响应CO2浓度和光周期变化过程中存在紧密联系。但Yue等[14]的研究发现CO2对缘管浒苔成体藻生长的影响取决于光周期的变化,在短光照8L∶16D条件下CO2促进其生长,在正常光照12L∶12D条件下CO2对其生长无影响,在长光照16L∶8D处理下CO2抑制其生长,这与本研究的结果不一致,可能是由浒苔和缘管浒苔的不同生理特性所致。
本研究首次尝试阐明CO2和光周期之间的相互作用对浒苔幼苗的生长和光合生理的影响。结果显示,随着CO2浓度的增加,浒苔幼苗的生长加快,并且这种增加随着日照时间的延长而增强。历年绿潮藻浒苔暴发期均集中在5—8月,此时温度升高,日照时间延长,为浒苔暴发创造了必要条件。同时伴随着未来海洋酸化进程,暴发浒苔绿潮的可能性增加。本研究结果为深入了解绿潮藻暴发的原因提供了基础数据,其他环境因素如温度、营养盐等对浒苔幼苗的影响还需要进一步研究,以便更深入地了解未来海洋绿潮发生的前期条件。

