饲料中添加菊粉对卵形鲳鲹幼鱼存活、生长和肠道菌群的影响
兰鲲鹏 ,吴光德 ,王 珺, ,陈 旭,王 芸,周传朋,林黑着,马振华,
1. 上海海洋大学 水产与生命学院,上海 201306
2. 中国水产科学研究院南海水产研究所/农业农村部水产品加工重点实验室,广东 广州 510300
3. 南方海洋科学与工程广东省实验室 (湛江),广东 湛江 524025
4. 中国水产科学研究院南海水产研究所热带水产研究开发中心,海南 三亚 572018
鱼类养殖在我国渔业中占有重要地位,其产量约占水产养殖总量的52%[1]。在现代集约化养殖条件下,通常养殖密度很高,导致养殖鱼类受到的应激胁迫显著增加,经常引发包括肠炎在内的各种消化道疾病,严重降低其成活率和生长速度[2]。鱼类肠道内微生物数量高达 107~108CFU·g—1,并且有着复杂且动态变化的群落结构,在营养物质的消化吸收、抵抗病原微生物与提高免疫力、保持鱼类健康与促进生长、存活等方面起着重要作用[3-4]。使用抗生素是调节消化道微生物最普遍和有效的方法,但却存在药物残留和产生耐药菌等问题。益生元(Prebiotic) 一般指低聚糖 (Oligosaccharides) 或多糖(Polysaccharides) 类物质,具有不被宿主消化酶所消化,但可作为微生物发酵的底物,选择性的促进肠道中某些微生物生长或提高其活性,并改善宿主健康的作用[5-6]。益生元是从植物中提取的天然产物,不存在抗生素残留和耐药性等问题,具有健康和环境友好等优点。随着越来越多的抗生素逐渐被禁用,研究和应用益生元替代抗生素调节肠道微生物成为营养与饲料学研究的热点[7-12]。
菊粉 (Inulin) 又称菊糖,是一种由D-果糖经由β(1→2)糖苷键连接而成的链状多糖,末端含一个葡萄糖基,平均分子量约为5 500,首次在莴苣(Lactuca sativa) 根部发现,广泛存在于菊芋 (Helianthus tuberosus)、洋葱 (Allium cepa) 和香蕉 (Musa paradisiaca) 等多种植物中[13]。菊粉是目前应用最为广泛的益生元,它可以被肠道中的微生物发酵产生短链脂肪酸等物质,有利于肠道中双歧杆菌等益生菌的增殖,并抑制致病菌的生长,有助于维持鱼类肠道微生物的稳定和改善肠道健康[14-15]。菊粉是在水产养殖领域应用最早的益生元之一,早在1997年,Wang等[16]将菊粉与几种多糖注射到草鱼 (Ctenopharyngodon idellus) 和罗非鱼 (Tilapia aureus) 腹腔内进行攻毒实验,观察菊粉等多糖对鱼体免疫力和成活率的影响。研究显示,在饲料中添加菊粉可以提高大菱鲆 (Psetta maxima)[17]、尖吻鲈 (Lates calcarifer)[18]、鲤 (Cyprinus carpio)[19]、草鱼[20]和罗非鱼 (Oreochromis niloticus)[21]等的生长性能和免疫指标。但也有研究发现添加不当会导致鱼类肠道上皮细胞损伤、生长下降等负面影响[22]。
卵形鲳鲹 (Trachinotus ovatus) 又名金鲳,在中国、日本、澳大利亚等国家广泛分布,具有肉质鲜美、生长快、饲料利用率高、抗逆性强等优点,其商业价值较高,是我国南方沿海主要养殖品种之一,2020年养殖产量超过10万吨[1]。该品种适合于深水网箱养殖,具有广阔的前景和潜力。在生产中高密度养殖使卵形鲳鲹受到的生理应激胁迫增加,导致病害发生和成活率降低等问题,严重限制了其产业的健康发展。本研究在卵形鲳鲹幼鱼饲料中添加了不同水平的菊粉,测定了其对实验鱼成活率、生长性能、形态指标以及肠道微生物的影响,评估确定其在饲料中的最适添加量,并为菊粉在其他鱼类饲料中的应用提供参考。
1 材料与方法
1.1 实验设计与饲料配制
以鱼粉和豆粕作为蛋白源,以鱼油和卵磷脂作为脂肪源,以高筋面粉作为碳水化合物源配制基础饲料。在基础饲料中分别添加0 (对照组)、0.3%、0.6%、0.9%、1.2%和1.5%的菊粉,制成6种实验饲料。实验所使用菊粉由比利时Beneo orafti公司提供,纯度为99%。实验饲料配方及营养组成见表1。配制饲料前所有原料经过粉碎过60目筛,将所有粉碎好的饲料原料按饲料配方称量后混合均匀,然后再加入鱼油和大豆卵磷脂 (先溶解于鱼油中),手工将油脂微小颗粒搓散,于腰鼓式立式混合机 (牧羊SYTH0.1) 中混合均匀,最后再加入约30%蒸馏水形成硬团,于双螺杆压条机 [F-26(Ⅱ),华南理工大学监制] 中将饲料挤压成直径2.5 mm的条状,在空调房吹干,于-20 ℃保存备用。

表1 6 种实验饲料配方及营养成分 (干质量)Table 1 Formulation and proximate composition of six experimental diets (Dry mass)
1.2 实验鱼与饲养管理
养殖实验在中国水产科学研究院南海水产研究所热带水产研究开发中心实验基地进行。实验用卵形鲳鲹幼鱼为当地育苗厂当年人工培育的同一批苗种。实验前,先将幼鱼用商业饲料暂养2周以适应养殖环境。实验鱼在小型网箱 (长100 cm×宽100 cm×高120 cm) 中养殖。实验开始前饥饿24 h。用丁香酚 (成都艾科达化学试剂有限公司) 麻醉后,挑选大小均匀的健康幼鱼[初始体质量为 (18.85±0.02) g] 随机分配于18个养殖网箱,每个网箱30尾。网箱随机分配一种实验饲料 (每饲料处理组3个重复)。每天早、晚饱食投喂2次 (7:00、17:00),实验为期8周。每3周清洗一次网箱上的附着生物。养殖过程中海水水温保待在29~32 ℃,pH 7.1~7.4,溶解氧质量浓度>5.0 mg·L-1,氨氮(NH3-N) 质量浓度<0.05 mg·L-1,海水盐度为28.0~31.2。
1.3 样品采集与化学分析
养殖实验结束时,停止喂食24 h,分别称量每个网箱鱼体总体质量,记录尾数,计算每个网箱卵形鲳鲹的平均体质量。从每个网箱随机取6尾鱼测量体质量与体长,测量完成后解剖其中3尾,采集内脏、肝脏、肠道和肠系膜脂肪样品并称质量,用于微生物高通量测序分析的肠道样品在液氮中速冻后于-80 ℃保存;其余3尾于-20 ℃保存用于体常规分析。
鱼体和饲料常规成分分析均采用AOAC (2000)的方法。其中,水分的测定为105 ℃烘干恒重法(24 h);粗蛋白的测定为凯氏定氮法,采用瑞典Hoganas公司的Foss 2300型自动定氮仪;粗脂肪的测定为索氏抽提法(以石油醚为抽提剂),采用瑞士Foss TecatorAB公司的Soxtec AVanti 2050型自动分析仪;灰分的测定为箱式电阻炉550 ℃灼烧法,采用日本Yamato Scientific公司的FO610C型马弗炉灼烧8 h。
卵形鲳鲹的中肠用4%多聚甲醛溶液固定,用不同浓度梯度的乙醇进行脱水处理后做石蜡包埋,然后用苏木精-伊红(HE)进行染色,用Image J图形软件测量绒毛高度,统计杯状细胞数目。
1.4 肠道菌群分析
采用CTABLE/SDS法提取卵形鲳鲹肠道微生物DNA,用1%琼脂糖凝胶电泳检测DNA的纯度和浓度,取适量的样品于离心管中,无菌水稀释至1 ng·μL-1。以稀释后的基因组DNA为模板,用16S rRNA V4—V5区[515F (5'-GTGCCAGCMGC CGCGG-3')和907R (5'-CCGTCAATTCMTT TRAGTTT-3')]特异性引物进行PCR扩增。扩增体系为20 μL,模板添加量为20 ng,扩增程序为:98 ℃预变性2 min,30个循环 (98 ℃变性10 s,55 ℃ 复性 10 s,72 ℃ 延伸30 s),72 ℃ 延伸 10 min。将纯化后质量合格的PCR产物进行文库构建(所用试剂盒为 TruSeq®DNA PCR-Free Sample Preparation Kit) 和Qubit和Q-PCR定量检测,采用PE250测序策略在Illumina Novaseq平台上进行高通量测序。
序列经过拼接和过滤得到有效数据后用Uparse软件 (http://drive5.com/uparse/) 进行聚类分析,默认将一致性97%以上的序列聚类为OTUs(Operational Taxonomic Units),筛选出现频率最高OTUs的序列用BLAST方法与Silva132数据库进行序列比对,获得门和属水平上的物种注释信息,样本间物种多样性通过R软件构建韦恩图,比较各实验处理样品间的Beta-多样性差异,根据距离矩阵绘制样品层次聚类树图。采用线性判别分析 (LDA Effect Size) 方法比较各处理组间微生物丰度上的差异。
1.5 数据计算与统计分析
实验鱼的成活率 (%)、增重率 (%)、特定生长率 (Specific growth rate, SGR, %·d—1)、饲料系数(Feed conversion ratio, FCR)、肥满度 (Condition factor, CF)、脏体比 (Viscerosomatic index, VSI)、肝体比 (Hepatosomatic index, HSI) 及脂体比 (Intraperitoneal fat, IPF) 等指标计算公式如下:
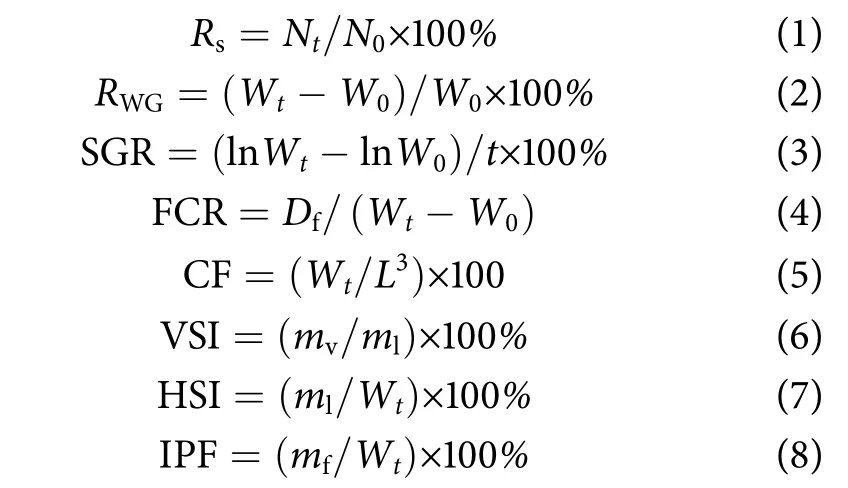
式中:Rs为成活率;N0和Nt分别为实验开始和结束时网箱中鱼的尾数;RWG为增重率,W0和Wt分别为实验开始和结束时的鱼体质量(g);t为实验天数;Df为摄食干质量 (g);L为鱼体长(cm);mv和ml分别为内脏和肝脏的湿质量 (g);mf为肠系膜上脂肪的湿质量 (g)。
数据采用单因素方差分析 (ANOVA),当处理之间差异显著时 (P<0.05),用Tukey's 检验进行多重比较分析,所有数据在进行方差分析前先进行方差齐性检验。统计分析采用SPSS 22.0软件进行,结果均以“平均数±标准差 ()”表示。
2 结果
2.1 饲料中添加菊粉对卵形鲳鲹生长性能和形态学指标的影响
饲料中菊粉添加水平对卵形鲳鲹的成活率、生长性能和形态学指标均产生了显著影响 (表2)。结果显示,菊粉添加量为1.5%处理组的成活率最高,显著高于其他各组 (P<0.05),而其他处理组之间差异不显著 (P>0.05);菊粉添加量为1.5%处理组的特定生长率最高,显著高于0.6%处理组(P<0.05),而其他处理组之间无显著差异 (P>0.05);在饲料中添加不同水平的菊粉未对卵形鲳鲹的饲料系数、肥满度和脏体比造成显著影响 (P>0.05)。饲料中添加菊粉显著降低了卵形鲳鲹的肝体比指数,肝体比随着菊粉添加量的增加先降低后升高,0.9%处理组出现最小值,而后随着添加量的增加而升高,0.3%~1.2%各处理组的肝体比显著低于对照组和1.5%处理组 (P<0.05)。添加菊粉可以显著降低卵形鲳鲹的脂体比,1.2%和1.5%处理组的脂体比显著低于其他处理组 (P<0.05)。
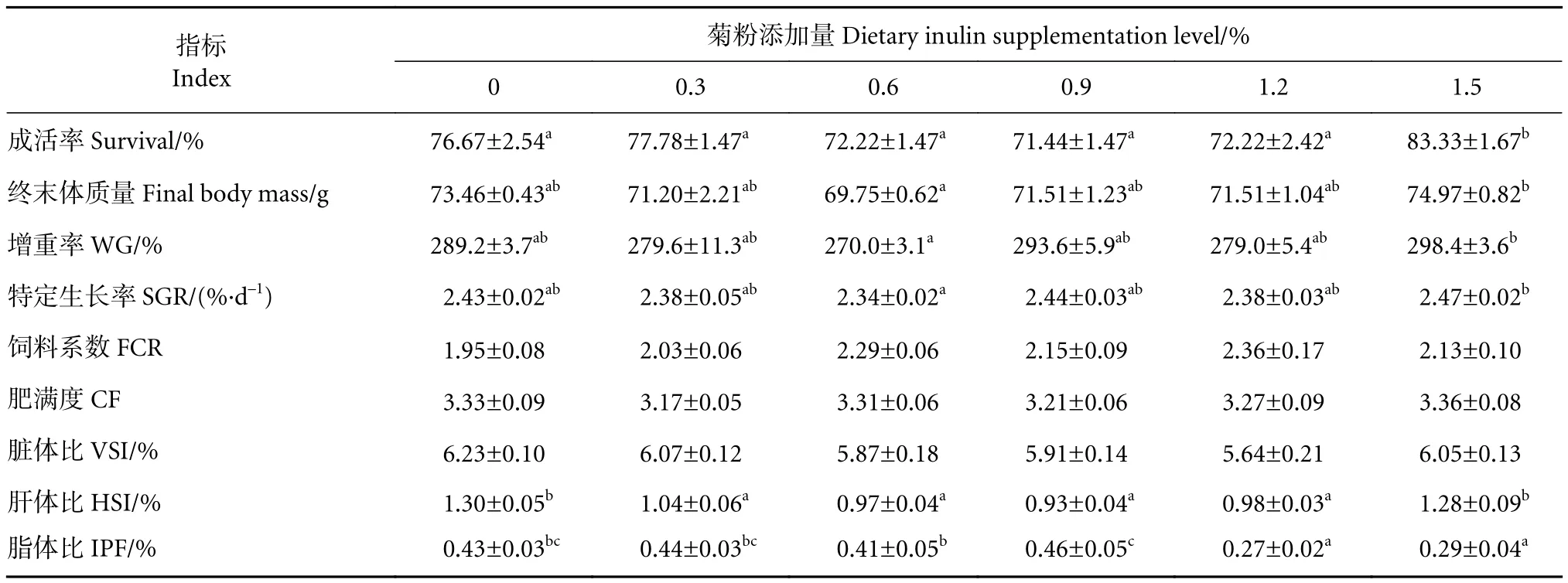
表2 饲料中添加菊粉对卵形鲳鲹生长和形态学指标的影响Table 2 Effects of dietary supplemental inulin on growth and morphological indexes of juvenile T. ovatus
2.2 饲料中添加菊粉对卵形鲳鲹肠道组织结构的影响
菊粉添加组的肠绒毛高度大于对照组,0.6%处理组与对照组之间差异显著 (P<0.05),说明在饲料中添加菊粉促进了卵形鲳鲹肠绒毛的生长 (图1-a)。柱状上皮细胞之间的杯状细胞数量在0.9%处理组最低,其余各组之间均无显著差异 (图1-b)。
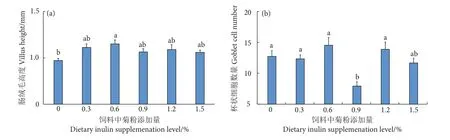
图1 摄食不同菊粉水平饲料的卵形鲳鲹肠绒毛高度和杯状细胞数量注:方柱上不同字母表示差异显著 (P<0.05).Fig. 1 Intestinal villus height and goblet cell number of T. ovatus fed with diets containing inulin at various concentrationsNote: Different letters on the bar indicate significant difference (P<0.05).
2.3 饲料中添加菊粉对卵形鲳鲹肠道菌群的影响
不同水平菊粉饲料对卵形鲳鲹肠道菌群的群落结构产生了显著影响。各处理组肠道菌群的优势种均属变形菌门 (Proteobacteria)、厚壁菌门 (Firmicutes) 和拟杆菌门 (Bacteroidetes),但优势种丰度存在差异,变形菌门丰度最高值[(70.2±6.1)%]和最低值[(45.5±8.8)%]分别出现在1.5%和0.6%处理组;拟杆菌门和厚壁菌门丰度在0.6%处理组最高;1.5%处理组的厚壁菌门丰度最低 [(8.4±0.4)%],对照组的拟杆菌门丰度最低[(6.4±1.7)%] (图2)。
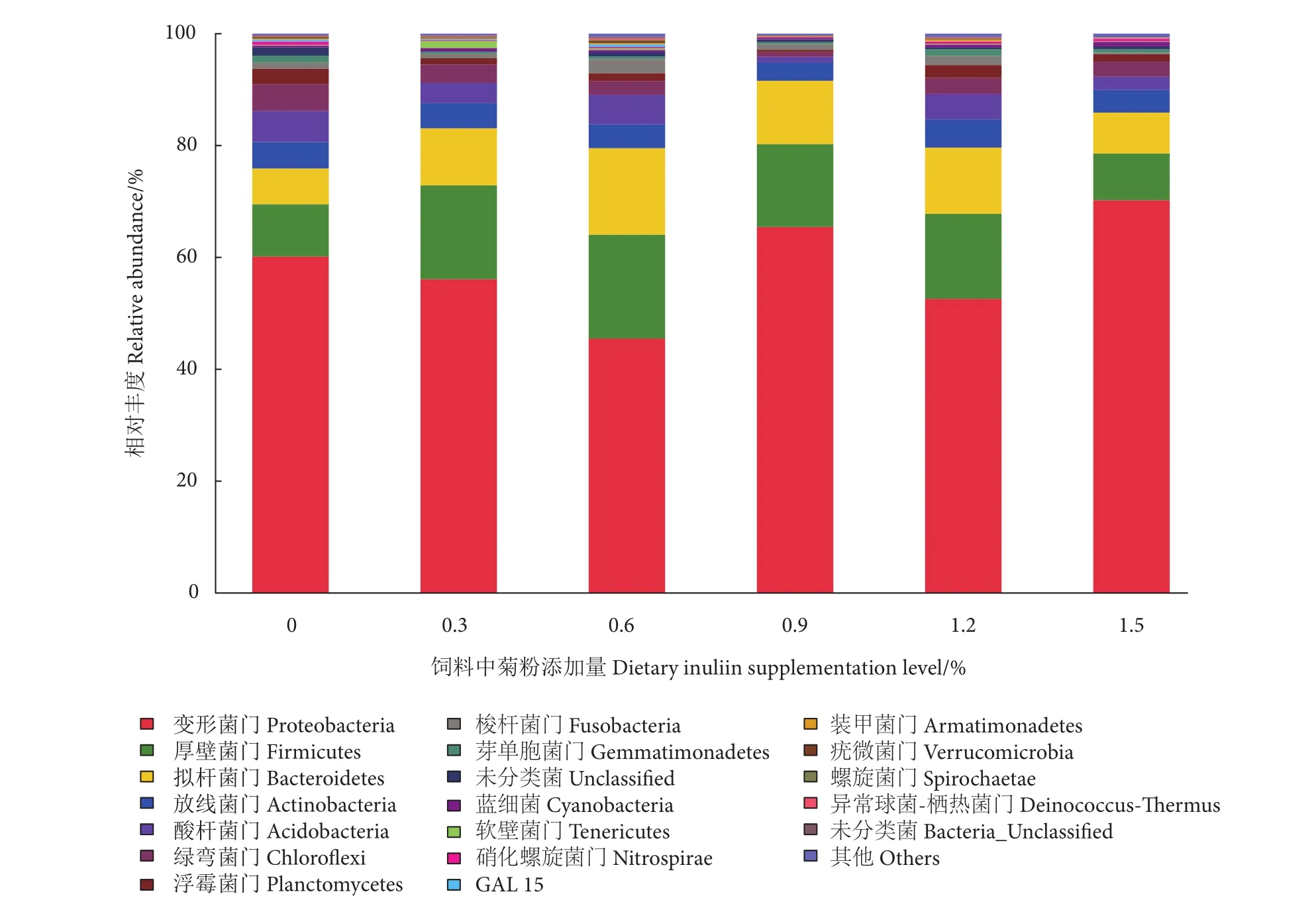
图2 摄食不同菊粉水平饲料的卵形鲳鲹肠道菌群门水平的相对丰度Fig. 2 Relative abundance of predominant phylum of gastrointestinal microbiota of T. ovatus fed with diets containing inulin at various concentrations
在属水平上,无色杆菌属 (Achromobacter)、短波单胞菌属 (Brevundimonas)和潘多拉菌属(Pandoraea)是各处理组肠道菌群的优势种。无色杆菌属种群丰度最高值[(17.8±6.7)%]出现在1.5%处理组,而0.6%处理组的无色杆菌属、短波单胞菌属、潘多拉菌属、代尔夫特菌属 (Delftia)、鞘氨醇单胞菌属 (Sphingomonas)种群丰度均最低 (图3)。
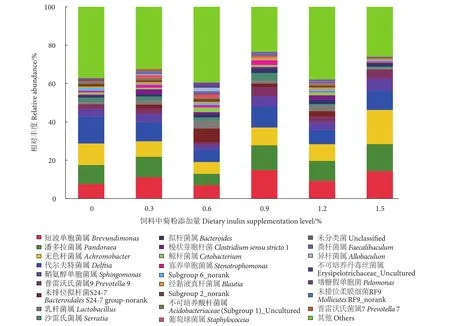
图3 摄食不同菊粉水平饲料的卵形鲳鲹肠道菌群属水平的相对丰度Fig. 3 Relative abundance of predominant genus of gastrointestinal microbiota of T. ovatus fed with diets containing inulin at various concentrations
样本聚类分析显示,菊粉添加量0、0.3%、0.6%和1.2%组为第一聚类,而0.9%和1.5%组为第二聚类,说明这两组卵形鲳鲹的肠道菌群结构相似度较高 (图4)。
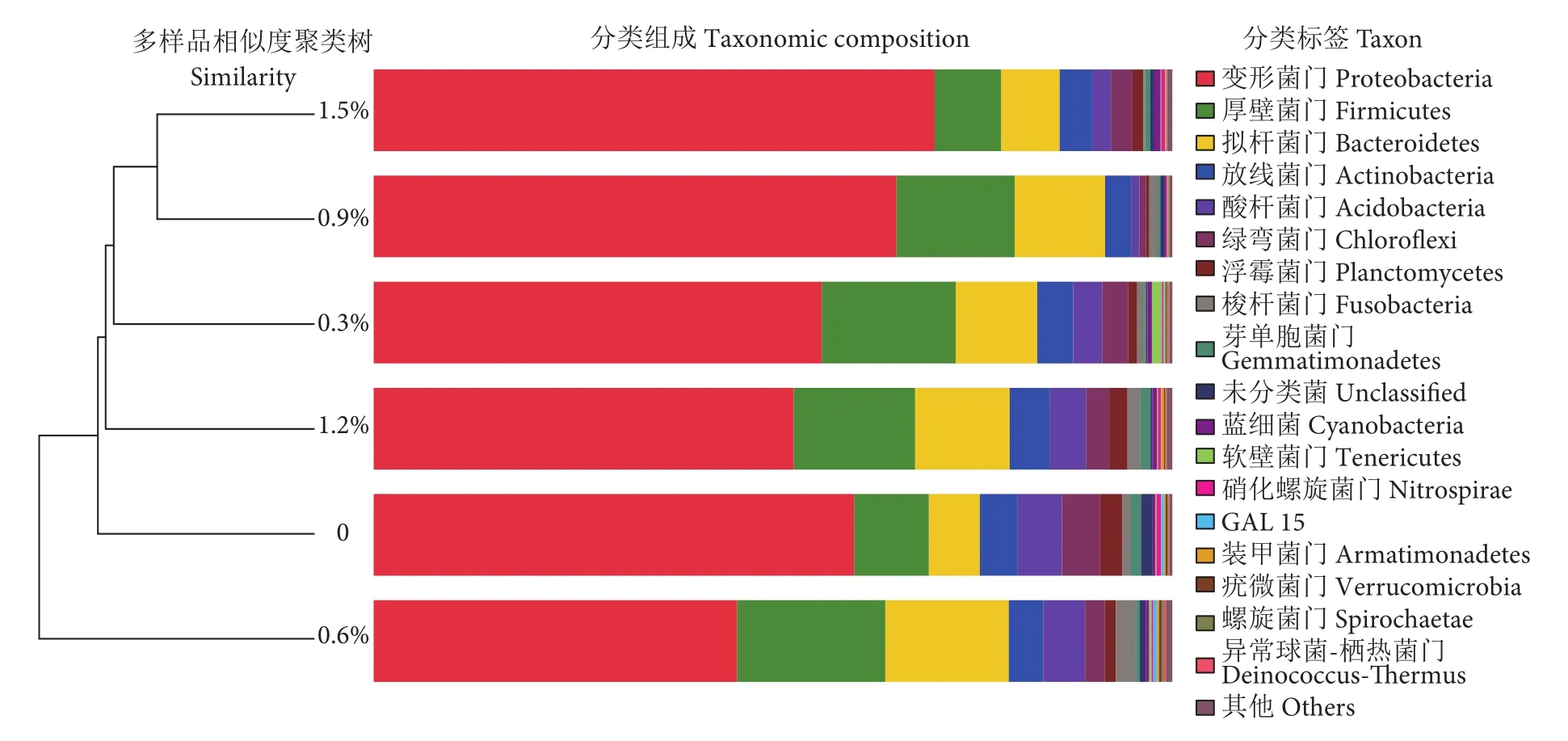
图4 卵形鲳鲹幼鱼肠道菌群水平聚类分析Fig. 4 Cluster analysis of intestinal flora of T. ovatus
3 讨论
高密度是现代集约化养殖模式最显著的特征之一,养殖鱼类所受到的应激胁迫也相应增加,将更多的能量消耗在对抗外界压力和自身应激上,导致成活率和生长速度降低。益生元可提高动物免疫性能、增强机体抗病力和抗应激能力,一定程度上能减少养殖鱼类疾病的发生,可以替代或减少抗生素类药物的使用,具有广阔的应用前景。
本研究中,摄食添加1.5%菊粉饲料的卵形鲳鲹具有最高的成活率,显著高于对照组,并且该处理组有最大的终末体质量、增重率和特定生长率,表明在饲料中添加菊粉具有提高成活率和促生长的效果。Ibrahem等[23]研究发现,在罗非鱼饲料中添加0.5%的菊粉,明显提高了鱼的成活率、增长率和特定生长率,且显著提升了溶菌酶活性和攻毒成活率。Tiengtam等[21]在罗非鱼的饲料中添加5%的菊粉,显著增强了血液中的红血球数量,以及葡萄糖、白蛋白、蛋白质、镁、钙和铁的含量,且显著增强了溶菌酶活性。Ortiz等[24]在饲料中添加5%或10%的菊粉显著提高了虹鳟 (Oncorhynchus mykiss) 的增重率,并显著降低了肠道中有害弧菌的数量。吴越[25]发现在饲料中添加1%菊粉能显著提高卵形鲳鲹白细胞介素 (IL-11) 在肠道中的表达量,并显著降低了卵形鲳鲹在哈氏弧菌 (Vibrio harveyi) 攻毒胁迫下的死亡率。上述结果说明菊粉可提高养殖鱼类的内源性免疫和抗应激能力,减少病害的发生,从而改善鱼类的健康状况。这可能是本研究中菊粉添加组成活率和生长速度提高的原因。但值得注意的是,也有研究指出,饲料中添加菊粉并没有明显改善大西洋鲑 (Salmo salar)[26]、杂交条纹鲈 (Morone chrysops×M. saxatilis)[27]和暗纹东方鲀 (Takifugu obscures)[28]的生长和存活表现。尤其是Reza等[29]在欧洲鳇 (Huso huso) 幼鱼饲料中添加了1%~3%的菊粉,结果显示鱼的增长率、蛋白质效率、能量和蛋白质沉积率、饲料转化率等指标与菊粉添加量存在负相关性。这些结果可能是添加量、所用饲料的营养成分和养殖环境不同等因素所致,说明菊粉对鱼类的作用可能存在种属差异性。因此,在饲料中添加菊粉时需要先针对不同种类和养殖模式开展试验评估。
肥满度、肝体比等形态指标是反映养殖鱼健康和产品品质的重要参数。鱼类对糖类的利用能力低于畜禽等陆生动物,对饲料蛋白质和脂肪的需求较高,而高蛋白、高脂肪的饲料会造成鱼类腹部和肝脏脂肪沉积增加,导致肝脏肿大,表征健康的肥满度、肝体比、脂体比等指标升高。本研究发现,在饲料中添加菊粉降低了卵形鲳鲹幼鱼的脏体比、肝体比、脂体比和肥满度,其中菊粉添加组和对照组之间的肝体比和脂体比差异达到显著水平。本研究中形态指标的改善也可能是摄食添加菊粉饲料的卵形鲳鲹具有更高成活率和生长速度的原因。李会峰[30]研究指出在凡纳滨对虾 (Litopenaeus vannamei) 的饲料中添加0.1%、0.2%和0.4%的菊粉显著降低了对虾的肝体比,与本研究结果一致。菊粉降低了脂肪在肝脏和其他内脏中的沉积,可能是通过其降血脂作用实现的[31]。这些发现具有重要意义,因为肝脏疾病是包括卵形鲳鲹在内的养殖鱼类最常见的疾病,脂肪沉积增加导致的脂肪肝是肝脏病变的重要原因,目前尚无有效的解决方法。因此,这一研究结果对于养殖过程中改善鱼类健康和提高成活率具有重要启发意义。
肠道是动物消化吸收食物的主要器官,包括菊粉在内的多糖类物质可以通过两方面对肠道产生影响:1)通过影响肠道蠕动神经递质的水平,特别是兴奋神经递质 (Substance P)和胃蠕动素(Motilin),以及抑制性神经递质 (Vasoactive intestinal peptide) 和钙素基因相关肽 (Calcitonin gene related peptide),Yu等[32]研究发现在饲料中添加0.5%的菊粉可以提高猪的兴奋神经递质和胃蠕动素水平,降低抑制性神经递质和钙素基因相关肽的水平,从而促进肠道蠕动,提高肠道的代谢速度;2)通过改变肠道形态如肠道绒毛的长度,从而增加营养物质的接触面积和肠道的吸收能力[33-34]。本研究中摄食添加菊粉饲料的卵形鲳鲹幼鱼的肠绒毛高度大于对照组。对罗非鱼的研究发现在饲料中添加菊粉能显著增加肠绒毛高度和杯状细胞数量[21],对鸡等禽类的研究也有类似结果[35-36],但在金头鲷的饲料中添加1%的菊粉,并未发现肠绒毛面积有明显增加[37],更有研究指出在红点鲑 (Salvelinus alpinus)的饲料中添加高剂量 (15%) 的菊粉,对肠道的形态结构产生了负面影响[22]。说明菊粉对肠绒毛等肠道形态结构的影响与鱼的种类以及添加量有关,在应用前必须严格评估其适宜的添加量。
肠道菌群中厌氧菌、兼性厌氧菌和好氧菌等所组成的动态内环境平衡,以及有益菌和有害致病菌的种类和数量比例影响着鱼类肠道健康、对营养物质的吸收、内分泌调节等生理机制[38-41]。养殖水环境和食物是鱼类肠道菌群结构形成和改变的两个关键因素[42]。菊粉通过为有益菌提供发酵反应的底物而影响不同微生物的丰度,是其对肠道菌群功能发生影响的可能途径[43-46]。微生物群落结构主要取决于优势种及其丰度的变化。本研究显示,变形菌门、厚壁菌门和拟杆菌门是卵形鲳鲹肠道菌群的优势种,这与Xun等[47]的研究结果一致。有研究指出变形菌门种群丰度的增加会导致肠道菌群结构失调和肠道免疫力下降[48-49]。厚壁菌门主要作用于合成短链脂肪酸 (SCFAs) 以及糖脂代谢,但厚壁菌门丰度的提高可能会增加鱼类肝脏脂肪积累[28,50]。Pu等[51]在猪的饲料中添加了19.1%的膳食纤维,发现可以显著增加微生物的多样性,同时促进短链脂肪酸的代谢。本研究中1.5%菊粉组的卵形鲳鲹肠道中变形菌门丰度最高,0.6%组的拟杆菌门和厚壁菌门丰度最高,而1.5%组的厚壁菌门丰度最低,对照组拟杆菌门丰度最低。拟杆菌门是参与多糖、胆固醇代谢和碳水化合物发酵的重要菌群[52]。单从这个角度看,0.6%组的肠道菌群组成优于对照组和1.5%组,1.5%添加量可能超过了卵形鲳鲹幼鱼的最适水平。
特定种类的微生物如拟杆菌能通过降解肠道上皮的黏蛋白为自己和宿主提供能量[50],但黏蛋白降解过度会破坏肠道黏液层,增加宿主被致病菌感染的风险,而菊粉可以替代黏蛋白而被微生物降解,从而维持黏液层生理结构的稳定[53]。在属水平上,无色杆菌属、短波单胞菌属和潘多拉菌属是优势菌属。无色杆菌属中的木糖氧化无色杆菌 (A. xylosoxidans) 会导致囊肿性纤维化而损害肠道健康[54]。短波单胞菌具有严重的侵入性和感染性,会对宿主的肠道产生一系列有害影响[55]。潘多拉菌属对于大多数Beta-内酰胺类和氨基糖苷类药物具有抵抗性,严重感染会引起败血症[56]。研究表明饲料中添加0.5%的菊粉能显著降低刺参 (Apostichopus japonicas) 肠道中致病菌的种群丰度[57]。本研究中,无色杆菌属的种群丰度在0.6%菊粉组最低,在1.5%组最高。短波单胞菌属、潘多拉均属、代尔夫特菌属、鞘氨醇单胞菌属均为条件致病菌,其丰度在0.6%菊粉组最低,说明饲料中添加适宜水平的菊粉能抑制卵形鲳鲹肠道中的致病菌数量。这可能是因为菊粉能与病原菌表面的外源凝集素发生特异性结合,从而阻止病原菌在肠道上的黏附和侵染[57]。Wang等[58]研究发现给奶牛每天饲喂300 g菊粉不仅能显著抑制其肠道致病菌的增殖,增强抗炎反应,还可提升其肠道中益生菌的丰度及半乳糖和丙酮酸的代谢水平。与对照组相比,菊粉添加使肠道中的无色杆菌属和普雷沃氏菌属 (Prevotella) 等有益菌的数量增加。普雷沃氏菌具有蛋白降解和发酵利用复杂多糖所必需的酶和基因簇,有助于饲料中蛋白质和碳水化合物的分解。但需要注意的是,肠道菌群受到多种因素的复杂影响,食物中的营养物质仅是众多因素之一,从菊粉添加量对应分析肠道菌群组成的变化需要非常谨慎,且不同菌之间也存在着相互作用,即使是有益菌,当其数量过高时,也会对宿主产生负面影响。揭示食物对肠道菌群结构及其功能的影响及潜在机制,需要开展更多的相关研究,从多个角度综合分析才能获得更深刻和全面的认知。
4 小结
本研究显示,在饲料中添加菊粉对卵形鲳鲹肠道菌群的优势种及其丰度等有明显影响,降低了脏体比、肝体比和脂体比等指标,说明鱼的健康状况得到改善,添加1.5%菊粉组有最高的成活率、终末体质量和生长速度,说明在卵形鲳鲹幼鱼的饲料中添加1.5%的菊粉可以提高其养殖成活率和生长性能,但菊粉对肠道菌群的影响及其作用机制还需进一步研究。
——奇妙的蛋

