肿瘤标志物联合检测诊断原发性肝癌的价值
周丽
上饶市广丰区人民医院 (江西上饶 334600)
原发性肝癌(primary hepatocellular carcinoma,PHC)是指原发于肝细胞和肝内胆管上皮细胞的恶性肿瘤,具有发病率高、病情进展快、预后差等特点,病因及发病机制至今仍未被明确,多被认为与环境、病毒性肝炎、肝硬化等因素密切相关。PHC患者早期无典型症状,大部分患者确诊时已经处于中晚期,严重危及患者生命安全[1]。故尽早诊断PHC 对于控制病情、促进疾病转归意义重大[2-3]。鉴于此,本研究探究肿瘤标志物联合检测诊断PHC的价值,现报道如下。
1 资料与方法
1.1 一般资料
选择2018 年4 月至2020 年6 月于我院经病理检查诊断为PHC 的70 例患者作为PHC 组,另选择同期于医院经病理检查明确为良性肝病的66 例患者作为良性肝病组。PHC 组男43 例,女27 例;年龄32~76 岁,平均(54.38±3.67)岁;体质量指数(body mass index,BMI)20.4~28.7 kg/m2,平均(24.62±0.75)kg/m2。良性肝病组男38 例,女28 例;年龄32~78 岁,平均(54.40±3.72)岁;BMI 20.5~28.8 kg/m2,平均(24.59±0.68)kg/m2。本研究获伦理委员会批准,两组性别、年龄、BMI 等一般资料比较,无统计学差异。具有可比性。
纳入标准:PHC 组符合《原发性肝癌诊疗规范(2017年版)》[4]中PHC 的诊断标准,且经病理学检查诊断为PHC;良性肝病组经影像学及病理学检查明确为良性肝病;年龄>18岁;患者及家属均知情同意。排除标准:伴有其他肝胆系统疾病,如胆囊结石、胆囊炎等;已接受放、化疗;伴有感染性疾病;凝血功能异常;免疫系统疾病;精神疾病,无法配合完成本研究。
1.2 方法
要求所有患者于检查前一天禁食8 h,采集次日清晨4 ml 空腹肘静脉血,待血液标本自然凝固后将其置于离心机上,以3 000 r/min 速度离心10 min 后获得上层血清。采用免疫分析仪(罗氏公司生产,cobas e411 型,国械注进20182222487),利用电化学发光法对肿瘤标志物[甲胎蛋白(alpha fetoprotein,AFP)、 癌 胚 抗 原(carcinoembryonic antigen,CEA)、糖类抗原199(carbohydrate antigen 199,CA199)、糖类抗原125(carbohydrate antigen 125,CA125)、糖类抗原153(carbohydrate antigen 153,CA153)]水平进行检测,且均采用罗氏公司提供的检测试剂,所有操作均按照试剂盒要求进行。
肿瘤标志物正常参考值范围如下:AFP 水平<5.8 IU/ml;CEA 水 平,20~69 岁 患 者<4.7 ng/ml,非吸 烟 患 者(20~69 岁)<3.8 ng/ml,吸 烟 患 者(20~69 岁)<5.5 ng/ml;CA199 水平<27.0 U/ml;CA125 水 平<35.0 U/ml;CA153 水 平<25.0 U/ml。单独检测时,不在正常参考值范围即为PHC;联合检测时,一项不在正常参考值范围即为PHC。
1.3 观察指标
比较两组AFP、CEA、CA199、CA125 及CA153 水平,并以病理结果作为诊断“金标准”,分析AFP、CEA、CA199、CA125 及CA153 单独及联合检测在PHC中的诊断价值,另计算上述肿瘤标志物单独及联合检测与病理结果的一致性。
1.4 统计学处理
2 结果
2.1 两组肿瘤标志物水平比较
相比于良性肝病组,PHC 组AFP、CEA、CA199、CA125及CA153水平均较高,有统计学差异(P<0.05),见表1。
表1 两组肿瘤标志物水平比较(±s)
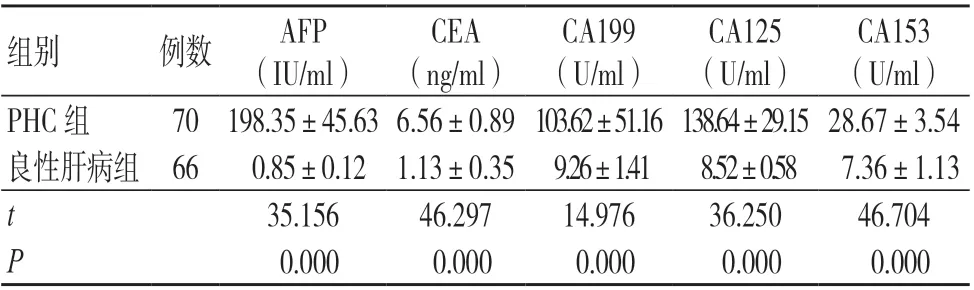
表1 两组肿瘤标志物水平比较(±s)
注:AFP 为甲胎蛋白,CEA 为癌胚抗原,CA 为糖类抗原
CA153(U/ml)PHC 组 70 198.35±45.63 6.56±0.89 103.62±51.16 138.64±29.15 28.67±3.54良性肝病组 66 0.85±0.12 1.13±0.35 9.26±1.41 8.52±0.58 7.36±1.13 t 35.156 46.297 14.976 36.250 46.704 P 0.000 0.000 0.000 0.000 0.000组别 例数 AFP(IU/ml)CEA(ng/ml)CA199(U/ml)CA125(U/ml)
2.2 诊断价值及一致性
相比于肿瘤标志物单独检测,肿瘤标志物联合检测在PHC 诊断中的灵敏度、准确度、阳性预测值及阴性预测值均较高,有统计学差异(P<0.05);AFP 单独检测诊断PHC 结果与病理检查结果的一致性尚可(Kappa=0.457,P=0.000);CEA 单独检测诊断PHC结果与病理检查结果的一致性不佳(Kappa=0.016,P=0.817);CA199 单独检测诊断PHC 结果与病理检查结果的一致性不佳(Kappa=0.330,P=0.000);CA125 单独检测诊断PHC 结果与病理检查结果的一致性不佳(Kappa=0.243,P=0.002);CA153 单独检测诊断PHC 结果与病理检查结果的一致性不佳(Kappa=0.122,P=0.037);肿瘤标志物联合检测诊断PHC 结果与病理检查结果的一致性良好(Kappa=0.779,P=0.000),见表2~3。
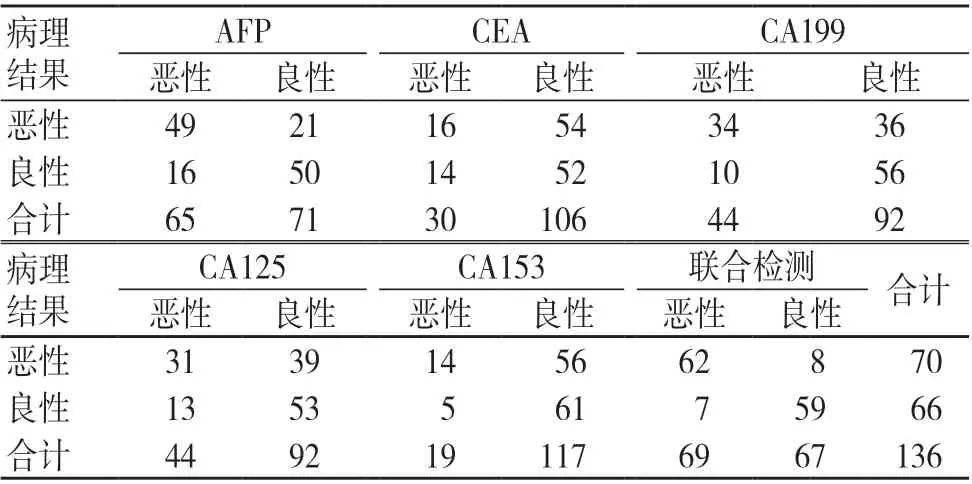
表2 肿瘤标志物单独及联合检测诊断PHC 的结果(例)
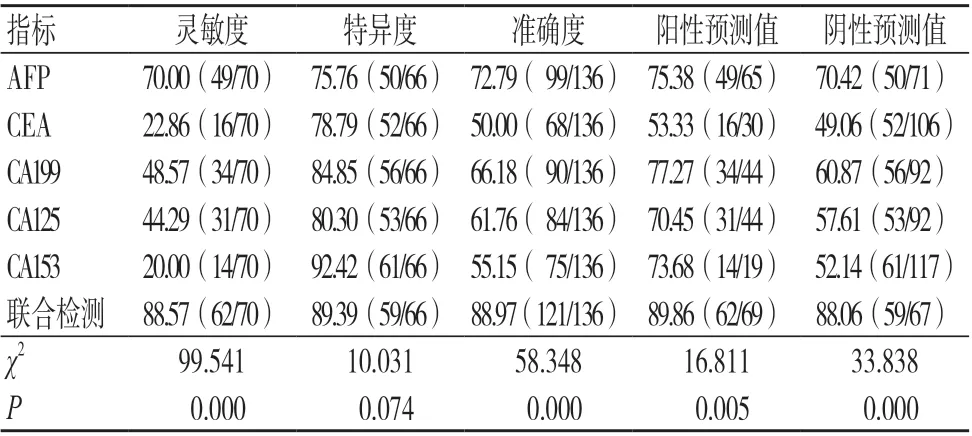
表3 肿瘤标志物单独及联合检测诊断PHC的价值(%)
3 讨论
现阶段,临床诊断PHC 主要依靠病理检查、MRI、CT、肿瘤标志物检测等方法,其中病理检查结果为“金标准”,但属有创操作,部分患者接受度较低,使其在临床应用中存在局限性;MRI 及CT等影像学检查受病变体积等因素影响,在疾病早期诊断中极易造成误诊或漏诊,影响诊断准确度;血清肿瘤标志物检测是近年来在PHC 诊断中新兴的方法,通过评估肿瘤标志物水平,判断机体是否出现恶性病变,为临床诊断提供可靠依据[5]。
AFP、CEA、CA199、CA125 及CA153 均 为肿瘤标志物,其中,AFP 是临床早期筛查肿瘤的常用指标,多用于肝癌的诊断及疗效判定,但该指标在诊断中假阳性率较高,可达60%~80%,影响临床诊断;CEA 主要用于恶性肿瘤的辅助诊断,尤其是对于由内胚层分化而来的恶性肿瘤,检出率较高,但在PHC 诊断中灵敏度及特异度均较低,且在PHC 早期诊断中效果不佳[6];CA199 是存在于血液循环的胃肠道肿瘤相关抗原,与AFP 联合检测在肝肿瘤良恶性诊断中效果较好;CA125 来源于胚胎发育期体腔上皮,多用于恶性肿瘤的诊断,其水平越高,提示机体出现癌变概率越大;CA153 是乳腺癌最常使用的肿瘤标志物,但在肝癌、转移性卵巢癌等恶性肿瘤中也出现不同程度的增高[7]。虽然上述肿瘤标志物单独检测在PHC 诊断中具有一定的价值,但无法获得较为满意的效果,且各肿瘤标志物间的诊断结果存在较大的差异。本研究结果显示,PHC组AFP、CEA、CA199、CA125 及CA153 水平均高于良性肝病组,差异有统计学意义(P<0.05);肿瘤标志物联合检测诊断PHC 的灵敏度、准确度、阳性预测值及阴性预测值均高于AFP、CEA、CA199、CA125 及CA153 单独检测,差异有统计学意义(P<0.05);肿瘤标志物联合检测诊断PHC 结果与病理检查结果的一致性良好(Kappa=0.779,P=0.000);表明肿瘤标志物水平在PHC 患者中出现异常改变,联合检测诊断PHC 的价值较高,可较好地弥补单独检测诊断的不足,为临床进一步明确诊断PHC 提供可靠依据。究其原因可知,肿瘤标志物联合检测能够有效克服因肝癌病理特征不同导致的肿瘤标志物表达水平变化,有助于提高诊断的准确度。另细胞表型间存在差异,肿瘤标志物单独检测存在灵敏度、特异度均较低的现象,而肿瘤标志物联合检测能够有效克服上述缺陷,从而提升诊断价值[8]。
综上所述,肿瘤标志物联合检测诊断PHC 的价值较高。

