原发性肝癌患者合并腹膜转移的相关影响因素预测分析
林昭旺,汪坚,杨灵,方敏
福建医科大学孟超肝胆医院影像科 (福建福州 350025)
原发性肝癌是全球第5 大常见癌症、第4 大癌症死亡原因[1],在我国恶性肿瘤中发病率排名第4,致死率排名第2[2]。原发性肝癌主要包括肝细胞癌(hepatocellular carcinoma,HCC)、肝内胆管细胞癌(intrahepatic cholangiocarcinoma,ICC)、混合型肝细胞癌-胆管癌(combined hepatocellular-cholangiocarcinoma,cHCC-CCA),其中HCC 占80%以上[3]。手术切除是目前唯一可能治愈肝癌的方法,但肝外转移是影响治疗效果的主要因素,其中肺、骨、淋巴结是常见的肝外转移部位,腹膜转移相对少见[4]。原发性肝癌合并腹膜转移的独立危险因素可能为经皮肝脏穿刺活检、肝癌自发性破裂出血,但仍存在争议[5-7]。另有研究认为,无论是否存在肺、骨、淋巴结等肝外转移,Child-Pugh 分级和TNM 分期才是影响原发性肝癌预后更重要的因素[8-10]。然而,有关合并腹膜转移是否为原发性肝癌预后的独立危险因素鲜有报道[11]。鉴于此,本研究旨在通过比较原发性肝癌合并腹膜转移患者和原发性肝癌未合并腹膜转移患者的Kaplan-Meier 生存曲线,探讨原发性肝癌患者合并腹膜转移的临床特征、相关影响因素及预后,现报道如下。
1 资料与方法
1.1 一般资料
回顾性分析2012 年8 月至2022 年3 月我院收治的44 例经病理、CT 及磁共振影像学证实为原发性肝癌合并腹膜转移患者[影像学检查腹膜上可见典型的腹膜软组织结节影和(或)腹膜“污垢样”增厚即为腹膜转移[12-13],腹膜转移组]初次确诊肝癌时的临床资料,其中HCC 39 例,ICC 3 例,cHCC-CCA 2 例。另回顾性分析同期我院收治的44 例经病理、CT 及磁共振影像学证实为原发性肝癌(年龄、性别、Child-Pugh 分级、肝癌分期等原发性肝癌相关危险因素与腹膜转移组相匹配[14],见表1)未合并腹膜转移患者(无腹膜转移组)初次确诊肝癌时的临床资料,其中HCC 35 例,ICC 9 例,cHCC-CCA 0 例。本研究通过福建医科大学孟超肝胆医院伦理审查委员会审查和批准(2020_072_01),所有患者均对本研究知情同意并签署知情同意书。

表1 两组原发性肝癌相关危险因素比较
纳入标准:≥18岁;临床病理、影像学资料完整;初诊原发性肝癌后1周内行手术切除,以获得病理确诊证据。排除标准:CT 或磁共振影像腹膜表现不典型;伴有其他脏器原发性肿瘤;免疫力极度低下。
1.2 方法
登录医院病历系统,收集两组一般资料[年龄、性别、初次确诊肝癌时Child-Pugh 分级、肝癌分期、术后随访时间、局部淋巴结转移、除腹膜外远处转移、实验室检查结果(初次确诊肝癌时,糖类抗原199、甲胎蛋白、白蛋白、总胆红素、凝血酶原时间)、针道损伤、肝癌破裂]。为保证结果具有可比性,CT 扫描使用飞利浦128排(256层)CT;磁共振扫描使用西门子Verio 3.0T 磁共振,扫描部位为全腹部,扫描范围为膈顶至盆底;结果由两名均具有10年放射科工作经验的医师共同判定;实验室检查结果用于计算Child-Pugh 分级,影像学指标用于评估肝癌分期。
另对于腹膜转移组,记录原发性肝癌确诊至腹膜转移确诊时间、腹膜转移确诊至随访结束时间、确诊腹膜转移后转归、腹膜转移确诊方式、腹膜转移表现形式、腹膜转移部位、确诊腹膜转移时Child-Pugh 分级、肝内肿瘤状态[其中,肝内肿瘤状态分为控制良好(局部治疗成功基础上肝内无复发肿瘤,如完全切除、完全消融坏死、密实型碘油沉积)、控制不佳或进展(新发或存活的肝内肿瘤)]、向肝外其他实质器官转移。
1.3 评估指标
分析原发性肝癌患者腹膜转移的相关影响因素,计算并比较两组Kaplan-Meier 生存曲线。
1.4 统计学处理
采用SPSS 22.0统计软件进行数据处理,以Kaplan-Meier 法绘制生存曲线,log-rank检验两组生存曲线是否存在差异;计量资料以中位数(范围)表示,组间比较采用非参数检验;计数资料以率表示,组间比较采用χ2检验;等级资料采用秩和检验,P<0.05为差异有统计学意义。
2 结果
2.1 原发性肝癌患者腹膜转移的相关因素分析
单因素分析显示,原发性肝癌患者腹膜转移与肝癌破裂有关(P=0.031),见表2、图1。

表2 原发性肝癌患者腹膜转移的相关因素分析[例(%)]
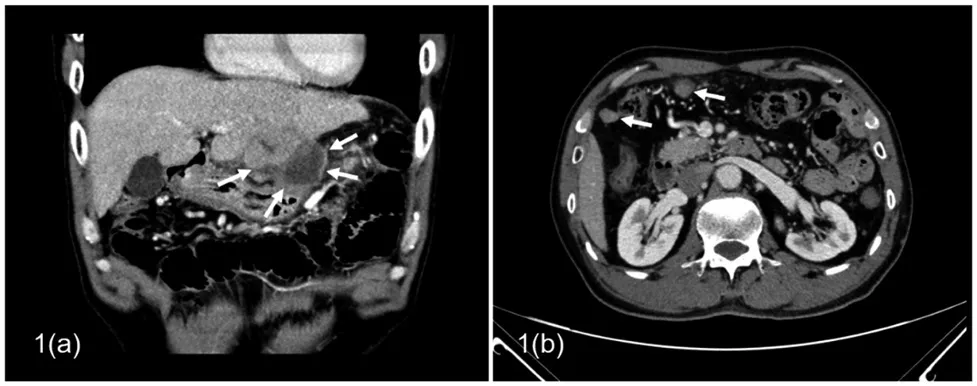
图1 肝癌自发性破裂出血病例
2.2 腹膜转移组临床特征
腹膜转移组原发性肝癌确诊至腹膜转移确诊中位时间为11 个月(范围1~75 个月);腹膜转移后中位生存时间为7 个月(范围0~56 个月);确诊腹膜转移后转归死亡占比50.00%;腹膜转移确诊方式以增强磁共振为主;腹膜转移表现形式以腹膜软组织结节影或腹膜软组织结节影和腹膜“污垢样”增厚并存为主;腹膜转移部位在右侧结肠旁沟或右侧肝下区、大网膜前区、其他腹膜区域;确诊腹膜转移时Child-Pugh 分级仍以A、B 级为主,但比例较初次确诊肝癌时已有所下降;肝内肿瘤状态多为控制不佳或进展;所有患者均有不同程度的向肝外其他实质器官转移,具体见表3。

表3 腹膜转移组临床特征
2.3 两组Kaplan-Meier 生存曲线比较
当原发性肝癌相关危险因素(年龄、性别、Child-Pugh 分级、肝癌分期等)相匹配时,两组总生存期比较,差异无统计学意义(χ2=0.002,P=0.963),见图2。

图2 两组Kaplan-Meier 生存曲线比较
3 讨论
从本研究结果推论可知,除年龄、性别、Child-Pugh 分级和肝癌分期已知因素外,术前或术中肝癌破裂是肝癌合并腹膜转移的独立危险因素,而针道损伤不是预测肝癌腹膜转移的独立危险因素。推测可能原因是肝癌破裂时,癌细胞可能随着血流播散到整个腹腔,从而引发腹膜转移。有文献报道,肝癌患者自发性破裂发生率在3%~12%之间[11,15],本研究无腹膜转移组肝癌破裂发生率(9.09%)与其相符;腹膜转移组肝癌破裂发生率较其更高(29.55%),提示肝癌破裂可能是导致腹膜转移的关键因素。但尸检病例文献[14,16]报道腹膜转移患者自发性肝癌破裂发生率远高于本研究结果,可达52.9%。推测可能原因为:(1)死亡后尸检率较高,从而提高检出率,而活体患者常仅发生轻微破裂,因症状轻微而被忽视漏检;(2)影像学手段(CT或磁共振)用以评估肝癌破裂,图像分辨力相对较低有可能造成漏诊,而尸检可明确诊断;(3)本研究样本量较小,可能存在抽样误差。
有学者认为,腹膜转移不是肝癌进展的预后因素,而是一种与肝癌晚期相关的现象[14]。本研究结果显示,在肝癌患者的其他危险因素(年龄、性别、Child-Pugh 分级、肝癌分期)匹配后,腹膜转移虽不是一个独立的预后因素,但腹膜转移后中位生存时间较短(7个月),表明患者已进入疾病晚期,与上述研究结论相符。然而,相关文献也指出,仍有一些肝癌合并腹膜转移患者的生存期相对较长[17-18],在本研究中也存在类似病例,如确诊腹膜转移后生存时间最长达56个月且仍持续生存。推测可能的原因是这些患者肝内肿瘤灭活完全并保持较好的肝功能水平。现有研究表明,肝癌患者即使已经合并肝外转移(含腹膜转移),肝内肿瘤状态和肝功能仍然是影响其预后的主要因素[19-20]。因此,仍应重点强调支持治疗的必要性,持续对肝内肿瘤进行积极治疗,同时保持良好的肝功能水平。
综上所述,原发性肝癌患者腹膜转移与肝癌破裂有关,但腹膜转移并不能独立影响原发性肝癌患者的总生存期;在原发性肝癌合并腹膜转移患者中,Child-Pugh 分级和肝癌分期仍是影响其总生存期最重要的因素。

