二硼化铝在空气与水介质中的热氧化特性研究
赵 杭,杨伯涵,陈浩楠,肖金武
(航天化学动力技术国防重点实验室,湖北航天化学技术研究所,湖北 襄阳 441003)
跨介质航行体[1]可实现空中飞行与水中/水下航行的结合,是未来运载工具、特种设备的重要发展方向,具有广泛的应用前景。支撑该项新型技术的核心之一在于与空气、水均具有良好反应特性的高热值固体燃料。
无定形硼粉和铝粉是常见固体燃料中的热值最高的两类物质[2,3,5],空气氛围下,理论质量热值分别为59.3、31.1MJ·kg-1。单独燃烧条件下,硼粉与铝粉由于表面存在的氧化膜能够阻碍氧化剂扩散,因此,燃烧过程中普遍存在点火延迟高、氧化反应不充分等问题[4,5]。研究表明,将铝粉掺混至硼粉中能够显著改善B的点火燃烧性能[6-8],且点火延迟和点火温度显著下降[9]。同时,合金化制备的铝硼合金粉亦可有效提高燃烧效率[10,11]。
二硼化铝(AlB2)是铝元素与硼元素形成的具有呈环状结构的无机化合物,是一种应用潜力较大的高热值硼基燃料。目前,有关AlB2燃烧的研究内容相对较少,特别是其在水环境中的氧化特性暂未见公开报道。本文以AlB2作为研究对象,对其形貌、燃烧热进行观察与测试;采用热分析手段对AlB2在空气、水两种环境氛围下的热力学特性进行系统研究,并与无定形硼粉和铝粉进行了对比分析,对AlB2用于跨介质燃料的可行性进行了研判。
1 实验部分
1.1 样品与仪器
无定形硼粉(中值粒径1.57μm江苏智仁景行新材料研究院);球形铝粉(规格为Q1鞍钢实业集团有限公司);AlB2(80目 沈阳金属研究所)。
STA-449F3型差示扫描量热仪(德国NETZSCH公司);Quanta 650型扫描电子显微镜(SEM)(美国赛默飞);1266型氧弹量热仪(法国PARR公司)。
1.2 表征方法
采用SEM观察AlB2表面形貌;采用氧弹量热仪对无定形B、球形Al粉、AlB2的燃烧热进行测试。
采用差示扫描量热仪对Al粉、B粉和AlB2进行热重分析-差示扫描量热法(TG-DSC)分析,实验气氛为空气,升温范围为室温至1400℃,空气流速设置为20mL·min-1,实验中选取10、20、30℃·min-13个升温速率。改变环境气氛对Al粉、B粉和AlB2进行水环境下的热重分析,实验气氛为80%水蒸气+20% N2,升温范围150~1000℃,水蒸气流量20mL·min-1,升温速率10℃·min-1。
2 结果与讨论
2.1 形貌分析
图1为AlB2的SEM图像。

图1 AlB2的SEM图像Fig.1 SEM image of AlB2
由图1可以看到,AlB2颗粒结构呈不规则球状,颗粒间不存在团聚现象,进一步观察颗粒表面可以发现,颗粒表面十分粗糙,呈现层状结构,表面不致密,存在较多空隙,这一结构有利于氧化性气氛向颗粒内部扩散。
2.2 燃烧热测试
图2为采用氧弹量热仪测得的球形Al粉、无定形B粉和AlB2燃烧热值。
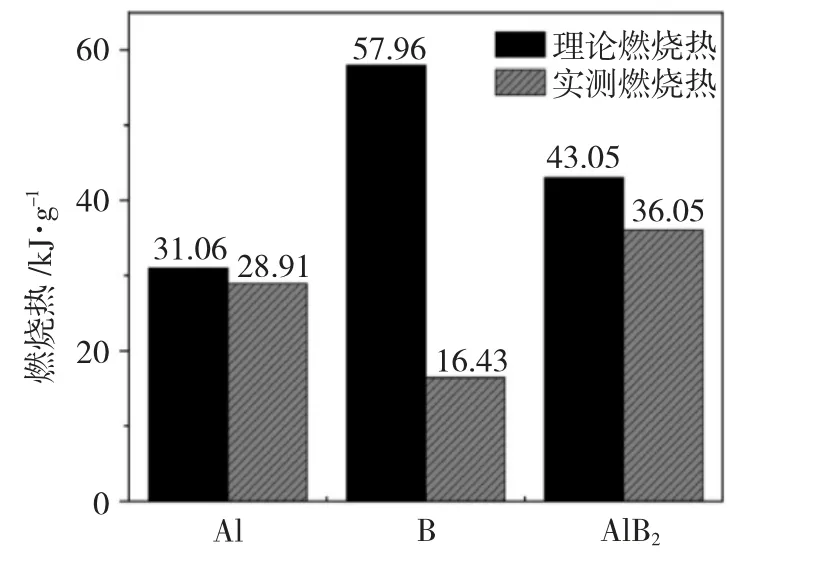
图2 Al、B和AlB2质量燃烧热测试结果Fig.2 Results of mass combustion heat of Al,B and AlB2
由图2可以看到,AlB2的实测燃烧热最高,为36.05kJ·g-1;无定形B粉的实测燃烧热值仅为16.43kJ·g-1,放热量较低;Al粉的实测燃烧热值为28.91kJ·g-1,已接近其燃烧热的释放极限。对比AlB2和无定形B粉可知,相同条件下AlB2的实测燃烧热相较于无定形B提高了119.42%,这是因为高温下Al和B的氧化物Al2O3与B2O3可反应生成硼酸铝(Al4B2O9),降低了B2O3和Al2O3对后续氧化反应的阻碍作用[11],因此AlB2可以更充分地与氧气接触并发生氧化。
2.3 空气氛围中的热性能研究
图3为20℃·min-1升温速率下Al、B、AlB2的TG-DSC曲线图。表1列出了样品的热氧化性能参数,其中点火温度采用TG-DTG切线法[12]进行判别,η表示反应效率,按式(1)计算:
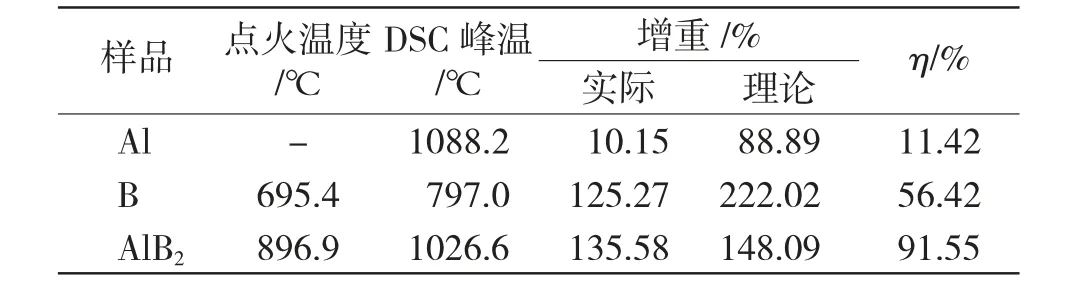
表1 不同样品在空气氛围的热氧化性能参数Tab.1 Thermal oxidation characteristic parameters of different samples in air atmosphere
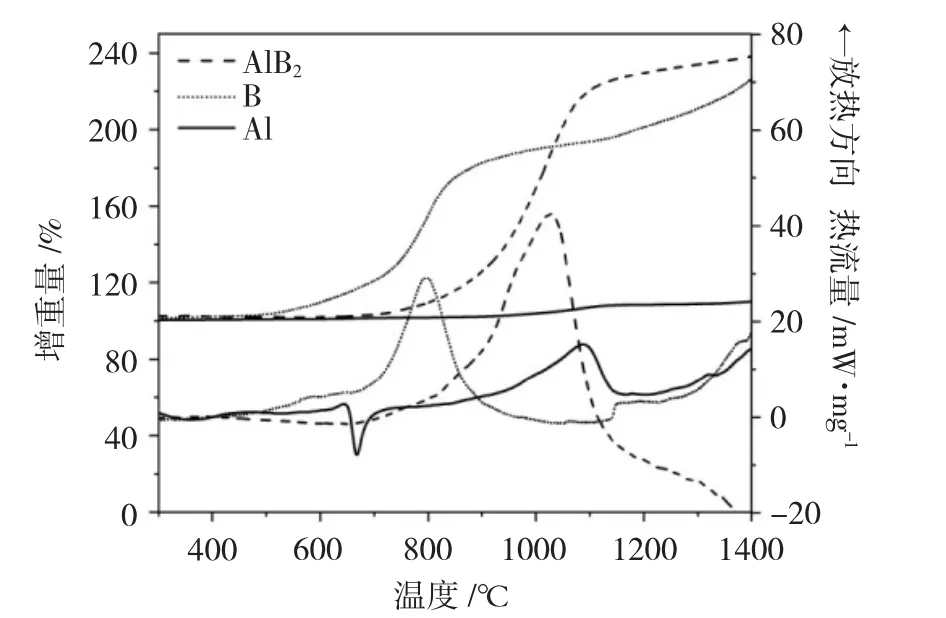
图3 不同样品的TG-DSC曲线(20℃·min-1)Fig.3 TG-DSC curves of different samples(20℃·min-1)

式中ME:实际增重;MT:理论增重。
由图3可以看到,Al在整个升温范围内未出现明显增重,表明在整个升温范围内Al无明显放热反应,约660℃出现的吸热峰可能是Al熔融引起的,1088.2℃出现的放热峰,可能是内部Al不断熔融膨胀导致颗粒内部压强变大,表面氧化层出现裂缝,内部铝液流出后发生氧化引起。B的TG曲线显示B在约650℃氧化开始加速,900℃后TG曲线趋于平缓,体系增重速度下降,可能是体系中B2O3含量过多,导致B难以与O2接触发生氧化。
AlB2的TG曲线呈现单阶段增重,体系在约700℃时氧化开始加速,氧化反应启动后其增重量迅速增加,1200℃时TG曲线趋于水平,表明体系氧化基本完成。
由表1可以看到,AlB2的点火温度高于无定形B,为896.9℃,这是因为AlB2在点火过程中首先要经历Al的释放[13],因此,需要在更高的温度下AlB2才开始发生氧化。AlB2在本实验温度范围内的反应效率大于无定形B与球形Al,达到了91.55%,这是因为AlB2中的Al和B可同时发生氧化,反应生成的Al2O3和B2O3能立刻发生反应生成高熔点的复合物Al4B2O9,这抑制了B2O3液膜与致密Al2O3膜的形成,且Al4B2O9的形态为针状结构,可以减少氧扩散距离并提高转化利率[14]。
2.4 B和AlB2的非等温动力学研究
热分析动力学是一种计算表观活化能、指前因子等参数的手段,这些参数能够反馈物质热动力学相关的基本信息[15]。热分析动力学的方法分为等温和非等温法,其中非等温法可以避免因选取具体的反应模型函数而产生的误差。AlB2在空气氛围中的反应效率和采用氧弹法测得的燃烧热相较于无定形B得到显著提升,为了验证Al的存在对AlB2氧化的促进作用,选取当前常用的非等温法Kissinger法[16]计算不同升温速率下AlB2和无定形B粉加热氧化的活化能等动力学参数,同时采用Ozawa法验证计算结果,以避免单种方法在计算过程中产生的系统误差,两种方法的计算公式见式(2)、(3),表2列出了具体计算结果。

表2 AlB2与B在空气氛围中的动力学参数Tab.2 Kinetic parameters of B and AlB2 in air atmosphere
Kissinger法:

Ozawa法:

式中 β:升温速率,℃·min-1;Tp:DSC曲线峰值温度,℃;A:指前因子,s-1;R:理想气体常数(8.34J·(mol·k)-1);Ek和Eo:Kissinger法和Ozawa法计算得到的活化能,kJ·mol-1。
由表2可知,随着升温速率的提升,两个样品的放热峰均向高温方向移动,这是由于升温速率提高会导致热传递相对滞后[17]。两种计算方法得到的相关系数r的值都较接近1,计算结果也十分接近,表明计算结果可信度较高。可以看到,采用Kissinger法计算得到的AlB2其活化能为218.1kJ·mol-1,该值相对于无定形B降低了约100kJ·mol-1,表明Al的存在有利于AlB2的氧化与能量释放,进一步增强燃料与空气的反应性。
2.5 水蒸气氛围中的热性能研究
图4为B、Al及AlB2在水蒸气环境中的TG和DTG曲线,表3为相关热氧化性能参数。

表3 不同样品在水蒸气氛围下的热反应特性参数Tab.3 Thermal oxidation characteristic parameters of different samples in water vapor atmosphere
图4(a)可以看到,单质Al与水蒸气进行反应时,在800℃之前,反应较为微弱,约850℃后体系增重开始加快,结合DTG曲线可以看到,Al/H2O(g)反应启动后其增重速率越来越大。可以发现,较低温度下单质Al在水蒸气中几乎不发生反应,提高系统温度才能提高Al的反应效率。
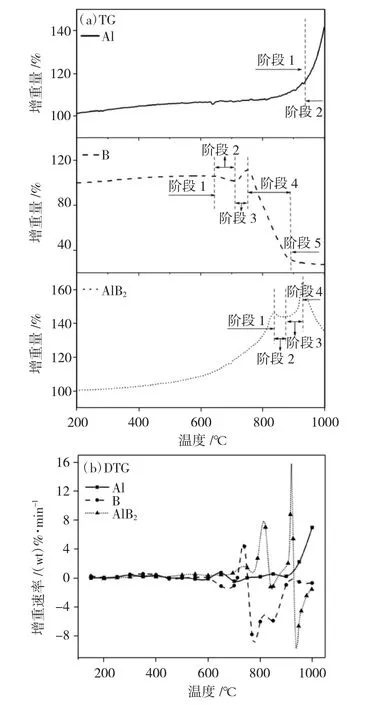
图4 B、Al、AlB2在水蒸气氛围下的TG和DTG曲线Fig.4 TG-DTG curves of Al,B and AlB2 in water vapor atmosphere
B在水蒸气中的氧化历程可以分为5个阶段:第一阶段为缓慢氧化阶段,B与水蒸气反应生成B2O3和H2;第二阶段为小幅失重阶段,TG曲线出现小幅度下降,这是由表面氧化层与水蒸气的反应引起,反应方程为B2O3(l)+H2O(g)→2HBO2(g)[18],这一反应的产物为气态物质。因此,第二阶段体系质量下降,同时这一反应也加快了表面氧化层的消耗;第三阶段为增重阶段,随着第二阶段反应的进行,表面氧化层不断消耗,更多B暴露在水蒸气环境中,该阶段可能是B与水蒸气的反应加快,有更多的B2O3生成,体系质量增加;第四阶段为大幅失重阶段,体系温度继续升高,B与水蒸气的反应加快,同时B2O3与水蒸气的反应也不断加快,该阶段体系质量不断下降可能是B与水蒸气的反应速率小于B2O3与水蒸气的反应速率引起;第五阶段为后反应阶段,体系质量趋于平稳,结合DTG曲线可以发现,这一阶段的增重速率也趋近于0,表明体系基本完成反应。
AlB2在水环境中的TG曲线可以分为4个阶段:第一阶段为大幅增重阶段,这一阶段体系增重量为46.27%,可能是体系中的Al与水蒸气反应生成Al2O3和H2引起;第二三四阶段分别为小幅失重、小幅增重、大幅失重阶段,与B在水蒸气中氧化的二三四阶段类似,因此,AlB2氧化的二三四阶段可能主要由B氧化引起。AlB2的TG曲线显示1000℃时曲线呈下降趋势,DTG曲线显示1000℃处增重速率也不为0,表明实验温度范围内体系未反应完全。
由表3可以看到,AlB2的氧化起始温度为764.2℃,相较于纯Al降低了约170℃,表明AlB2中Al与H2O(g)氧化启动更容易;AlB2/H2O(g)反应体系的最大增重与失重速率分别为16.2wt.%·min-1和10.1wt.%·min-1,且都处于B氧化阶段,对比无定形B的增重速率可以发现,AlB2中的B氧化阶段反应速率显著高于无定形B,表明AlB2中的B与H2O(g)的氧化更迅速。
3 结论
(1)相比与Al粉与无定形B粉,AlB2的实测燃烧热最高,达到了36.05kJ·g-1,能量释放效率达到了83%以上;
(2)空气氛围的加热氧化过程中,由于Al2O3和B2O3能反应生成针状结构的Al4B2O9,AlB2的反应效率相较于铝粉与无定形B得到显著提高;
(3)空气氛围下,AlB2的反应活化能相比于无定形B粉降低了约100kJ·mol-1,Al的存在提高了AlB2的反应速率。
(4)水蒸气氛围的加热氧化过程中,Al需要在较高温度下反应才能启动;无定形B的氧化可分为缓慢氧化、小幅失重、增重、大幅失重、后反应阶段;AlB2的氧化可以分为Al氧化阶段和B氧化阶段,其中Al氧化阶段起始温度低于纯Al,B氧化阶段的最大增重和失重速率皆大于无定形B。

