酶法制备燕麦多肽的工艺条件优化及分析
陈敏,何远清,马超月,丁阳阳
江苏大学(镇江 212013)
燕麦(Avena sativaL.)是禾本科、燕麦属1年生草本植物,是8种主要粮食作物之一[1]。燕麦在中国种植范围广(多集中在内蒙古、河北、山西、陕西等地)、产量高、价格低,且燕麦中蛋白质含量丰富,营养价值高,主要由清蛋白、球蛋白、醇溶蛋白和谷蛋白4种蛋白组成,其中以球蛋白含量最高,在禾谷类粮食中居首位[2]。燕麦蛋白中富含人体必需的8种氨基酸,符合FAO/WHO提出的参考蛋白模式,其中赖氨酸含量是大米和小麦的2倍以上,经常食用燕麦,可有效改善由我国不良膳食结构引起的“赖氨酸缺乏症”[3]。燕麦蛋白质净利用率高达65.7%,功效比达2.25,氨基酸分数高达68.2,生物价达64.9%,显著高于大多数其他植物蛋白,且燕麦蛋白的净利用率和功效比与牛肉相当,表明其在体内有较高的吸收利用率[4]。燕麦主要利用方式是作为主食、加工成零食或儿童辅食,而对于其潜在的更高效的生物利用价值开发较少,因此迫切需要研究燕麦更高价值利用的方法,为燕麦的进一步开发利用提供依据。
大量研究表明,蛋白质经过酶解可获得比原蛋白更好生物活性的物质,称之为生物活性肽[5]。生物活性肽(bioactive peptides)是指长度在2~30个氨基酸之间,具有特定生物活性的肽类复合物,其结构复杂多样。生物活性肽可对机体产生积极的健康效应,如免疫调节、激素调节、抗菌、抗病毒、降血压、降血脂等生物活性[6-7]。研究发现,大豆、乳清、鱼肉、鸡蛋、菜籽等蛋白水解生物活性肽可通过清除自由基、减少脂肪过氧化氢含量和螯合金属离子来发挥其抗氧化活性[8-10]。Takahashi等[11]研究表明,大米蛋白经胰蛋白酶消化后可通过促进中性粒细胞吞噬和增加超氧阴离子的产生改善人体的免疫功能。任清等[12]以燕麦麸皮为原料,经碱性蛋白酶(alcalase)酶解得到的多肽DPPH清除率可达57.39%。Ramak等[13]采用木瓜蛋白酶水解燕麦麸皮制备多肽,其产物在体外具有较好的抗氧化活性,其中ABTS自由基清除活性为866.9±10.6 μmol/L TE/g。可见,燕麦作为优质蛋白的来源,应对其进一步开发利用。因此,为获得具有较高生物活性的燕麦多肽,试验通过单因素和响应面方法优化碱性蛋白酶酶解燕麦蛋白的工艺条件,并通过测定DPPH清除率和羟自由基清除率以评价其体外抗氧化活性。
1 材料与方法
1.1 材料与试剂
燕麦粒(凌峰农副产品有限公司);碱性蛋白酶(南京诚纳化工有限公司);氢氧化钠、盐酸等试剂(均为分析纯)。
1.2 仪器与设备
METTLER TOLEDO Five Easy Plus pH计(梅特勒-托利多仪器有限公司);HH数显恒温水浴锅(金坛市科析仪器有限公司);凯特GL10 MA大容量冷冻离心机(盐城市凯特实验仪器有限公司);BioTek Eon TM微孔板分光光度计(美国Biotek Instruments);Free Zone 12plus真空冷冻干燥机(美国Labconco公司)。
1.3 方法
1.3.1 燕麦蛋白的提取
提取工艺参照李桂娟等[14]的方法并有所改动。
具体工艺:燕麦按料液比1∶9(g/mL)加水溶解→用1 mol/L NaOH调节pH 10.0→置于50 ℃水浴锅中浸提120 min→4 500 r/min离心15 min→分离得上清液→用1 mol/L HCl调节上清液pH 4.0→4 500 r/min离心15 min→得到蛋白质沉淀→真空冷冻干燥得燕麦蛋白质干粉。
1.3.2 单因素优化试验
碱性蛋白酶水解燕麦蛋白工艺流程如图1所示,每个因素研究范围见表1。
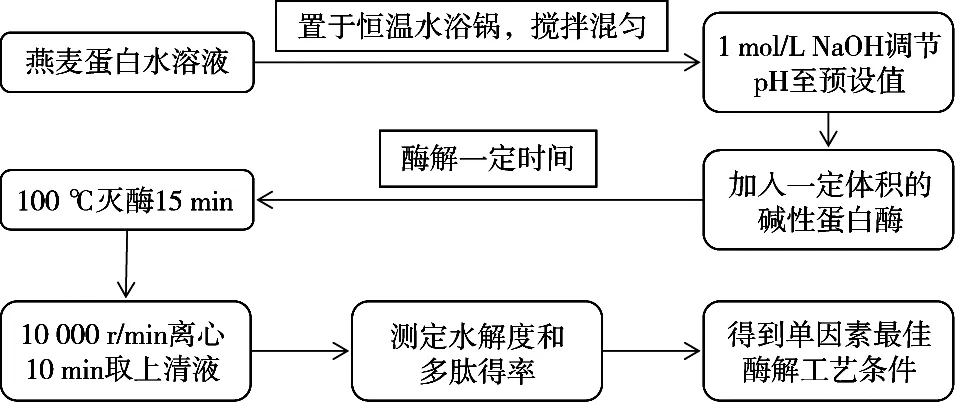
图1 碱性蛋白酶水解燕麦蛋白工艺流程

表1 每个单因素研究范围
1.3.3 响应面工艺优化试验
在单因素试验基础上,设计四因素三水平的响应面分析试验,研究各参数对研究指标的影响,得出最佳酶解条件(表2)[15]。

表2 响应面试验因素与水平
1.3.4 酶解指标测定
1.3.4.1 水解度(DH)的测定
水解度的计算根据Adler-Nissen[16]建立的pH-stat法,其计算公式见式(1)。

式中:V为NaOH溶液体积,mL;Np为NaOH溶液浓度,mol/L;Mp为酶解底物中净蛋白的质量,g;α为α-NH2在蛋白底物中的平均解离度,Alcalase对蛋白平均解离度为0.885;htot为单位质量蛋白中肽键的总量,mmol/g,对于某一特定蛋白质htot为固定值,经查阅文献得到燕麦蛋白htot=7.31 mmol/g[17]。
1.3.4.2 多肽得率的测定
将燕麦蛋白水解液稀释数倍后,等比例(1∶1)添加15%的三氯乙酸(15 g三氯乙酸+85 mL水),置于30 ℃时水浴反应30 min,按5 000 r/min离心10 min后去沉淀以除去大分子蛋白,收集上清液。按照福林酚法测水解液中的多肽浓度,多肽得率按式(2)计算[18]。

1.3.4.3 燕麦多肽DPPH清除率的测定
用无水乙醇配制0.1 mmol/L的DPPH溶液,在棕色瓶中低温保存备用,按照表3进行试验[19]。
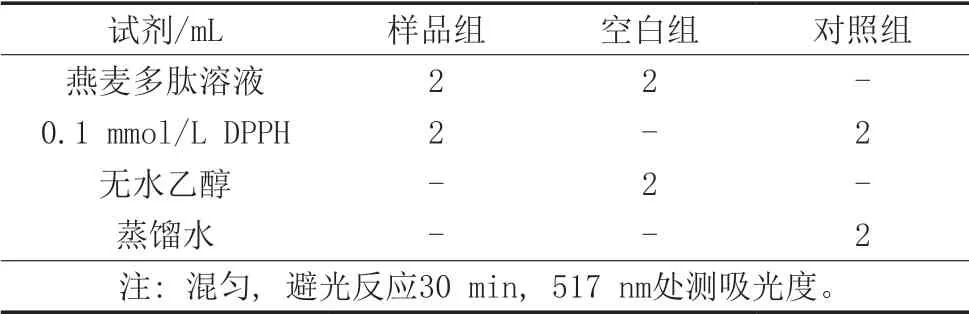
表3 燕麦多肽DPPH清除率的测定步骤 单位:mL
按式(3)计算样品DPPH清除率。

1.3.4.4 燕麦多肽羟自由基清除率的测定
试验步骤参照原洪[20]的方法并有所改动。如表4所示,设3组平行试验。

表4 燕麦多肽羟自由基清除率的测定步骤 单位:mL
按式(4)计算羟自由基清除率。
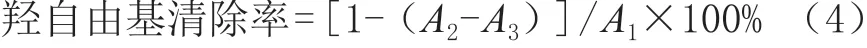
1.3.5 数据处理
采用Origin pro 8和Excel进行数据处理并作图。使用SPSS 17.0通过单因素方差分析(ANOVA)和Duncan方法进行统计结果的分析。使用Design Expert 8.0.6进行响应面分析。
2 结果与分析
2.1 单因素试验结果与分析
2.1.1 加酶量对酶解效果的影响
如图2所示,在0~2.4 mL/L的酶浓度范围内,燕麦蛋白水解度随酶浓度增大而逐渐升高,从7.20%增加到9.14%。此外,在0~1.6 mL/L的酶浓度范围内,多肽得率呈上升趋势,在添加量1.6 mL/L时达到最高17.49%,之后呈缓慢下降趋势。这主要由于当溶液中酶的浓度较低时,加酶量增加,酶与底物最大限度结合,促进酶解反应的进行。但当溶液中酶的浓度达到饱和后,底物的水解度不断增大,溶液中肽键减少,从而导致多肽得率下降,这与刘媛等[21]在优化杏仁粕蛋白酶解过程中的结果一致。因此,试验选择1.6 mL/L作为最适加酶量。
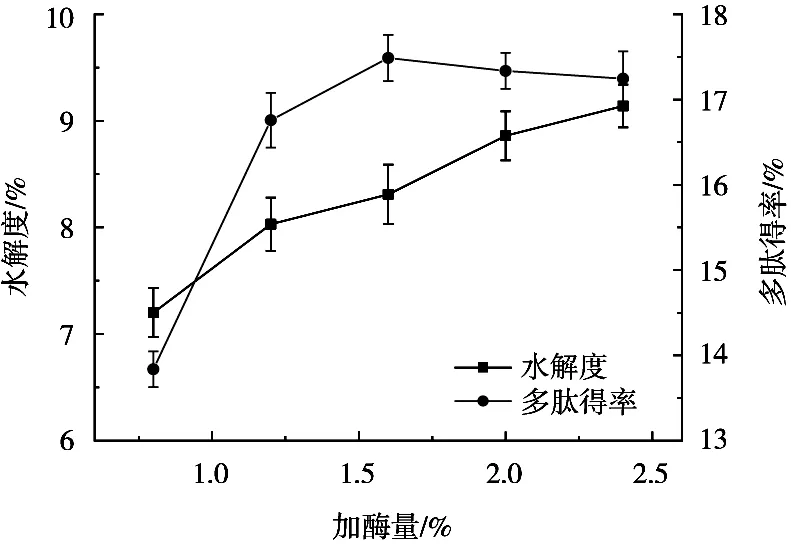
图2 加酶量对酶解效果的影响
2.1.2 温度对酶解效果的影响
研究表明,温度对酶的活性能够产生较大的影响。当试验温度低于其发挥作用的温度时,酶的活性会受到一定抑制。温度高于其发挥作用的温度时,酶分子的一级结构或空间结构会发生变化,酶分子会变性或解聚,从而使酶的催化作用降低[22]。如图3所示,在40~60 ℃范围内,随着温度的增加,水解度呈先升高后下降趋势,在50 ℃时达到最高7.78%。此外,随着温度逐渐升高,多肽得率总体呈增加趋势,在55 ℃后增速减慢。由此可见,温度对燕麦蛋白的酶解效果影响较大。综合两项指标,试验选择55 ℃作为燕麦蛋白碱性蛋白酶水解的最适酶解温度。
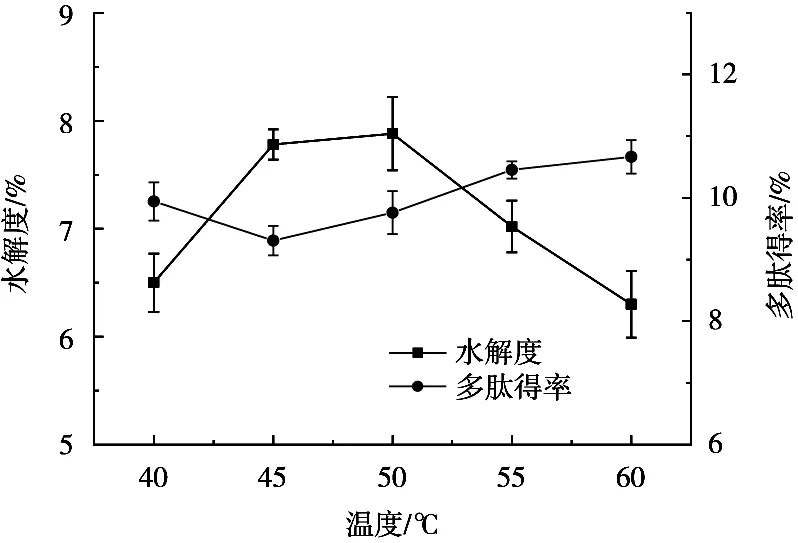
图3 温度对酶解效果的影响
2.1.3 pH对酶解效果的影响
研究表明,pH能够影响酶活性基团的分子构象,以及与底物的结合或解离状态,从而影响酶解效果[23]。如图4所示,在pH 8.0~10范围内,水解度和多肽得率变化趋势基本一致,均随pH的不断升高呈现先上升后下降趋势,在pH 9.5时,水解度和多肽得率均达到最高值,分别为8.37%和13.49%。表明水解度和多肽得率受pH的影响较为一致,可见,最适pH为9.5。
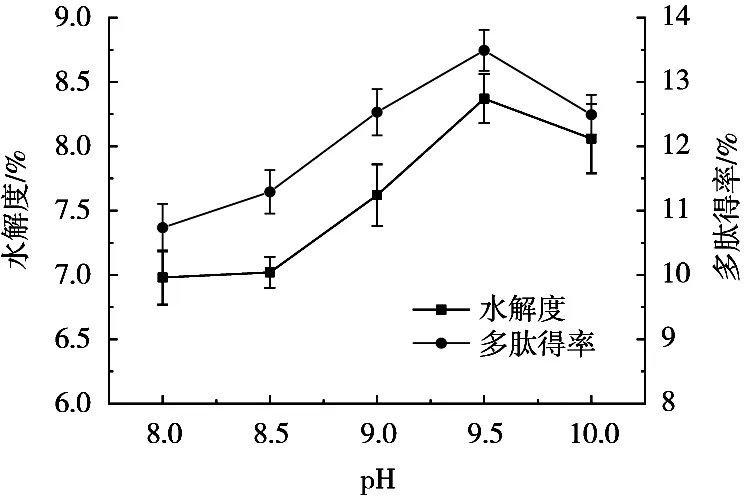
图4 pH对酶解效果的影响
2.1.4 底物浓度对酶解效果的影响
底物在一定浓度范围内影响着酶解反应的进行,当底物浓度低于酶浓度时,酶与底物充分结合,促进酶解反应的进行。而底物浓度过高时,溶液黏稠度过大,抑制酶的扩散与结合,导致酶解速率降低。如图5所示,底物浓度在2%~10%范围内,水解度和多肽得率均随底物浓度的升高呈先升高后降低趋势,不同的是水解度在8%时达到最高值12.78%,而多肽得率在6%时达到最高值20.63%,之后开始缓慢下降。综合2项指标,选择8%为最佳酶解底物浓度。

图5 底物浓度对酶解效果的影响
2.1.5 时间对酶解效果的影响
如图6所示,0~90 min内,水解度的增加速率较大,90 min时达到11.03%,之后增速减慢。另外,在此时间段内,多肽得率随酶解时间的增加呈先增加后下降趋势,在120 min时达到最大值20.27%。这可能是由于:在酶解初始阶段,可断裂的肽键多,且酶活较高,使得酶解速度快;随着酶解时间不断延长,溶液中可断裂的肽键减少,酶的活性有所下降,且反应体系中短链肽可能重新聚合生成新的物质,与原本的底物产生竞争性抑制作用,酶与新物质结合反应从而导致酶解速度缓慢[24]。因此,试验选择120 min为最佳酶解时间。
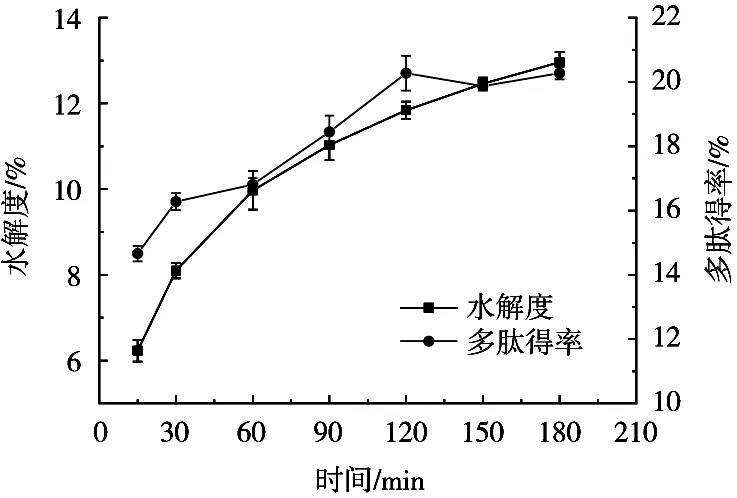
图6 时间对酶解效果的影响
2.2 响应面试验结果与分析
2.2.1 响应面模型建立
在单因素结果的基础上,按照表2进行响应面试验,结果见表5。对其进行多元回归拟合,获得二次多元回归方程:Y1=1 226.725 8+13.416 2X1+0.055 837X2+ 202.046 07X3+8.017 60X4+2.958 33×10-3X1X2-1.22X1X3+0.015 5X1X4-0.011 833X2X3-4.233 33× 10-3X2X4-0.022X3X4-0.191 94X12-8.683 33×10-3X22-10.181X32-0.070 660X42。

表5 响应面试验设计及结果
2.2.2 响应面数据分析
回归分析结果如表6所示,模型极显著(P< 0.01),失拟项不显著(P=0.066 2>0.05),表明方程与预测值之间有较好的拟合度。模型总决定系数0.975 8,表明该模型能解释97.58%的响应值变化。另外,结果显示X2、X3、X4对燕麦蛋白的水解度具有极显著的影响,X1X3、X2X4存在显著的交互作用,其余不显著。根据F值和P值,各因素对燕麦蛋白水解度的影响程度为X3(pH)>X4(温度)>X2(时间)>X1(底物浓度)。此外,通过运用软件得到的水解度响应曲面图和等高线图(图7~图12)可以更清晰地反映各响应值对结果的影响。
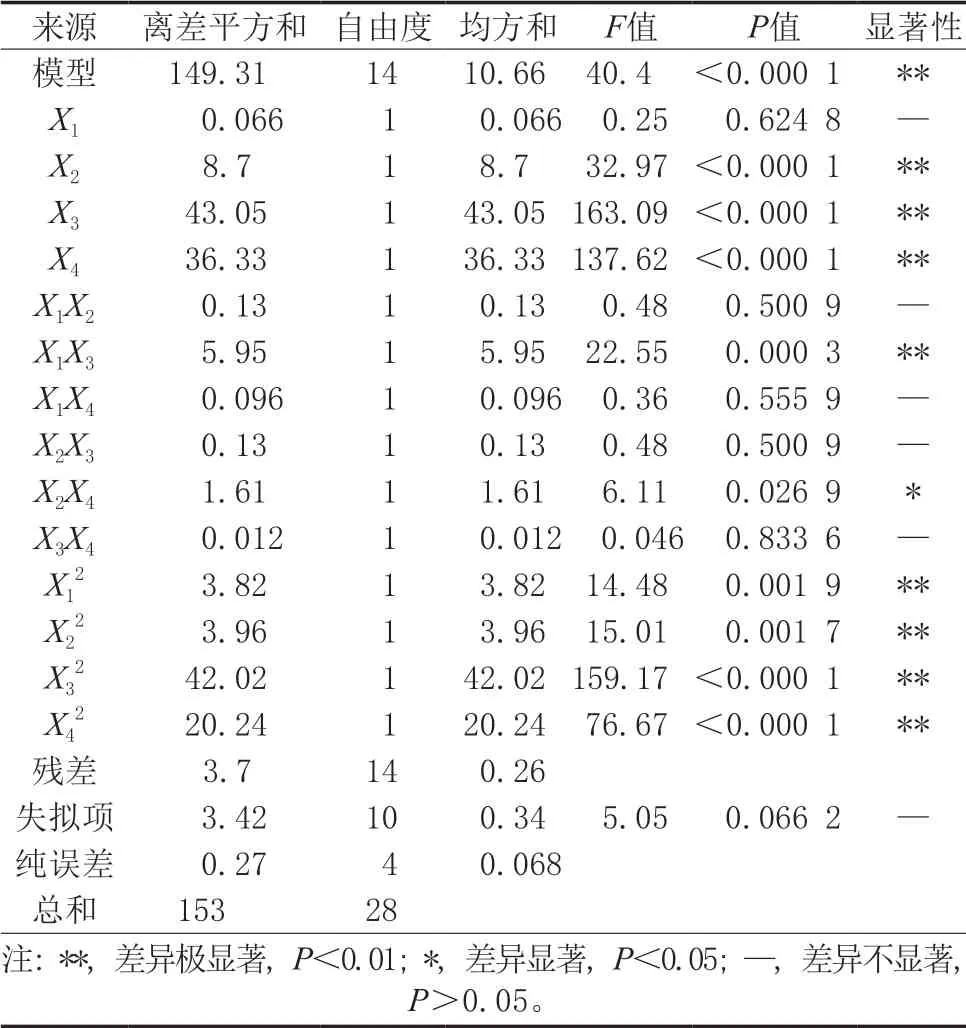
表6 回归模型方差分析(感官评分)
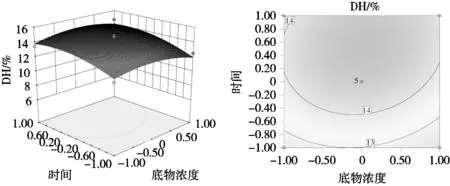
图7 底物浓度和时间对水解度影响的响应曲面与等高线图

图8 底物浓度和pH对水解度影响的响应曲面与等高线图

图9 底物浓度和温度对水解度影响的响应曲面与等高线图

图10 时间和pH对水解度影响的响应曲面与等高线图

图11 时间和温度对水解度影响的响应曲面与等高线图
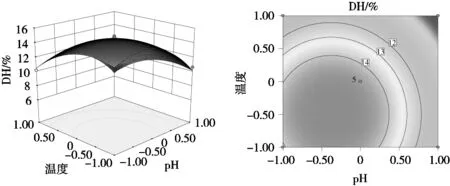
图12 pH和温度对水解度影响的响应曲面与等高线图
2.2.3 最优条件的验证
通过软件Design-Expert求解方程,得到优化alcalase 2.4 L FG水解燕麦蛋白的条件:底物浓度10%,水解时间149.41 min,pH 9.18,水解温度51.92 ℃。在此条件下,燕麦蛋白的理论水解度为15.75%。为验证该条件的准确性,在此条件下重复试验3次,燕麦蛋白的平均水解度为14.86%,与理论计算值误差仅为0.89%。
2.3 燕麦多肽体外抗氧化指标的测定及分析
2.3.1 DPPH清除率
1, 1-二苯基-2-三硝基苯肼(1, 1-diphenyl-2- picrylhydrazyl radical,DPPH)是一种很稳定的氮中心的自由基,DPPH的单电子可被自由基清除剂捕捉而颜色变浅,导致其在510 nm处的吸光度下降,通常被用来评价样品的自由基清除能力和抗氧化能力[25]。由图13可知,在3.125~50 mg/mL浓度范围内,燕麦多肽的DPPH自由基清除率随浓度升高呈上升趋势。经计算,燕麦多肽清除DPPH的IC50值为9.112 mg/mL,在50 mg/mL时,DPPH清除率可达90.8%。马洪鑫[26]优化得到的藜麦蛋白抗氧化肽DPPH自由基清除率为74.82%±0.04%。同政泉等[27]制备的猴头菇多肽DPPH的清除率为51.17%,表明经过响应面优化工艺制得的燕麦多肽具有较好的DPPH清除能力。
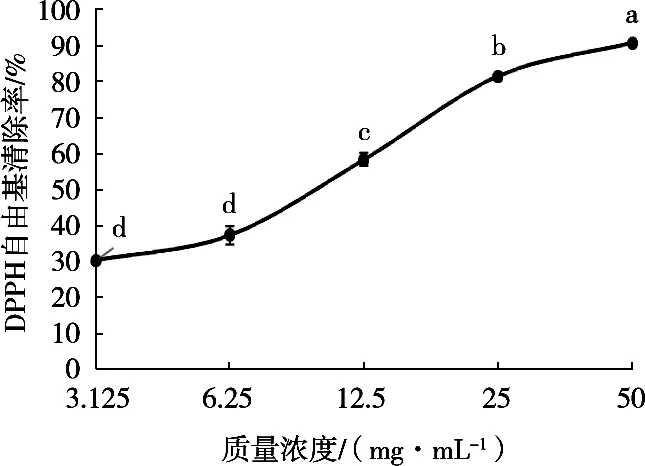
图13 不同浓度燕麦多肽DPPH清除率
2.3.2 羟自由基清除率
羟自由基是体内最活泼的活性氧,其可破坏蛋白质、DNA、脂肪等生物大分子的结构,引起衰老、癌症和其他相关疾病,因此清除羟自由基是预防各种疾病发生的最有效的防御机制之一[28]。由图14可知,在3.125~50 mg/mL浓度范围内,燕麦多肽的羟自由基清除率随浓度升高呈先上升后平稳的趋势,在12.5 mg/mL时,羟自由基清除率接近100%。经计算,燕麦多肽清除羟自由基的IC50值为3.062 mg/mL。杨珊珊等[29]制备的蛋清多肽浓度为5 mg/mL时,羟自由基清除率为68.5%。张浩玉等[30]制备的绿豆多肽羟自由基消除能力在25 mg/mL时达到最大值61.3%,表明按此工艺制得的燕麦多肽具有较好的羟自由基清除能力。
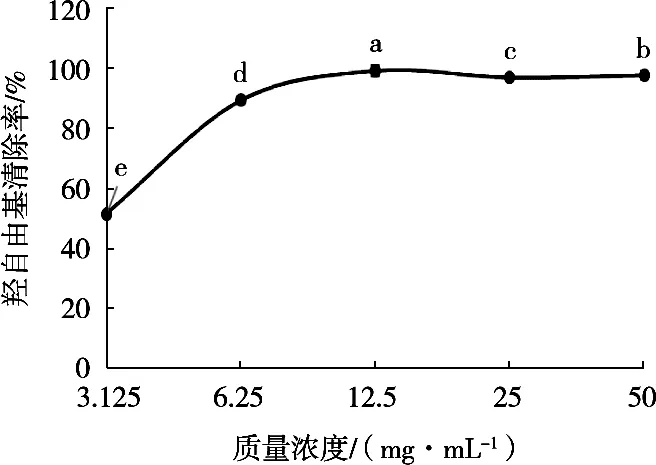
图14 不同浓度燕麦多肽羟自由基清除率
3 结论
试验以燕麦蛋白为酶解底物,采用碱性蛋白酶进行酶解。在单因素试验结果基础上进行四因素三水平的响应面分析试验,得到碱性蛋白酶的最佳酶解条件:碱性蛋白酶alcalase 2.4 L FG使用量1.6 mL/L,底物浓度10%,酶解时间150 min,温度保持在52 ℃,pH调整并保持在9.2。此条件下燕麦蛋白的水解度达到14.86%,多肽得率为19.02%。
所得燕麦多肽DPPH清除率达90.8%,羟自由基清除率达99.2%,表明由此工艺制得的燕麦多肽具有较高的体外抗氧化活性,具有较好的开发应用前景。但试验未对燕麦多肽进行进一步分离纯化和进行体内的抗氧化效果验证,在后续试验中可将已知有活性的燕麦多肽片段做进一步的分离纯化,并通过动物试验找到抗氧化活性最高的肽段,将具有更高的应用价值。

