枸杞多糖对妊娠期暴露全氟辛酸致子代雌鼠卵巢损伤的保护作用
宫英阑,温 冉,史孝伟,袁焕青,张 妍,包佳鹭,王晓丹*
(1.河北农业大学 中兽医学院,河北 保定 071000;2.河北象大合众生物科技有限公司,河北 正定 050800)
全氟辛酸(perfluorooctanoic acid,PFOA)分子式为C8HO2F15,又称十五氟辛酸。由于其具有优良的热稳定性、化学性质稳定、疏水和疏油的特性,被广泛应用于生活中常见的物质中,如服装、化妆品、厨具、装修材料等[1]。PFOA的大量使用使环境介质、土壤,甚至在偏远的极地都能检测到它的存在[2]。使动物通过身边的大气颗粒、水源、土壤等途径接触到PFOA,长时间在体内蓄积产生生物毒性。前期研究表明,妊娠期PFOA暴露会引起流产和胎儿发育缓慢、孕鼠体质量下降、仔鼠存活率降低、子代雄鼠睾丸组织受损、精子数量减少、血清睾酮水平降低等[3-4]。
枸杞是传统的滋补中药,具有护肝明目,益精补肾等功效。枸杞多糖(Lyciumbarbarumpolysaccharids,LBP)是从中药枸杞中提取出,是枸杞的主要活性成分。现代研究表明LBP具有抗氧化、抗肿瘤,降糖降脂、调节免疫力以及对生殖系统具有保护作用[5]。有研究发现,LBP对大鼠卵巢系统有明显的保护作用,可恢复老年大鼠血清雌激素和孕酮水平[6]。LIU等[7]通过建立卵巢损伤模型,同时给小鼠灌胃LBP发现显著提高了小鼠卵巢中原始卵泡和初级卵泡、次级卵泡和窦卵泡的比例,降低了闭锁卵泡的比例。
本试验建立妊娠期暴露PFOA致子代雌鼠卵巢损伤模型,并使用不同浓度的LBP进行缓解。通过对青春期子代雌鼠血清中激素水平以及卵巢组织激素受体表达、氧化指标以及对卵母细胞减数分裂相关基因检测,探讨LBP对生殖功能的保护作用机制。
1 材料与方法
1.1 试验试剂PFOA(纯度≥98%,Sigma公司);LBP(上海源叶生物科技公司);40%甲醛、黄体生成素(LH)、促卵泡素(FSH)、雌二醇(E2)、促性腺激素释放激素(GnRH)、雌激素受体α(ERα)、雌激素受体(ERβ)、活性氧(ROS)ELISA试剂盒(上海酶联生物科技有限公司);超氧化物歧化酶(SOD)、丙二醛(MDA)、总抗氧化能力(T-AOC)、蛋白定量(TP)、过氧化氢酶(CAT)测定试剂盒(南京建成生物工程研究所);总RNA提取试剂盒(上海普洛麦格生物产品有限公司);引物由大连宝生生物设计并合成,具体序列如表1。

表1 荧光定量PCR引物序列
1.2 实验动物饲养与给药8周龄雌性SPF级昆明小鼠60只和8周龄雄性SPF级昆明小鼠30只由北京斯贝福生物科技有限公司提供,许可证号为SCXK(京)2019-0010。动物自由采食和饮水饲养于河北农业大学动物医学院动物房,保持室温(23±1)℃,12 h光照,12 h黑暗。适应1周后,傍晚雌鼠与雄鼠2∶1合笼,次日早晨检查雌鼠阴栓,有阴栓的定为孕0 d。将60只怀孕的小鼠随机分为6组,分别为空白对照组(K组)、PFOA组(P组)、LBP对照组(L组)、低剂量治疗组(D组)、中剂量治疗组(Z组)、高剂量治疗组(G组),每组10只。妊娠1~17 d 口服灌胃给药,每只鼠0.2 mL,每天称小鼠体质量按照体质量给药,具体给药方式如表2。哺乳期不给药,子代小鼠21日龄时断奶,将子代雌鼠与雄鼠分开,正常饲喂到35 d,眼球采血,颈椎脱臼处死,无菌收集卵巢。
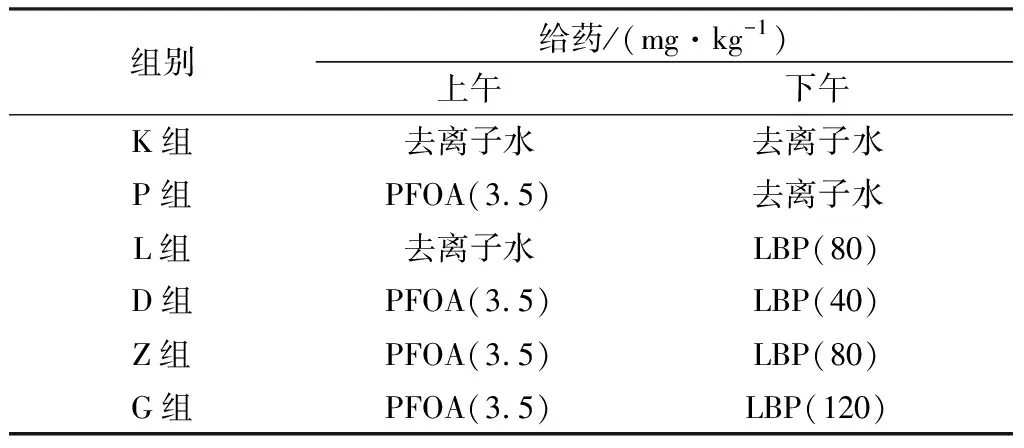
表2 LBP对子代雌鼠PFOA毒性缓解作用的给药方式
1.3 子代雌鼠体质量及卵巢指数记录各组雌鼠出生35 d时的体质量及卵巢质量,计算分析雌鼠35 d 时的卵巢指数,卵巢指数(%)=卵巢质量(g)/体质量(g)×100%。
1.4 血清中LH、FSH、E2、GnRH含量测定小鼠眼球采血,室温凝固10~20 min,2 000~3 000 r/min离心20 min,收集上清,严格按照说明书进行操作,检测血清中LH、FSH、E2、GnRH的含量。
1.5 卵巢组织中ERα、ERβ水平卵巢与PBS(PH 7.2~7.4)的比例为1∶9,匀浆器匀浆,3 000 r/min离心20 min,仔细收集上清,按照检测试剂盒说明书操作,检测组织中ERα、ERβ水平。
1.6 组织SOD、MDA、CAT、T-AOC、ROS水平的测定按照小鼠卵巢与生理盐水的比例为1∶9,制作10%的卵巢组织匀浆,用蛋白定量测试盒检测并计算匀浆蛋白浓度。严格按照说明书操作,检测各组卵巢组织中SOD、MDA、CAT、T-AOC、ROS的水平。
1.7 荧光定量PCR对卵母细胞减数分裂通路关键基因表达的检测称取20 mg卵巢组织,加入500 μL 的裂解液,按照总RNA提取试剂盒说明书操作提取卵巢组织中的总RNA提取。将总RNA反转录为cDNA待测。具体反转录体系如表3。以cDNA为模板,β-actin为内参基因使用LightCycler®96全自动荧光定量PCR仪,采用2-step PCR反应程序:预变性95℃ 30 s;95℃ 5 s,60℃ 30 s,40个循环。按照公式2-△△Ct值计算各基因的相对表达量。

表3 反转录体系及方法 μL

2 结果
2.1 LBP对子代雌鼠体质量、卵巢质量及卵巢指数的影响如表4所示,与空白对照组相比,PFOA组子代雌鼠体质量极显著降低(P<0.01),卵巢质量显著升高(P<0.05),卵巢指数极显著升高(P<0.01)。与PFOA组相比,高剂量治疗组子代雌鼠体质量极显著升高(P<0.01),中剂量治疗组子代雌鼠卵巢质量和卵巢指数均显著降低(P<0.05)。高剂量治疗组卵巢质量和卵巢指数虽然无统计学差异,但与PFOA组相比有降低的趋势。另外,LBP对照组与空白组各指标无显著性差异。
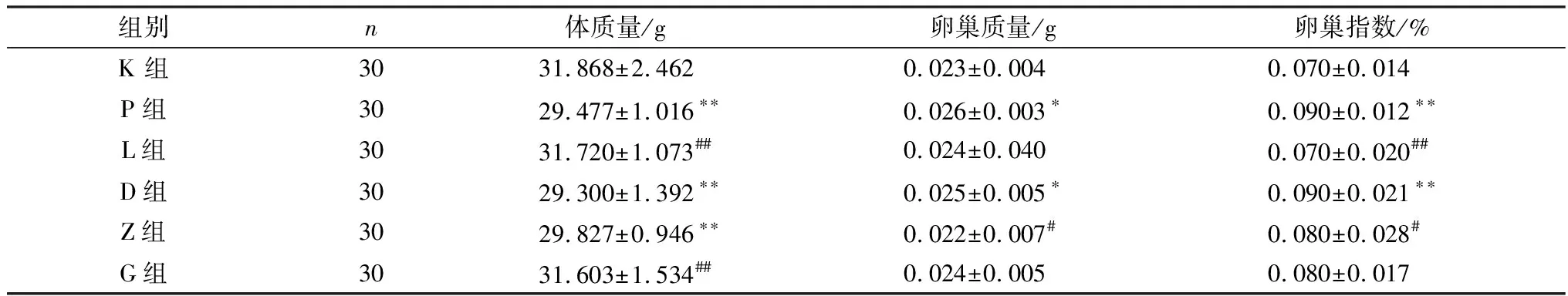
表4 LBP对子代雌鼠体质量、卵巢质量及卵巢指数的影响
2.2 LBP对子代雌鼠血清中LH、FSH、E2、GnRH含量的影响如图1所示,与空白对照组相比,3.5 mg/kg PFOA可以极显著降低子代雌鼠血清中LH、FSH、GnRH的含量(P<0.01),极显著升高E2含量(P<0.01)。与PFOA组相比,中剂量治疗组和高剂量治疗组可以极显著升高LH的含量(P<0.01),高剂量组可以极显著升高FSH的含量(P<0.01),其中高剂量的LBP对于恢复LH水平效果更好。另外低剂量治疗组、中剂量组极显著升高GnRH的含量(P<0.01),极显著降低E2含量(P<0.01),使GnRH与E2的含量与空白组无显著性差异。
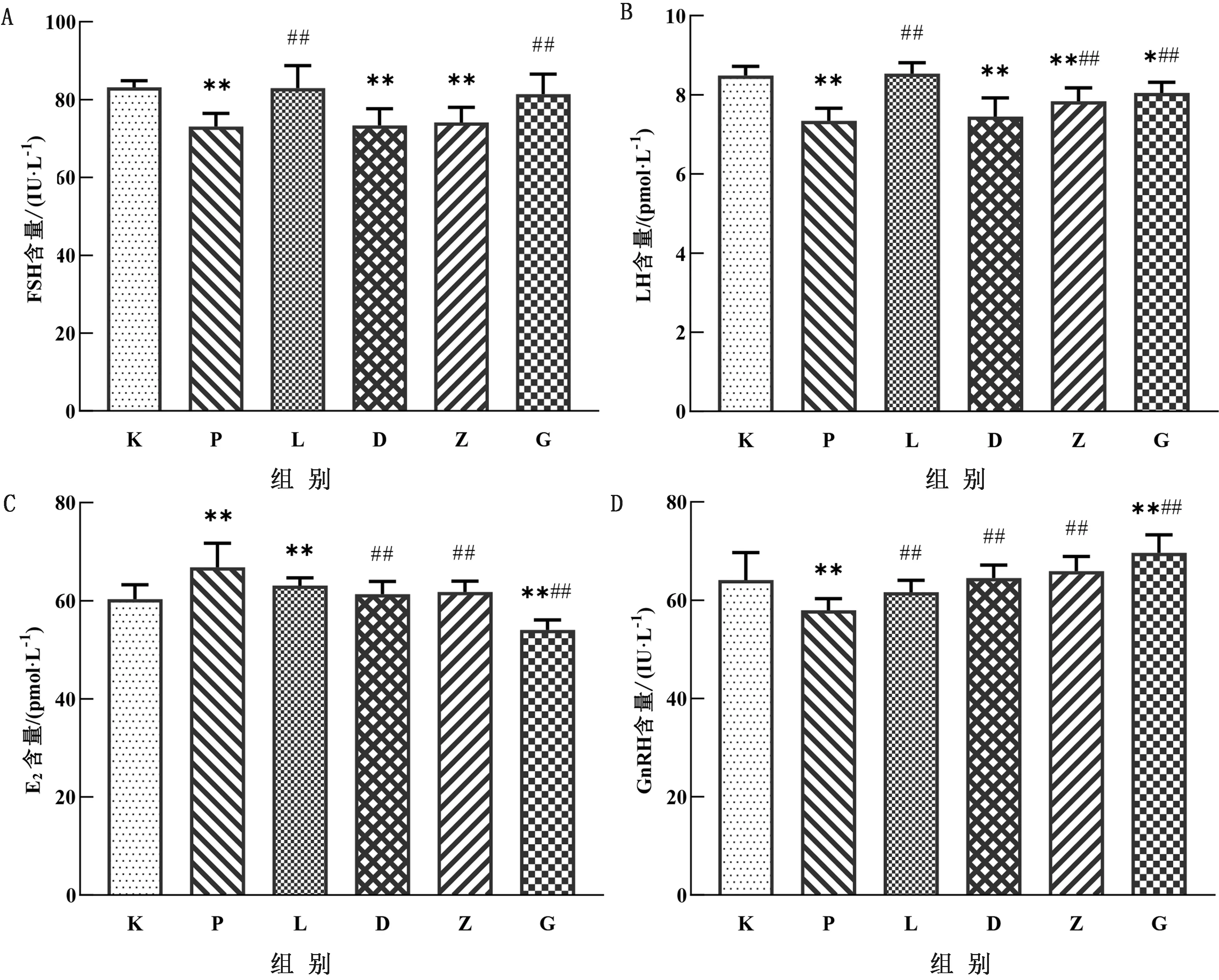
图1 LBP对子代雌鼠血清中FSH(A)、LH(B)、E2(C)、GnRH(D)含量的影响
2.3 LBP对子代雌鼠卵巢组织中ERα、ERβ水平的影响如图2所示,与空白组相比,PFOA组极显著升高了子代雌鼠卵巢组织中ERα、ERβ水平(P<0.01),高剂量治疗组极显著降低了ERα、ERβ水平(P<0.01)。LBP对照组与空白对照组无明显差异。
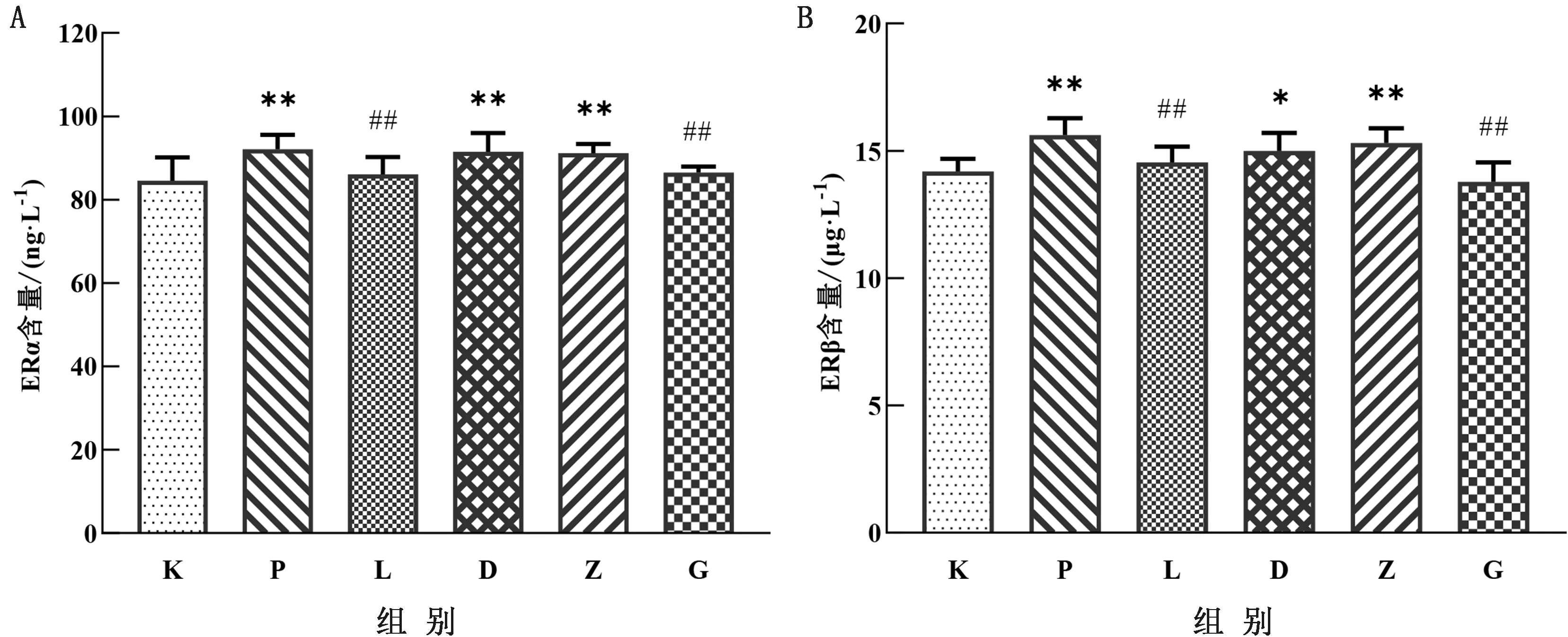
图2 LBP对子代雌鼠卵巢组织中ERα(A)、ERβ(B)水平的影响
2.4 LBP对子代雌鼠卵巢组织SOD、MDA、CAT、T-AOC、ROS水平的影响如图3所示,与空白组相比,3.5 mg/kg PFOA可以极显著降低卵巢组织中SOD、CAT、T-AOC水平(P<0.01),极显著升高MDA、ROS水平(P<0.01)。与PFOA组相比,低剂量治疗组与中剂量治疗组可以显著升高卵巢组织中SOD活力(P<0.05),高剂量治疗组可以极显著升高卵巢组织中SOD活力(P<0.01)。低剂量治疗组、中剂量治疗组、高剂量治疗组均极显著升高了卵巢组织中CAT含量,降低MDA的含量(P<0.01)。中剂量治疗组和高剂量治疗组极显著升高卵巢组织的总抗氧化能力(P<0.01)。中剂量治疗组可以显著降低卵巢组织中ROS含量(P<0.05),高剂量治疗组可以极显著降低卵巢组织中ROS的含量(P<0.01)。对于多糖对照组来说,均与空白组无显著性差异。
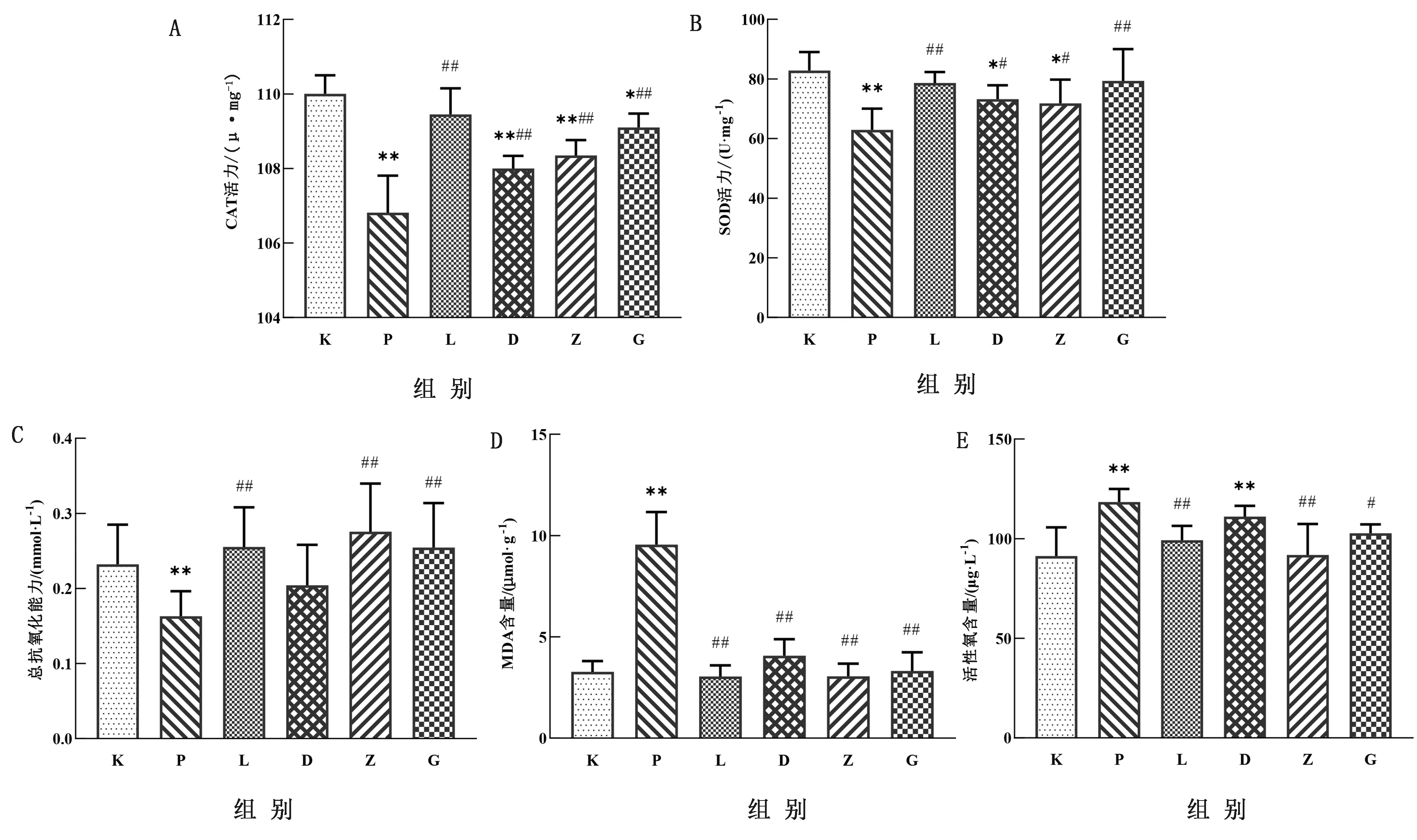
图3 LBP对子代雌鼠卵巢组织CAT(A)、SOD(B)、T-AOC(C)、MDA(D)、ROS(E)水平的影响
2.5 LBP对子代雌鼠卵巢组织中卵母细胞减数分裂通路关键基因的影响从图4可以看出,与空白对照组相比,3.5 mg/kg的PFOA可以极显著降低卵巢组织中卵母细胞减数分裂关键基因smc1α、smc1β、smc3、rec8 mRNA的表达(P<0.01),低剂量治疗组可以显著升高smc3 mRNA的表达(P<0.05),中剂量和高剂量治疗组可以极显著升高smc1α、smc1β、smc3、rec8 mRNA的表达(P<0.01)。
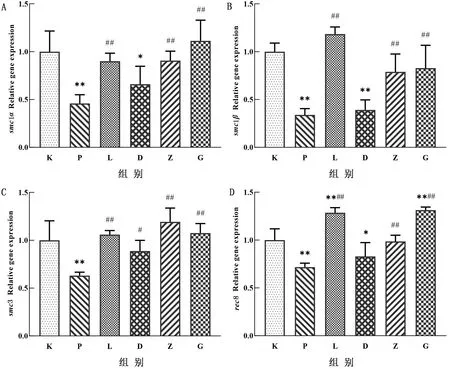
图4 LBP对子代雌鼠卵巢组织smc1α(A)、smc1β(B)、smc3(C)、rec8(D)mRNA表达的影响
3 讨论
妊娠期是胚胎和胎儿在母体内发育成熟时期,而妊娠期卵子发生的卵母细胞第1次减数分裂以及原始卵泡的形成对雌性动物以后的生殖能力起着决定性作用[8],因此本试验选择在妊娠期给药,探讨3.5 mg/kg PFOA对子代35日龄雌性小鼠生殖功能的损伤以及不同剂量LBP对生殖系统的保护作用。
结果显示,妊娠期暴露3.5 mg/kg PFOA使出生后35 d的子代雌鼠体质量极显著降低(P<0.01),卵巢质量显著升高(P<0.05),因此卵巢指数偏低(P<0.01)。这与VAN等[9]推断PFOA使子代雌鼠体质量降低,子代雄鼠体质量升高一致。而120 mg/kg LBP使小鼠的体质量恢复至与空白组无显著性差异。40,80,120 mg/kg LBP均可对小鼠卵巢质量的恢复起作用,而80 mg/kg可显著缓解PFOA致子代雌鼠卵巢质量降低的现象(P<0.05)。
卵巢的内分泌功能受到下丘脑-腺垂体-卵巢轴的调控。下丘脑分泌GnRH经垂体门脉系统直接作用于腺垂体,促进腺垂体分泌FSH和LH[10]。FSH可刺激卵泡细胞增殖和促进卵泡的生长发育,LH可促进排卵和黄体生成。二者共同作用于卵巢,使卵巢分泌E2和孕酮。本试验结果显示,PFOA可使小鼠血清中GnRH、LH、FSH的含量极显著降低(P<0.01),E2含量极显著升高(P<0.01)。可能与PFOA是一种环境内分泌干扰物,具有拟雌激素特性[11],可以与雌激素受体竞争性结合从而使体内游离的雌激素增加。大量的雌激素负反馈作用于下丘脑-垂体,抑制其分泌GnRH,抑制腺垂体分泌FSH和LH,从而影响卵泡的正常发育和成熟。40和80 mg/kg LBP均可使小鼠血清中E2、GnRH恢复至与空白组无显著性差异,80和120 mg/kg LBP可以升高小鼠血清中LH含量,120 mg/kg LBP可以升高小鼠血清中FSH水平。这表明LBP对妊娠期暴露PFOA所致子代雌鼠生殖内分泌失调具有缓解作用。
经典的雌激素受体位于细胞核,包括ERα和ERβ2种亚型,其蛋白质在翻译后会暂时性的在包浆出现,因此可在细胞质检测到[12]。ERα和ERβ与雌激素的亲和力存在差异,一般情况下ERα与雌激素的亲和力较强,只有雌激素水平过高时,ERβ才被激活[13]。PFOA可能作为雌激素化合物激活雌激素受体使子代雌鼠卵巢组织中ERα和ERβ的表达增多。有文献报道,通过体内试验证明PFOA对雌性大鼠体内的ERα表达有促进作用[11],与本试验结果一致。而120 mg/kg LBP可以使卵巢中激素受体的表达恢复正常水平。
目前有很多研究表明PFOA可以通过氧化应激导致雄性动物生殖损伤,但很少有人研究PFOA是否诱导卵巢氧化应激。而LBP是天然的抗氧化剂,可以缓解PFOA致小鼠肝脏[14]、睾丸[15]发生氧化应激导致的损伤。当机体受到氧化应激原的刺激后会产生大量的自由基,过量自由基通过攻击生物膜引发脂质过氧化物作用,从而产生脂质过氧化物,如MDA。MDA含量的多少可以直接反映出细胞遭受氧化损伤的程度。而SOD、CAT可以清除体内产生的自由基[16]。因此本研究检测了卵巢组织匀浆中的ROS、MDA、SOD、CAT以及总抗氧化能力T-AOC水平。发现母鼠妊娠期暴露3.5 mg/kg的PFOA后子代小鼠卵巢中SOD、CAT、T-AOC水平显著降低,同时MDA、ROS水平显著升高。LBP用治疗后发现这些指标发生不同程度改善,且80,120 mg/kg的治疗效果较好。
妊娠期暴露雌激素以及具有拟雌激素特性的环境污染物可以通过激活雌激素受体从而影响同源重组,并下调一系列减数分裂关键基因的表达[17-18]。rec8是卵母细胞减数分裂特异性基因,它可以影响卵母细胞的增殖、凋亡,正常情况下小鼠体内rec8在睾丸和卵巢中表达量高,而在其他组织中不表达或者表达量很低[19]。smc1、smc3是减数分裂内聚蛋白复合物的核心亚基,是染色体结构维持蛋白,smc1又包括smc1α和smc1β。缺乏smc1β的小鼠不能完成减数分裂,雌鼠与雄鼠均表现为不育,说明smc1β是减数分裂所必须的[20]。中药制剂和颜坤泰胶囊具有缓解女性卵巢功能的功效,能增加老龄小鼠卵母细胞的卵泡数量,抑制卵母细胞凋亡,并有提高减数分裂特异性内聚亚基rec8和smc1β的趋势[21]。有研究发现,将分离得到的14.5 d小鼠胚胎卵巢置于含DBP的培养基中培养3 d,发现胎鼠卵巢中的rec8、smc1β、smc3的mRNA表达水平显著降低[22]。因此检测PFOA是否可以影响减数分裂通路关键基因在转录水平的表达,结果发现PFOA显著下调卵巢组织中rec8、smc1α、smc1β、smc3 mRNA的表达。80,120 mg/kg的LBP可以提高rec8、smc1α、smc1β、smc3 mRNA 水平,说明其对PFOA造成的生殖损伤有缓解作用。
PFOA可以通过减少SOD、CAT、T-AOC的水平,增加ROS、MDA含量导致子代雌鼠卵巢组织的损伤。还可以降低血清中的FSH、LH、GnRH含量,升高E2水平,提高卵巢组织中ERα、ERβ含量,下调卵巢组织中卵母细胞减数分裂通路关键基因的表达,而LBP可以缓解PFOA造成的子代雌鼠卵巢损伤。

