1株同时携带tet(X6)和tet(X3)的禽源印地不动杆菌比较基因组学分析
李垠树,赵 冰,孙华润,何 坤,许 慧,梁玉蕾,胡功政,苑 丽
(河南农业大学 动物医学院,河南 郑州 450046)
不动杆菌属(Acinetobacter)是条件致病菌,当机体抵抗力降低时易引起机体感染,是引起医院感染和暴发的重要致病菌之一,可引起呼吸道感染、脑膜炎、泌尿生殖道感染、皮肤及软组织感染等,重症者可导致死亡,多见于老年人和婴幼儿[1-2]。主要包括鲍曼不动杆菌、醋酸钙不动杆菌、洛菲不动杆菌、溶血不动杆菌、琼氏不动杆菌、约翰逊不动杆菌和抗辐射不动杆菌等。2012年,MALHOTRA等[3]首次从印度一个垃圾场分离鉴定出印地不动杆菌(Acinetobacterindicus),尽管其属于非鲍曼不动杆菌属,但是也是重要的条件致病菌。2016年,杜慧竟等[4]在核对中国医学细菌保藏管理中心库藏的1株卡他布朗汉姆菌时,发现该菌株实为印地不动杆菌,表明2012年前我国已有印地不动杆菌的存在。
四环素类抗生素被广泛应用于农业植物、水产养殖和动物生产的细菌感染治疗[5],包括土霉素、四环素、多西环素等,近年来由于细菌对本类药物的耐药日趋严重,临床应用受到一定的限制。替加环素是一种新的四环素类药物,于2005年6月被美国食品和药物管理局(FDA)批准用于复杂的腹腔内感染、复杂的皮肤及软组织感染(cSSSLs),2008年批准用于治疗社区获得性肺炎,也被视作治疗碳青霉烯类多重耐药革兰阴性菌严重感染的最后药物之一[6-7]。1984年,GUINEY等[8]在专性厌氧脆弱拟杆菌携带的质粒上发现新型四环素耐药基因tet(X),可以在有氧环境培养的大肠埃希菌中表达抗性,但是在原宿主中不表达。伴随着耐药基因tet(X)的出现,说明革兰阴性菌的最后一道防线已被攻破。与外排泵基因和核糖体保护基因的作用机理不同,tet(X)编码合成的氧化还原酶可通过化学修饰改变四环素类的分子结构,从而使其失活[9],因此弄清tet(X)的传播机制,为临床控制替加环素耐药菌的传播具有重要意义。
近年来,一些动物园为招揽游客(尤其是未成年人),专门在园内设置禽类散养场。游客在散养场可以与动物进行亲密接触、饲喂等互动,以增加游园的趣味性。但是,人与动物的直接或间接接触,可能会增加人兽共患病病原体从动物传播给人的机会,并引起游客的感染,尤其是免疫力低下的人群,如老年人和儿童[10]。本研究从某市动物园的禽类散养场分离获得1株印地不动杆菌,该菌株同时携带2种tet(X)的变异体:tet(X6)和tet(X3),经药敏试验、全基因组测序及比较基因组学分析,探究动物园散养场在人畜共患病原菌散播中的作用,并为临床控制替加环素耐药基因的散播提供部分依据。
1 材料与方法
1.1 菌株来源2019年7月在某市动物园内的禽类散养场采集42份样品(包括新鲜粪便和肛门拭子),从其中1只健康珍珠鸡粪便样品中分离到菌株LYS68A。
1.2 抗菌药物氟苯尼考、多西环素、土霉素、替加环素、庆大霉素、新霉素、阿米卡星、复方磺胺二甲嘧啶(磺胺二甲嘧啶∶甲氧苄啶=5∶1)均由河南牧翔动物药业有限公司提供,所有药物均在有效期内使用。
1.3 培养基LB肉汤培养基、LB琼脂培养基均购于北京路桥技术有限公司,使用前都在有效期内,使用时严格按照说明书配置好并高压灭菌保存备用。
1.4 细菌分离鉴定使用LB肉汤、LB琼脂对LYS68A进行纯化,挑取单菌落通过革兰染色镜检和全自动细菌鉴定仪(VITEK COMPACT 2,法国生物梅里埃公司)初步鉴定种属,经全基因组测序进一步确定种属。
1.5 药物敏感性测定采用微量肉汤稀释法[11]测定9种抗菌药物对菌株LYS68A的最小抑菌浓度(minimum inhibitory concentration,MIC),药敏结果根据美国临床试验室标准化协会(CLSI)标准判读[11],质量控制菌株为大肠埃希菌ATCCR25922。
1.6 耐药基因检测通过煮沸法提取菌株LYS68A的基因组,采用PCR方法对替加环素耐药基因tet(X)进行检测,引物tet(X)-F:5′-CGAAAGAGACAA-CGACCGAGAGGCA-3′;tet(X)-R:5′-AGGAAA-TTTCCTTGTGGGCAAGCAT-3′)由本实验室设计,目的片段长750 bp,引物由北京擎科生物科技有限公司合成。PCR反应体系为20 μL:2×Taq Master Mix 10 μL,上、下游引物各1 μL,ddH2O 7 μL,模板1 μL。取5 μL PCR产物进行1.0%琼脂糖凝胶电泳,检测DNA片段长度,选取特异性强的PCR产物送至北京擎科生物技术有限公司进行单向测序,结果与NCBI数据库相关序列进行比对。
1.7 全基因组测序使用天根全基因组提取试剂盒提取菌株LYS68A的基因组DNA;全基因组测序由武汉贝纳科技服务有限公司完成;采用Illumina Nextseq 500和ONT(Oxford Nanopore Technologies)MinION平台进行测序;使用unicycler(0.4.8)软件对短读长序列和长读长序列进行组装[12],染色体序列先在RAST网站(http://rast.nmpdr.org)进行注释,然后利用BLASTn和BLASTp(http://blast.ncbi.nlm.nih.gov/blast)对序列进行比对分析;使用CGE服务器(https://cge.cbs.dtu.dk/services/)和综合抗菌素耐药性数据库(https://card.mcmaster.ca/)对耐药基因进行检索、分析;使用ISfinder(https://isfinder.biotoul.fr/)对插入元件(IS)进行识别、鉴定;序列的线性化分析比较使用Easyfig 2.2.3,而环形结构图谱绘制使用BRIG进行分析[13-14]。将LYS68A基因组序列提交至NCBI数据库,获得的序列号为CP070997。
2 结果
2.1 菌株的鉴定革兰阴性菌LYS68A经全自动细菌鉴定仪鉴定为洛菲不动杆菌(Acinetobacterlwoffii),尽管有不吻合的典型生化谱,但仍属于极好鉴定(概率为98%)(表1)。由于全自动细菌鉴定仪鉴定不动杆菌的菌属有限,仅能检出8种(鲍曼不动杆菌复合菌、溶血不动杆菌、琼氏不动杆菌、鲁氏不动杆菌、医院不动杆菌、皮氏不动杆菌、抗放射不动杆菌、乌尔辛不动杆菌),因此经第3代全基因组测序,并将LYS68A的16S rRNA序列在NCBI数据库中比对后最终确定该菌株其实属于印地不动杆菌(Acinetobacterindicus)。
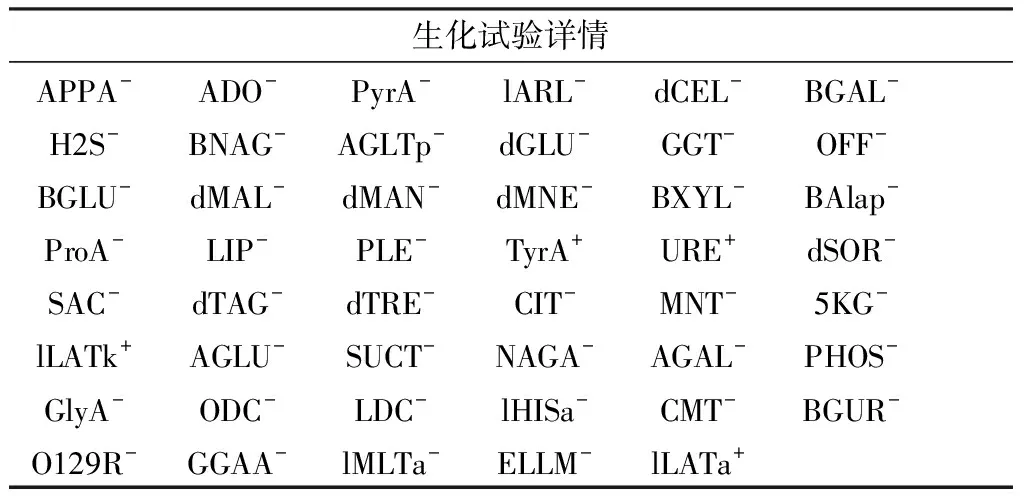
表1 菌株LYS68A的生化试验详情
2.2 药物敏感性检测结果药敏结果表明菌株LYS68A对氟苯尼考(MIC=32 mg/L)、土霉素(MIC=16 mg/L)和复方磺胺二甲嘧啶(MIC≥512 mg/L)呈现耐药;而对庆大霉素、新霉素、阿米卡星、多西环素和替加环素(MIC≤1 mg/L)高度敏感。
2.3tet(X)检测结果经PCR扩增、纯化及测序比对表明菌株LYS68A携带有tet(X)的变异体,其与HE等[15]上传的tet(X3)(MK134375)的同源性为100%。
2.4 比较基因组学分析菌株LYS68A基因组全长3 212 811 bp,GC含量45.72%,预测有3 042个基因,2 936个潜在CDS,81个tRNA,21个rRNA操纵子,4个ncRNA,11个基因岛,1个crispr和89个IS插入序列。将菌株LYS68A基因组在NCBI数据库中搜索后,发现了4条覆盖率和同源性较高的序列,均为印地不动杆菌,分别是TQ18(CP045131)、B18(CP044455)、TQ23(CP045198)和TQ04(CP04-5129)。比较这5个菌的染色体可以发现(图1),它们均具有类似的骨架结构,且菌株LYS68A与TQ18、B18、TQ23和TQ04的同源性分别为98.66%,98.15%,98.56%,98.56%,其中菌株LYS68A的基因组在ribBA(106 735~107 805 bp)与tRNA-Gly(167 481~167 556 bp)之间插入了1段长为59 630 bp 的区域;在tRNA-Ile(1 309 968~1 310 044 bp)与intS(1 390 140~1 390 739 bp)之间插入了1段长度为80 095 bp的区域,说明tRNA-Gly和tRNA-Ile的周围是潜在的热点区域,外源DNA可通过同源重组或者插入的方式整合到基因组上。
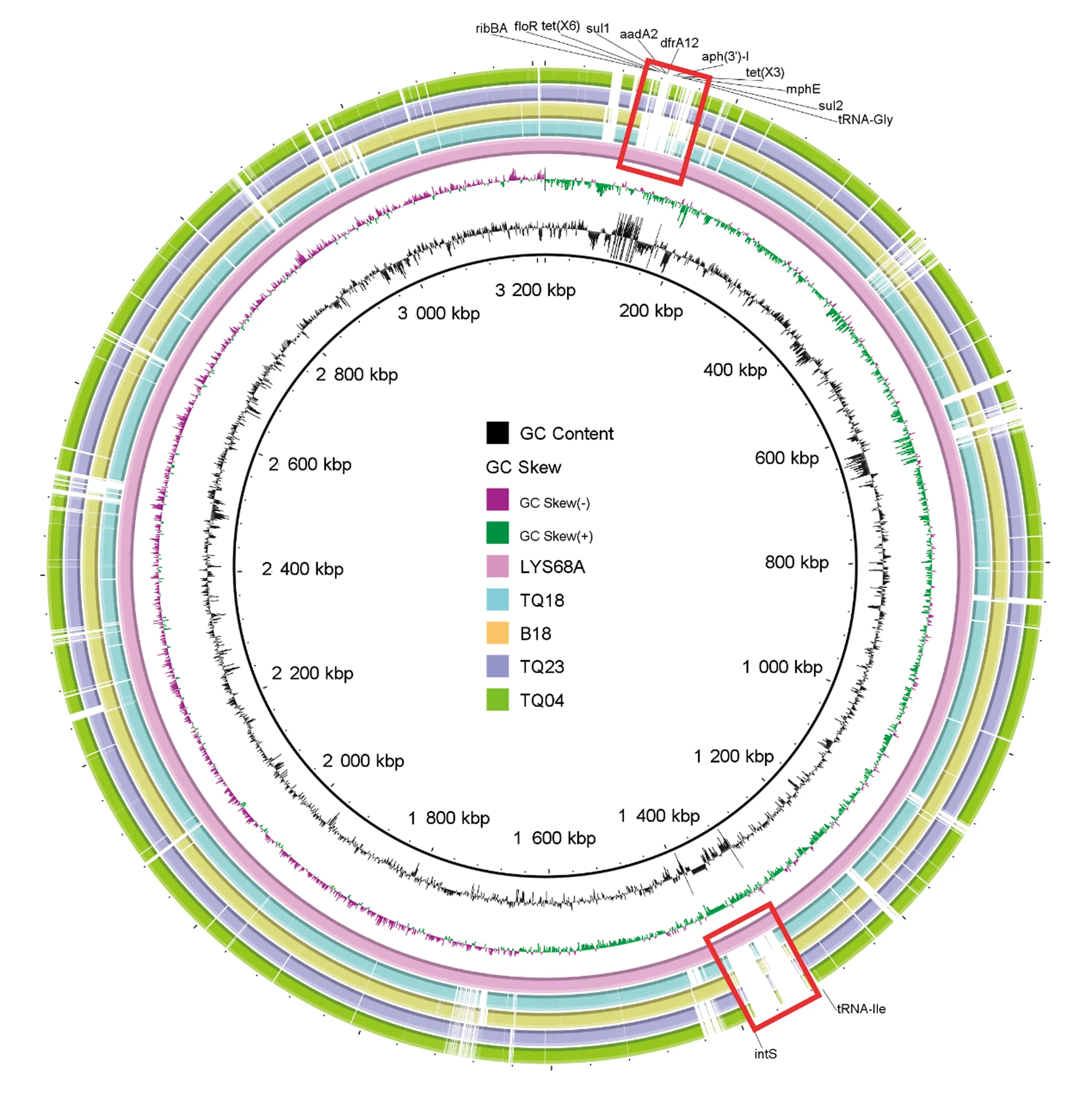
图1 印地不动杆菌菌株LYS68A与TQ18、B18、TQ23、TQ04的染色体比较图
菌株LYS68A染色体上共携带9个耐药基因(tet(X6)、tet(X3)、floR、sul1、aadA2、dfrA12、aph(3’)-I、mphE和sul2),它们构成了一个由3部分组成的总长为29 252 bp(111 391~140 642 bp)的多重耐药区(图2),此多重耐药区位于插入片段(107 805~167 481 bp)内,即位于染色体tRNA-Gly的上游,推测是以一个整体直接插入菌株LYS68A染色体的热点区域,即该多重耐药区是以整体形式经同源重组完成水平转移。
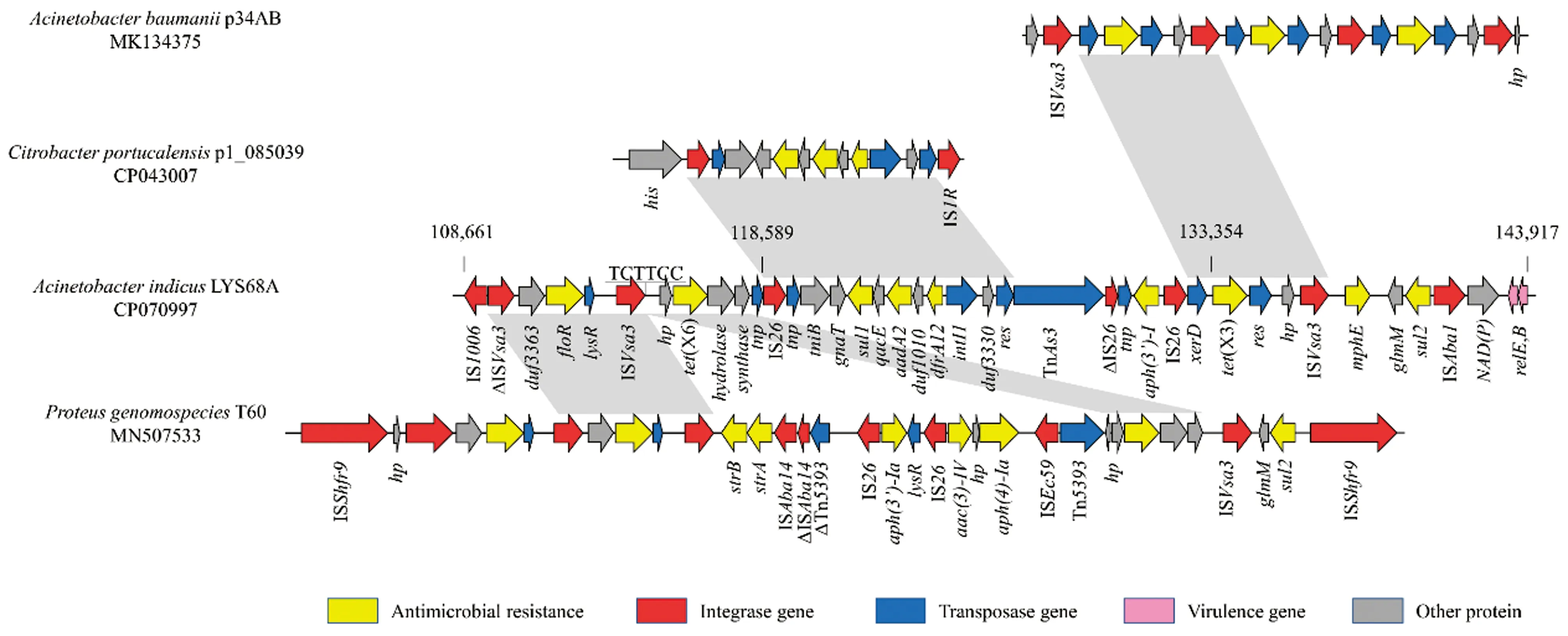
图2 菌株LYS68A染色体上多重耐药区的线性比较图
左侧部分是长度为8 634 bp(109 429~118 062 bp)的片段,包含了2个耐药基因(tet(X6)和floR)。经比对后发现,本部分与HE等[15]在2020年报道的1株奇异变形杆菌染色体上的ICEPgs6Chn1(MN507533)元件内的多重耐药区相似度较高。HE等[16]也证实该ICE元件可以形成环状中间体而进行整体水平转移,但并未研究ICE元件内的各部分能否独立进行水平转移。耐药基因floR两侧含有2个方向相同的插入序列ISVsa3,但由于左侧的ISVsa3部分缺失,故不能独立成环完成水平转移。耐药基因tet(X6)的上、下游结构(hp-tet(X6)-α/β hydrolase-GMP synthase)与HE等[16]报道的tet(X6)的环境基因同源性高达99%,推测菌株 LYS68A通过ISVsa3和假定蛋白(hp)之间的热点区域(TCTTCC)经同源重组获得了tet(X6)基因。
中间部分(118 174~126 810 bp)经序列比对发现与质粒p1_085039(CP043007)的21 411~29 608 bp区域具有100%的同源性。片段左侧由插入序列IS26介导,与p1_085039相比右侧缺少1个IS1R,中间包含1个缺失了3’保守区的Ⅰ类整合子,该整合子的可变区包含了3个耐药基因的耐药基因盒dfrA12-duf1010-aadA2,该基因盒主要对磺胺类和氨基糖苷类耐药。熊明华等[17]发现Ⅰ类整合子对氨基糖苷类耐药基因的捕获最多,其次是磺胺类耐药基因。将这段长度为1 697 bp的耐药基因盒序列在NCBI数据库中比对后发现,该结构在肠杆菌属细菌中最为常见,在印地不动杆菌中较为少见。已经证实,Ⅰ类整合子不仅可捕获外源性耐药基因,而且可以在不同菌属间进行水平传播[18],即该部分耐药基因是经Ⅰ类整合子介导整合至印地不动杆菌菌株LYS68A的染色体中。
右侧部分(129 813~141 822 bp)在NCBI数据库中比较后发现,本片段包含了tet(X3)、aph(3’)-I、mphE和sul2等4个耐药基因,其中tet(X3)上、下游基因环境(IS26-xerD-tet(X3)-res-hp-ISVsa3)与2019年HE等[15]报道质粒p34AB(MK134375)中的5 319~10 151 bp片段(ISVsa3-xerD-tet(X3)-res-hp-ISVsa3)的覆盖率为86%,同源性达99%。HE等[15]发现tet(X3)基因在质粒中有3个相同的拷贝,且可以由相邻的插入序列ISVsa3介导形成环状中间体完成水平转移。本试验中菌株LYS68A的tet(X3)基因仅有1个拷贝,且仅一侧含有ISVsa3,推测另一侧的插入序列在同源重组后发生了缺失,结果导致tet(X3)不能独立成环并完成水平传播。
3 讨论
替加环素是一种新的四环素类药物,是治疗多重耐药病原菌的最后手段之一,可以克服外排泵和核糖体保护机制介导的四环素抗性。tet(X)最早是在1984年由GUINEY等[8]在专性厌氧脆弱拟杆菌携带的质粒上发现。YANG等[5]通过测定土霉素降解过程中的吸收峰,说明tet(X)是通过编码一种黄素依赖的单加氧酶使四环素类抗生素失活。此后,人们陆续在动物源临床分离株中鉴定出tet(X)或其变异体[19-20],尤其是肠杆菌科细菌和不动杆菌[21-22]。2021年,UMAR等[23]在鸭疫里默杆菌中发现了一系列新型变异体tet(X18)至tet(X44),预示tet(X)变异体的种类日趋复杂多样。同时,携带2种tet(X)变异体的菌株也不断被发现。2020年,CHENG等[24]检出同时携带tet(X14)和tet(X2)猪源稳杆菌,而本试验首次在1株印地不动杆菌中同时检出tet(X6)和tet(X3),说明临床菌株中携带多个tet(X)变异体的的现象日趋增多,对研究替加环素耐药基因的水平传播机制造成较大的困难和挑战。
根据全基因组测序,本试验在染色体上发现了2个tet(X)变异体:tet(X6)和tet(X3)。2020年,本实验室曾从猪肉源奇异变形杆菌T60中分离鉴定了1个新型tet(X)变异体,称为tet(X6)[16],且奇异变形杆菌T60对替加环素(MIC=32 mg/L)耐药。同样的,质粒介导的tet(X3)最初是在2019年HE等[15]从猪源的耐替加环素鲍曼不动杆菌和大肠埃希菌中分离鉴定,随后又从奶牛源粪便中分离到了携带tet(X3)的印地不动杆菌,且发现tet(X3)既可由染色体介导,又可由质粒介导,在奶牛场内既可克隆垂直传播,又可经质粒接合水平传播[25]。同时发现携带tet(X3)的分离菌均对替加环素(MIC≥8 mg/L)耐药。经比对后发现本次分离获得的印地不动杆菌菌株LYS68A携带的tet(X6)和tet(X3)与上述分离菌的tet(X)变异体同源性均很高,且上、下游的基因环境也高度相似。不同的是,本试验中分离获得的印地不动杆菌菌株LYS68A对替加环素高度敏感(MIC=1 mg/L)。此现象与2020年CHENG等[24]在猪源稳杆菌中检出的携带tet(X14)菌株对替加环素的敏感性相类似。GUINEY等[8]在专性厌氧脆弱拟杆菌携带的质粒上发现tet(X)时就已发现该基因在原宿主中不表达对四环素的抗性,但是却在有氧环境培养的大肠埃希菌中表现出四环素抗性,猜测tet(X)是否表达主要与O2的是否存在有关。2007年,GHOSH等[26]首次在土壤中分离到1株携带tet(X)的好氧鞘氨醇杆菌,进一步证实tet(X)需要有O2才能表达四环素降解特性。MOORE等[27]发现,当TetX在O2和NADPH同时存在时会降解替加环素,结果导致携带tet(X)的宿主菌对替加环素表达抗性。本实验室分离获得的印地不动杆菌为专性好氧菌,但其携带的tet(X)仍未表达对替加环素的抗性,具体原因尚须进一步研究。同时,该印地不动杆菌是从某市动物园禽类散养场健康禽类的粪便中分离获得,尽管暂时未对替加环素表达耐药,但是并不影响tet(X)的变异体在菌属间或不同动物间的传播,再加上动物园禽类散养场中人与动物的互动较多,所以该基因通过人与动物密切接触有很大机会传播至人,尤其是抵抗力较差的老年人和婴幼儿,同时,本试验发现动物园禽类散养场是人畜共患病传播的重要中间媒介和贮库,应引起人们的重视。
——一道江苏高考题的奥秘解读和拓展

