猪流行性腹泻病毒S2基因B细胞表位嵌入型S-层蛋白在副干酪乳杆菌中的表达与鉴定
白伟琴,卡楚拉,乌志勇,苗 苗,塔 娜,格日勒图
(内蒙古农业大学兽医学院,呼和浩特 010010)
猪流行性腹泻病毒(Porcine epidemic diarrhea virus,PEDV)是一种较常见的、侵染性较高的、具有包膜结构的、单股正链RNA病毒,属于α冠状病毒属[1-2]。基因组全长约28 kb,可编码4种主要结构蛋白,分别为纤突蛋白(S)、膜糖蛋白(M)、核衣壳蛋白(N)和小膜蛋白(E)[3]。其中,S蛋白属于一种Ⅰ型糖蛋白,分布在病毒粒子最外层,与其他冠状病毒S蛋白一样,PEDV S蛋白也是定位于病毒粒子表面的一种二聚体结构糖蛋白,在调节特定宿主细胞受体糖蛋白的相互作用、病原体侵入宿主细胞后的介导及刺激自然宿主诱导中和抗体产生中发挥关键作用[4]。在表位疫苗的研究中选定能与主要组织相容性复合体Ⅱ类(MHCⅡ)有效匹配的肽序列尤为重要,因为MHCⅡ-Ag易向辅助T细胞递呈抗原,从而有望触发细胞免疫和体液免疫兼备的免疫应答,因此选择S2基因B细胞表位(EpitopeS2)作为靶位序列。
副干酪乳杆菌作为一种常见的食品级微生物,在乳制品、饮料及保健食品中均能分离到,并在食品工业中得到广泛应用[5]。利用非致病性和侵袭性的副干酪乳杆菌作为抗原传递载体应用于疫苗研究领域,不仅能发挥乳酸菌本身的益生作用,还能避免制备纯化病毒抗原的繁琐流程,并有效刺激机体产生中和抗体[6]。乳酸菌S-层蛋白(S-layer protein,SLP)是蛋白质状的细胞包膜结构[7],可作为外部显示的辅助蛋白和糖蛋白[8],其作为融合蛋白还具备以下特点:首先,SLP是乳酸菌的特殊结构,能在菌体表面组装成纳米级晶格结构,将抗原表位嵌入到这些晶格中更有利于病毒抗原与宿主相关细胞接触形成有效刺激[9];其次,SLP具有增加宿主细菌黏附作用,可有效延迟细菌在肠道中滞留时间[10]。被广泛应用于构建S-层融合蛋白,在人或动物的免疫接种中应用。为更好地触发免疫应答,将EpitopeS2基因嵌入到乳酸菌SLP基因序列中构建融合基因SLP-EpitopeS2,利用SLP的佐剂效应使得表位肽更好地发挥作用。
本研究将SLP-EpitopeS2融合基因克隆到表达载体pTRK892中构建重组质粒pTRK-SLP-EpitopeS2,并将其电转化至副干酪乳杆菌构建重组副干酪乳杆菌来表达EpitopeS2抗原蛋白,以期为PEDV新型活菌载体疫苗相关研究提供基础数据。
1 材料与方法
1.1 材料
1.1.1 菌株及质粒 副干酪乳杆菌由本实验室从传统马奶酒中分离并保存;重组质粒pGEX-SLP-EpitpeS2由本实验室构建及保存[11];大肠杆菌MC1061菌株、乳杆菌表达载体pTRK892均购自Addgene公司。
1.1.2 主要试剂及仪器 PEDV B细胞表位单克隆抗体(McAb)委托吉尔生化(上海)有限公司制备;辣根过氧化物酶(HRP)标记的山羊抗鼠IgG、FITC标记的山羊抗鼠IgG均购自北京博奥森生物技术有限公司;蛋白质分子质量标准购自北京聚合美生物科技有限公司;增强型DAB显色试剂盒购自北京索莱宝生物科技有限公司。
SDS-PAGE电泳仪购自伯乐生命医学产品(上海)有限公司;激光共聚焦显微镜购自卡尔蔡司光学(中国)有限公司。
1.2 方法
1.2.1 引物设计与合成 根据重组质粒pGEX-SLP-EpitopeS2基因序列设计引物,序列如下:F:5′-GCTGAATTCTACTAGAAAGGAAAATCATCT-ATGAAGAAAAATTTAAGAATCGTTAGCGC-TG-3′;R:5′-AGAGCGGCCGCTTATCTAAAGT-TTGCAACCTTAAC-3′,下划线处分别为EcoRⅠ和NotⅠ酶切位点。引物由上海桑尼生物工程有限公司合成。
1.2.2 重组质粒pTRK-SLP-EpitopeS2的构建及鉴定 利用上述合成的引物,以重组质粒pGEX-SLP-EpitopeS2为模板PCR扩增SLP-EpitopeS2融合基因,用限制性内切酶EcoRⅠ和NotⅠ双酶切目的基因,将目的基因与经相同酶切处理的pTRK892表达载体用T4 DNA连接酶4 ℃过夜连接,将连接产物转化大肠杆菌MC1061感受态细胞,从含有1.5%红霉素(Em)的LB琼脂培养基中筛选阳性克隆,阳性克隆经扩大培养后提取质粒,进行PCR和双酶切鉴定。
1.2.3 重组副干酪乳杆菌的构建及鉴定 将副干酪乳杆菌制备为副干酪乳杆菌感受态细胞。将重组质粒pTRK-SLP-EpitopeS2与副干酪乳杆菌感受态细胞混合冰浴5 min,将混合物转移到预冷的电转化杯中进行电转化,电转完成后添加800 μL含有0.500 mol/L蔗糖、0.020 mol/L MgCl2和0.005 mol/L CaCl2的MRS液体培养基并转移到1.5 mL离心管中,37 ℃培养3 h。将200 μL细菌悬浮液均匀涂布于含有0.2%红霉素的MRS固体培养基上,在37 ℃恒温培养箱中培养48~72 h,直至形成单个菌落,将单个菌落接种于5 mL MRS液体培养基(Em+)中进行扩大培养,取少量菌液进行PCR鉴定。将鉴定正确的重组副干酪乳杆菌菌液与 50%甘油1∶1混合,-80 ℃保存。
1.2.4 SDS-PAGE鉴定重组副干酪乳杆菌中SLP-EpitopeS2的表达 将pTRK-SLP-EpitopeS2菌株进行传代培养,二代菌以1∶100(V/V)接种于MRS液体培养基(Em+)中,37 ℃培养箱中培养36~48 h进行蛋白表达。取1 mL菌液转移至1.5 mL离心管中,4 ℃、5 000×g离心10 min。沉淀用预冷的PBS洗涤3次,加入50 μL 1×SDS上样缓冲液重悬沉淀,100 ℃煮沸5 min变性,冰浴5 min,12 000×g离心10 min,取20 μL蛋白质样品进行SDS-PAGE。电泳结束后用考马斯亮蓝染色液染色1 h,考马斯亮蓝染色脱色液脱色1~2 h,观察是否有目的蛋白。
1.2.5 Western blotting 鉴定重组副干酪乳杆菌中SLP-EpitopeS2的表达 SDS-PAGE结束后,将蛋白凝胶通过半干转的方法转移至硝酸纤维素膜(NC膜)上,用5%脱脂奶粉室温封闭3 h,然后将NC膜于PEDV B细胞表位单克隆抗体(1∶500稀释)中4 ℃ 孵育过夜,次日NC膜用含0.05% Tween的PBST洗涤3次,每次10 min,然后与HRP标记的山羊抗鼠IgG(1∶5 000稀释)室温孵育2 h,用PBST洗涤3次,每次10 min。洗涤完后用增强型DAB显色试剂盒进行显色观察。
1.2.6 间接免疫荧光试验(IFA)鉴定 将载玻片用多聚赖氨酸处理30 min,并将D600 nm值约为1.0的重组副干酪乳杆菌(含pTRK-SLP-EpitopeS2质粒)和对照副干酪乳杆菌(不含质粒)用4%多聚甲醛固定在载玻片上,在1∶100稀释的PEDV B细胞表位单克隆抗体中避光孵育45 min,用PBS洗涤2次后,样品在1∶100稀释的FITC标记的山羊抗鼠IgG 抗体中避光孵育30 min,并用PBS洗涤3次,然后通过激光共聚焦显微镜观察和拍照记录。
1.2.7 重组副干酪乳杆菌膜蛋白提取及鉴定 参考尹琼芳等[12]氯化锂(LiCl)提取SLP的方法,将扩大培养的重组副干酪乳杆菌菌液分装至50 mL离心管中,4 ℃、5 000 r/min离心5 min,收集菌体沉淀,沉淀用预冷的PBS洗涤3次,用8 mL 4 mol/L 的LiCl重悬菌沉淀,室温摇床孵育1 h,孵育结束后4 ℃、12 000 r/min离心15 min,收集上清。上清液于0.01 mol/L PBS(pH 7.4)中4 ℃透析,用聚乙二醇浓缩蛋白样品溶液,取少量蛋白用1.2.4和1.2.5的方法分别进行SDS-PAGE和Western blotting鉴定。
2 结 果
2.1 重组质粒pTRK-SLP-EpitopeS2鉴定结果
重组质粒pTRK-SLP-EpitopeS2 PCR鉴定结果显示,成功扩增出大小为1 400 bp的条带,与插入的SLP-EpitopeS2融合基因大小一致;EcoRⅠ和NotⅠ双酶切鉴定结果显示,获得大小分别为1 400 和4 700 bp的条带(图1),与预期大小相符,测序结果与预期结果一致,不存在碱基缺失和基因突变,表明重组质粒pTRK-SLP-EpitopeS2构建成功。

M1,DL2000 DNA Marker;1,重组质粒PCR产物;2,阴性对照;M2,DL5000 DNA Marker;3,重组质粒双酶切产物 M1,DL2000 DNA Marker;1,PCR product of recombinant plasmid;2,Negative control;M2,DL5000 DNA Marker;3,Double enzyme digestion products of recombinant plasmid图1 重组质粒pTRK-SLP-EpitopeS2鉴定结果Fig.1 Identification results of recombinant plasmid pTRK-SLP-EpitopeS2
2.2 重组副干酪乳杆菌鉴定结果
经电转化得到的单菌落稀释后进行 PCR 鉴定,在1 400 bp 处出现目的条带(图2),表明重组质粒pTRK-SLP-EpitopeS2成功转入副干酪乳杆菌中。
2.3 SDS-PAGE鉴定SLP-EpitopeS2的表达
SDS-PAGE鉴定结果显示,重组副干酪乳杆菌在48 ku处出现一条明显的条带,与目的蛋白预计大小相符,而副干酪乳杆菌阴性对照则在相应位置处没有出现条带(图3A),根据SDS-PAGE结果可初步判定SLP-EpitopeS2融合基因在副干酪乳杆菌中得到了表达。
2.4 Western blotting 鉴定SLP-EpitopeS2的表达
Western blotting结果显示,重组副干酪乳杆菌可与PEDV B细胞表位单克隆抗体进行特异性结合,在48 ku处出现一条高特异性的条带,而副干酪乳杆菌阴性对照则未出现任何条带(图3B)。表明融合基因SLP-EpitopeS2在副干酪乳杆菌中成功表达。
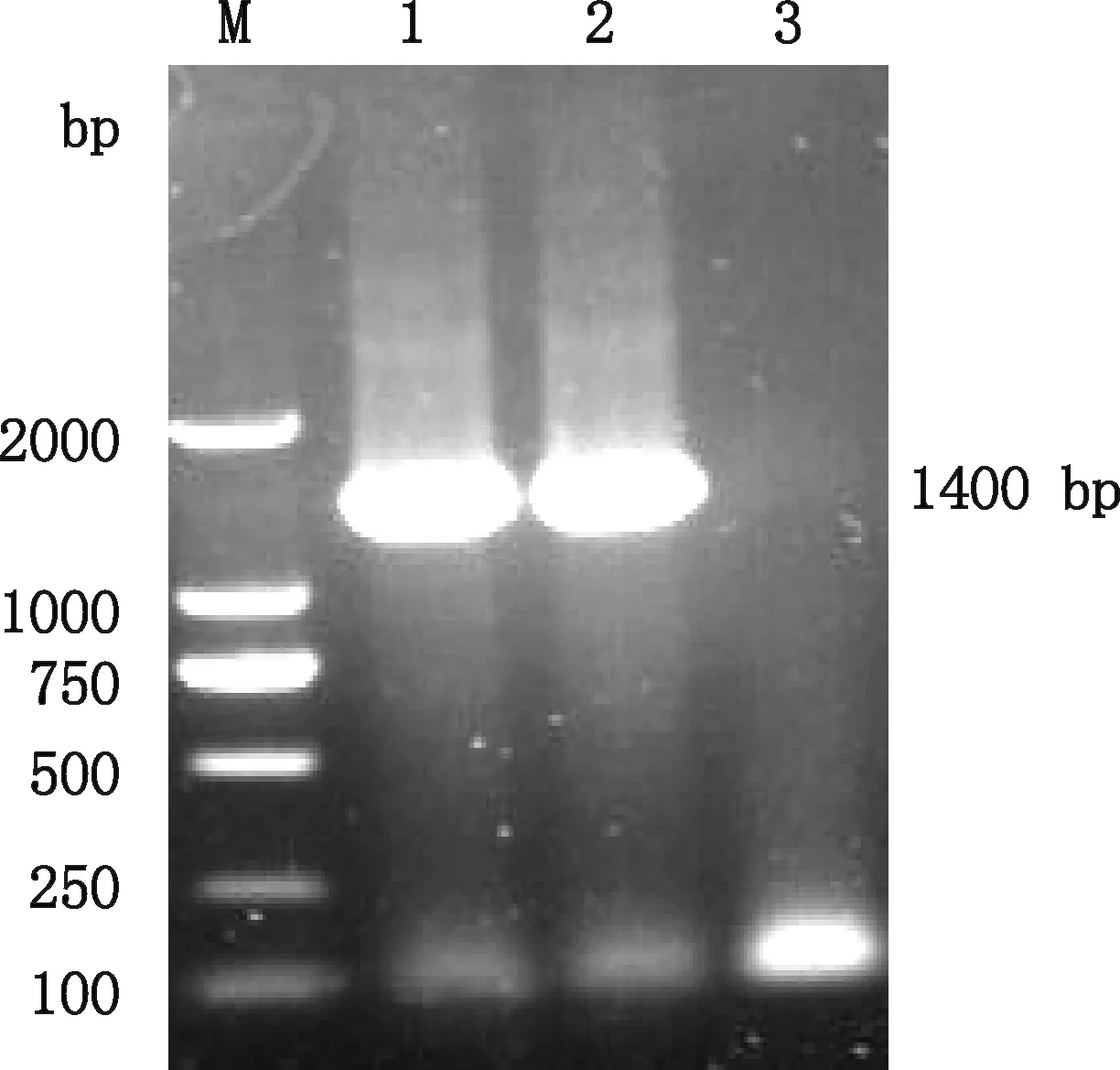
M,DL2000 DNA Marker;1、2,重组副干酪乳杆菌PCR产物;3,副干酪乳杆菌PCR产物 M,DL2000 DNA Marker;1 and 2,PCR products of recombinant Lactobacillus paracasei;3,PCR product of Lactobacillus paracasei图2 重组副干酪乳杆菌鉴定Fig.2 Identification of recombinant Lactobacillus paracasei
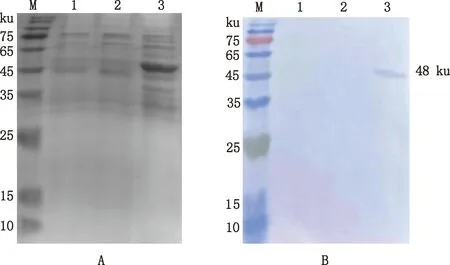
M,蛋白质分子质量标准;1、2,阴性对照;3,SLP-EpitopeS2蛋白表达 M,Protein Marker;1 and 2,Negative control;3,SLP-EpitopeS2 protein expression图3 SLP-EpitopeS2蛋白表达的SDS-PAGE(A)和Western blotting(B)鉴定Fig.3 SDS-PAGE (A) and Western blotting (B) identification of SLP-EpitopeS2 protein expression
2.5 IFA结果
IFA结果显示,重组副干酪乳杆菌几乎全部被激发出了绿色荧光信号,而副干酪乳杆菌对照则没有出现相应的绿色荧光信号(图4),根据结果判断融合基因SLP-EpitopeS2可能表达于副干酪乳杆菌表面。

A,绿色荧光下重组副干酪乳杆菌;B,白光下重组副干酪乳杆菌;C,绿色荧光下对照菌;D,白光下对照菌 A,Recombinant Lactobacillus paracasei under green fluorescence;B,Recombinant Lactobacillus paracasei under white light;C,Negative control under green fluorescence;D,Negative control under white light图4 重组副干酪乳杆菌IFA鉴定(400×)Fig.4 IFA identification of recombinant Lactobacillus paracasei (400×)
2.6 重组副干酪乳杆菌膜蛋白鉴定结果
重组副干酪乳杆菌和副干酪乳杆菌对照经过LiCl处理后进行SDS-PAGE和Western blotting鉴定,结果重组副干酪乳杆菌在48 ku处出现明显的蛋白条带,结合IFA结果推测融合基因表达于副干酪乳杆菌菌体表面(图5)。

M,蛋白质分子质量标准;1,重组菌膜蛋白;2,对照菌膜蛋白;3,重组菌培养上清;4,对照菌培养上清 M,Protein Marker;1,Membrane protein of recombinant bacteria;2,Membrane protein of control bacteria;3,Culture supernatant of recombinant bacteria;4,Culture supernatant of control bacteria图5 膜蛋白中重组SLP-EpitopeS2的SDS-PAGE(A)和Western blotting(B)检测结果Fig.5 SDS-PAGE (A) and Western blotting (B) detection results of recombinant protein SLP-EpitopeS2 in membrane protein
3 讨 论
过去的几十年,猪流行性腹泻给全球养猪业造成了巨大的经济损失[13],引起了公众的高度重视。接种疫苗仍是预防和控制PEDV最有效的方法[14]。近年来,国内外研究者在PEDV疫苗研究方面作了大量的研究工作,研制了不同种类的疫苗[15],对控制流行性腹泻起到了良好的预防作用。随着分子生物学技术的不断发展,传统的灭活疫苗及减毒活疫苗在不久的将来可能会被基因工程疫苗等新疫苗替代。灭活疫苗虽然安全无毒,也能刺激机体产生免疫保护作用,但免疫周期短,保护效果不佳[16],减毒疫苗如果减毒不完全还可能引起疾病感染[17],然而,表位疫苗安全稳定,其分子质量较小,不会引起机体的免疫抑制及排斥反应[18]。由于表位肽本身免疫原性不高,因此可选用嗜酸乳杆菌SLP进行融合,增强其免疫原性。
乳酸菌是一类被公认的、安全的、对动物和人体有益的微生物,在自然界中广泛存在[19],且与肠道健康密切相关,能依赖自身在肠道中的定植特性定植于胃肠道中,通过自身的发酵功能分泌有机酸、抗菌素、维生素和具有生物活性的肽等物质,乳酸菌向宿主释放的物质可抵抗有害菌的生长繁殖,从而维持肠道内环境的稳定,调节胃肠道中的菌群平衡[20]。其中副干酪乳杆菌作为正常的肠道菌群,适应胃肠道中高盐、高酸性的环境,可在胃肠道环境中生存增殖,抗原蛋白也随着菌体的复制而得到复制,并不断向宿主释放抗原蛋白。若将其开发成口服疫苗将是一个新的突破。Guo等[21]将PEDVS1基因克隆到乳球菌表达载体pNZ8149中构建重组质粒pNZ8149-S1,并将重组菌免疫BALB/c小鼠评价免疫原性,结果显示,重组乳酸乳球菌可诱导机体产生较高水平的体液免疫和黏膜免疫应答。Li等[22]将PEDVS基因克隆到乳酸菌表达载体pVE5523中,免疫小鼠评价免疫原性,与Guo等[21]研究结果相似,可高水平地诱导体液免疫、细胞免疫和黏膜免疫。上述试验结果虽证明重组乳酸菌免疫小鼠能产生较高水平的体液免疫、黏膜免疫应答,但存在由于插入片段大而导致对PEDV野外变异株的特异性差和抗原蛋白的表达量不高等瓶颈问题。
本试验首先扩增出融合基因SLP-EpitopeS2,并将其克隆到乳杆菌表达载体pTRK892中,构建了重组质粒pTRK-SLP-EpitopeS2,并将其转入副干酪乳杆菌中进行目的蛋白的表达。应用食品级副干酪乳杆菌作为载体菌可避免抗原蛋白的纯化等繁琐流程,且选择表位基因在某种程度上可克服病毒变异所带来的中和病毒效率低等关键问题。SDS-PAGE和Western blotting 结果显示,在相应位置处出现特异性目的条带,与多克隆抗体相比,选用单克隆抗体进行Western blotting鉴定可有效减少与其他杂蛋白的交叉反应,提高试验结果的准确性,根据与单克隆抗体抗的特异性结合,表明融合蛋白SLP-EpitopeS2还具备抗原性。在IFA中,成功解决了S2基因 B细胞表位肽在副干酪乳杆菌中能否有效表达的定性问题,与副干酪乳杆菌对照相比,重组副干酪乳杆菌绝大多数菌体都能激发出绿色荧光信号。但遗憾的是由于实验室激光共聚焦显微镜的性能参数所限,未能更准确地证实S2表位肽是否在乳酸菌膜上定位问题。为补充证实该问题,使用4 mol/L高浓度的LiCl处理重组副干酪乳杆菌和副干酪乳杆菌对照,非特异性洗脱出乳杆菌表面上的膜蛋白,在这种高浓度的LiCl洗脱条件下,菌体表面混杂的膜蛋白几乎都被洗脱下来,但对细菌细胞膜的损伤甚微[23]。所以结合单克隆抗体高特异性识别目的融合蛋白,推测融合蛋白SLP-EpitopeS2可能在副干酪乳杆菌菌体表面表达。表达量高且展示于载体菌膜表面的蛋白是开发口服疫苗较高的优势[24],但由于本试验尚未进行动物试验而不能确定重组副干酪乳杆菌作为口服疫苗能否有效刺激机体产生高水平的免疫应答。在今后还需通过进一步试验确定其免疫原性。
4 结 论
本试验选择乳酸菌表达载体pTRK892成功构建了PEDV EpitopeS2 B细胞表位嵌入型SLP融合表达载体,并成功在副干酪乳杆菌中表达,为今后进行PEDV 新型活菌载体疫苗研究奠定了基础。

