1株鸡源肠炎沙门氏菌的分离鉴定及致病性分析
张甜甜,吕文亮,林显华,鹿 瑶,徐海燕,谷 巍,郝木强,盛永杰
(山东宝来利来生物工程股份有限公司,山东省动物微生态制剂重点实验室,泰安 271017)
沙门氏菌(Salmonella)是革兰氏阴性菌,杆状,是重要的肠道致病菌。沙门氏菌属是一个很大的菌属,其血清型超2 600种[1]。肠炎沙门氏菌(SalmonellaEnteritidis)常可引起鸡、鸭等禽类感染,近年来,人们对沙门氏菌病例的调查表明,养殖场93%的鸡检测出沙门氏菌感染,认为家禽及其副产品是最常见的传染途径[2-4],与其他血清型沙门氏菌相比,肠炎沙门氏菌在蛋鸡生殖道的定植能力更强[5]。沙门氏菌能通过输卵管直接沉积在蛋黄中,从而躲过鸡蛋的清洗和消毒,导致感染的蛋孵化率低,弱雏率和死亡率增加[6],还会造成肉鸡生长速度减缓、采食量下降和肠炎性腹泻、死亡等症状,对肉鸡养殖业造成了巨大经济损失[7]。更重要的是,沙门氏菌可引起食物中毒[8]。近年来,疾病预防控制中心报告的病例发现,肠炎沙门氏菌是引起疾病的主要血清型之一[9],据报道,2021年欧洲包括英国在内的6个国家报道了272例确诊的肠炎沙门氏菌ST11感染病例[10]。
为确定云南某蛋鸡场疑似沙门氏菌病病料中的主要病原菌的种类和生物学特性,本试验进行了沙门氏菌的分离、鉴定、药物敏感性试验及动物致病性试验,以期为沙门氏菌病的临床诊断和有效防治提供帮助。
1 材料与方法
1.1 样品及试验动物
病死鸡来源于云南某蛋鸡养殖场。20只4日龄健康海兰褐雏鸡购自泰安东岳种禽有限公司。
1.2 主要试剂
SS琼脂、胰蛋白胨大豆肉汤(TSB)、沙门氏菌显色培养基、沙门氏菌生化鉴定条、TSI琼脂、半固体琼脂、胰蛋白胨大豆琼脂(TSA)培养基、革兰氏染液均购自青岛海博生物技术有限公司;细菌基因组DNA提取试剂盒和2×TaqPCR MasterMix均购自天根生化科技(北京)有限公司;DL2000 DNA Marker购自宝生物工程(大连)有限公司;药敏纸片购自杭州滨和微生物试剂有限公司;沙门氏菌诊断血清试剂盒购自北京陆桥技术股份有限公司。
1.3 细菌分离培养
无菌条件下取病死鸡肝脏,加入无菌生理盐水研磨,制成组织匀浆液,划线接种于SS琼脂培养基平板上,37 ℃培养24 h。挑取SS琼脂培养基平板上无色透明的小菌落,接种于沙门氏菌显色培养基平板,37 ℃培养24 h。取沙门氏菌显色培养基平板上的紫色菌落划线接种于TSA培养基平板,进行菌落形态观察和革兰氏染色,观察菌体形态。
1.4 生化鉴定
使用沙门氏菌生化鉴定条对分离菌进行生化试验鉴定,参照《GB 4789.4-2016》[11]进行结果判定。
1.5 血清学鉴定
按沙门氏菌属诊断血清试剂盒使用说明书,采用玻片凝集法进行血清学鉴定。于洁净玻片上滴加沙门氏菌标准血清,将菌苔加入少量灭菌生理盐水制成菌液,取少量菌液与血清混合均匀,2 min内判断结果,同时设置生理盐水为阴性对照。
1.6 16S rRNA鉴定
取分离菌株,接种于TSB培养基中,37 ℃、180 r/min培养24 h。培养好的菌液按细菌基因组DNA提取试剂盒说明书提取细菌基因组DNA,并以此为模板,选用16S rRNA通用引物(1492R:5′-GGTTACCTTGTTACGACTT-3′;27F:5′-AGA-GTTGATCCTGGCTCAG-3′)进行PCR扩增。PCR反应体系50 μL:2×TaqPCR MasterMix 25 μL,上、下游引物(10 μmol/L)各1 μL,模板DNA 2 μL,超纯水21 μL。PCR反应条件:94 ℃预变性5 min;94 ℃变性1 min,52 ℃退火1 min,72 ℃延伸2 min,共25个循环;72 ℃延伸10 min。取5 μL PCR扩增产物进行1.0%琼脂糖凝胶电泳检测,电泳完毕后用凝胶成像仪观察结果并拍照,将扩增后的PCR产物送生工生物工程(上海)股份有限公司测序,在NCBI网站通过BLAST比对分析,确定细菌种属。选取11株沙门氏菌属代表菌株的16S rRNA核苷酸序列通过软件Mega 11.0的邻接法(NJ)构建遗传进化树。
1.7 毒力基因检测
使用细菌基因组DNA提取试剂盒提取分离菌株基因组DNA,并以此为模板进行毒力基因检测。参考杨文文等[12]合成15对沙门氏菌毒力基因检测引物(表1),包含毒力岛基因、毒力质粒基因、肠毒素基因、菌毛毒力基因检测引物,引物均由生工生物工程(上海)股份有限公司合成。PCR反应体系25 μL:2×TaqPCR MasterMix 12.5 μL,上、下游引物(10 μmol/L)各1 μL,模板DNA 1 μL,超纯水9.5 μL。PCR反应条件:95 ℃预变性5 min;94 ℃变性30 s,57 ℃退火30 s,72 ℃延伸30 s,共30个循环;72 ℃延伸10 min。PCR结束后,取5 μL扩增产物进行1.0%琼脂糖凝胶电泳检测,观察并拍照。
1.8 对鸡的致病性试验
将20只4日龄健康雏鸡随机分为2组,试验组和对照组,每组10只。将分离菌接种于TSB培养基中,37 ℃、180 r/min过夜培养,平板菌落计数至含菌量为4.2×108CFU/mL,经嗉囊软管灌喂试验组雏鸡,0.5 mL/只,对照组灌喂等体积无菌生理盐水,观察雏鸡发病情况并统计死亡率,取病死鸡的肝脏进行致病菌分离培养。
1.9 药物敏感性试验
采用纸片琼脂扩散法(K-B法)测定分离菌株的药物敏感性。无菌条件下将纯化的菌液均匀涂布在TSA琼脂平板上,贴好药敏纸片后,于37 ℃培养24 h,观察并测定抑菌圈直径大小。参照美国临床和实验室标准化协会(CLSI 2019)抗微生物药物敏感性试验标准判定敏感、中介、耐药。
2 结 果
2.1 细菌分离培养结果
分离菌株在SS琼脂培养基上形成直径为1~2 mm表面光滑、边缘整齐、无色透明的圆形菌落(图1A),在沙门氏菌显色培养基上呈现圆形紫色菌落(图1B),在TSA培养基上呈半透明乳白色小菌落(图1C)。经镜检观察,菌体呈小短杆至球杆状,革兰氏染色阴性(图1D)。初步判定分离菌株为疑似沙门氏菌,命名为S2。

A~C,分别为分离菌在SS琼脂培养基、沙门氏菌显色培养基和TSA培养基上的菌落形态;D,革兰氏染色镜检结果(1 000×) A,Colony morphology of the isolate on SS agar medium,Salmonella chromogenic medium and TSA medium,respectively;D,Gram staining microscopic examination results(1 000×)图1 分离菌培养特性及形态观察Fig.1 Culture characteristics and morphological observation of the isolated bacteria
2.2 生化鉴定与血清学鉴定结果
生化试验结果显示,菌株S2接种的三糖铁斜面,斜面产碱,底层产酸,产硫化氢;赖氨酸脱羧酶、卫矛醇试验为阳性;靛基质、尿素酶、氰化钾、山梨醇、水杨苷、β-半乳糖苷、丙二酸盐生化试验结果均为阴性(表2),判断菌株S2为典型沙门氏菌属菌株。血清学鉴定结果表明,菌株S2与O多价、O1、O9、O12、H多价、Hg和Hm血清反应为阳性,与其他血清反应为阴性。参照沙门氏菌诊断抗原表,确定菌株S2属于D群肠炎沙门氏菌,其抗原结构式为1,9,12:g,m。

表2 分离菌生化鉴定结果Table 2 Results of biochemical identification of the isolated strains
2.3 分离菌16S rRNA鉴定结果
分离菌16S rRNA PCR扩增结果显示,获得大小约为1 500 bp的目的片段(图2),测序结果为1 405 bp。将测得序列上传至GenBank数据库中进行BLAST比对分析,结果显示,菌株S2与肠炎沙门氏菌代表株MT621365(马来西亚)相似性最高,为99.86%;遗传进化树显示,菌株S2与肠炎沙门氏菌MT621365聚为一簇(图3),自展值为99%,因此,菌株S2可鉴定为肠炎沙门氏菌。
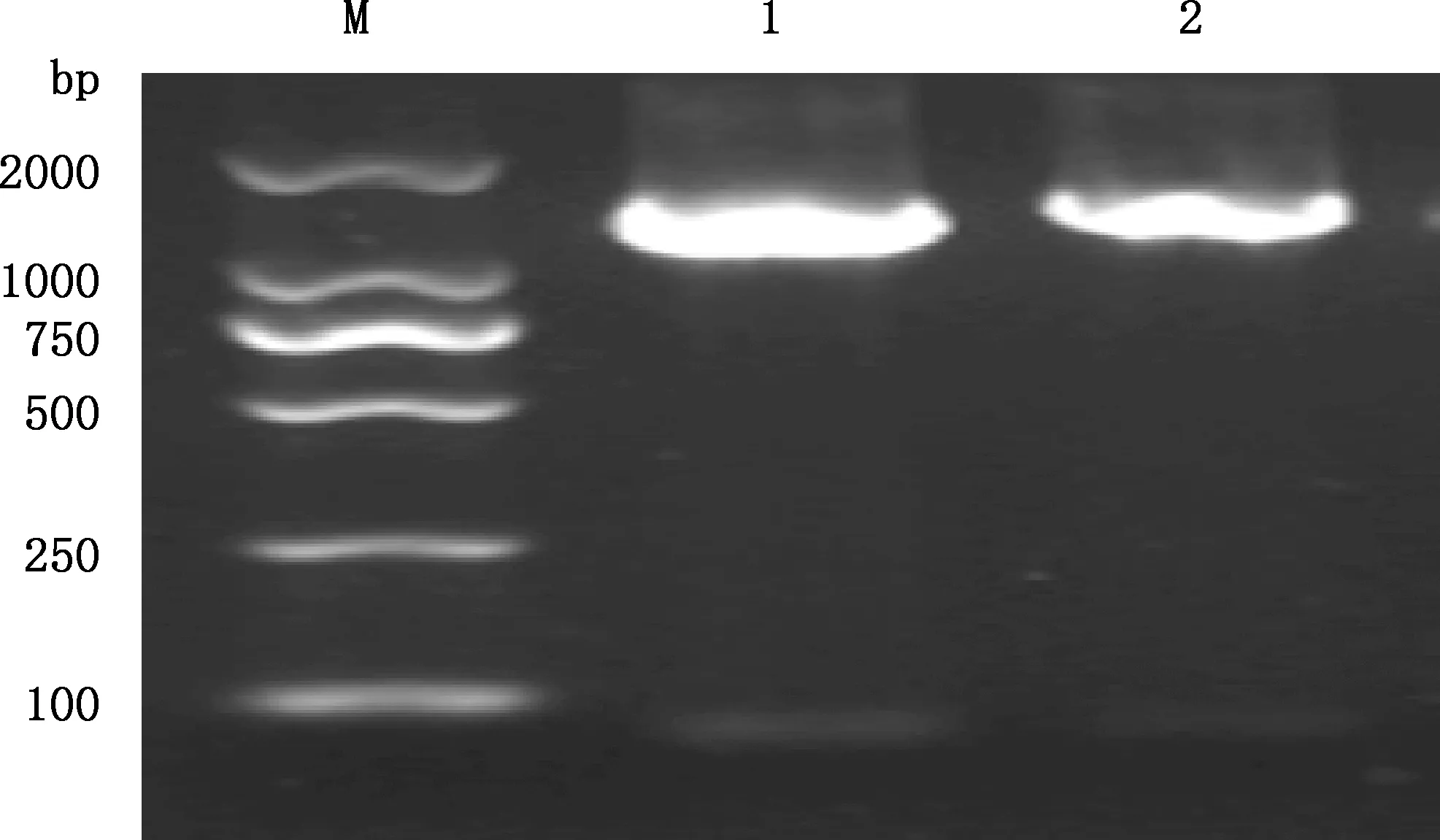
M,DL2000 DNA Marker;1、2,菌株S2 M,DL2000 DNA Marker;1 and 2,Strain S2图2 分离菌株16S rRNA基因PCR扩增结果Fig.2 PCR amplification results of 16S rRNA gene of the isolate
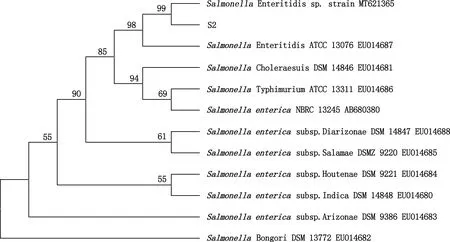
图3 分离菌S2与参考菌株基于16S rRNA基因序列的遗传进化树Fig.3 Phylogenetic tree of the isolated strain S2 and reference strains based on 16S rRNA gene sequence
2.4 毒力基因检测
沙门氏菌毒力基因检测结果显示,菌株S2 13种毒力基因invJ、hilA、ssaB、misL、mgtC、orf319、sopB、spvA、spvB、spvC、spvR、stn和fimA基因均呈阳性,而sopA、fliC这2个毒力基因没有扩增出目的条带(图4)。

M,DL2000 DNA Marker;1~15,分别为invJ、sopA、hilA、ssaB、misL、mgtC、orf319、sopB、fliC、spvA、spvB、spvC、spvR、stn和fimA基因 M,DL2000 DNA Marker;1-15,invJ, sopA, hilA, ssaB, misL, mgtC, orf319, sopB, fliC,spvA, spvB, spvC, spvR, stn and fimA genes,respectively图4 分离菌S2毒力基因检测结果Fig.4 Identification results of virulence gene of S2 strain
2.5 致病性试验结果
致病性试验结果显示,试验组雏鸡在接种4 d后全部开始发病,出现精神萎靡、畏寒症状,接种后6 d雏鸡全部死亡;对照组雏鸡正常生长,未见不良症状。剖检死亡雏鸡可见肝脏坏死点、脾脏肿大出血、肾脏肿大的症状,沙门氏菌培养结果呈阳性。
2.6 药物敏感性试验结果
在测定的15种常用药物中,肠炎沙门氏菌S2株对阿莫西林-克拉维酸、头孢西丁、庆大霉素、环丙沙星、氯霉素、四环素等12种药均敏感,对甲氧嘧啶、复方新诺明和林可霉素耐药(表3)。
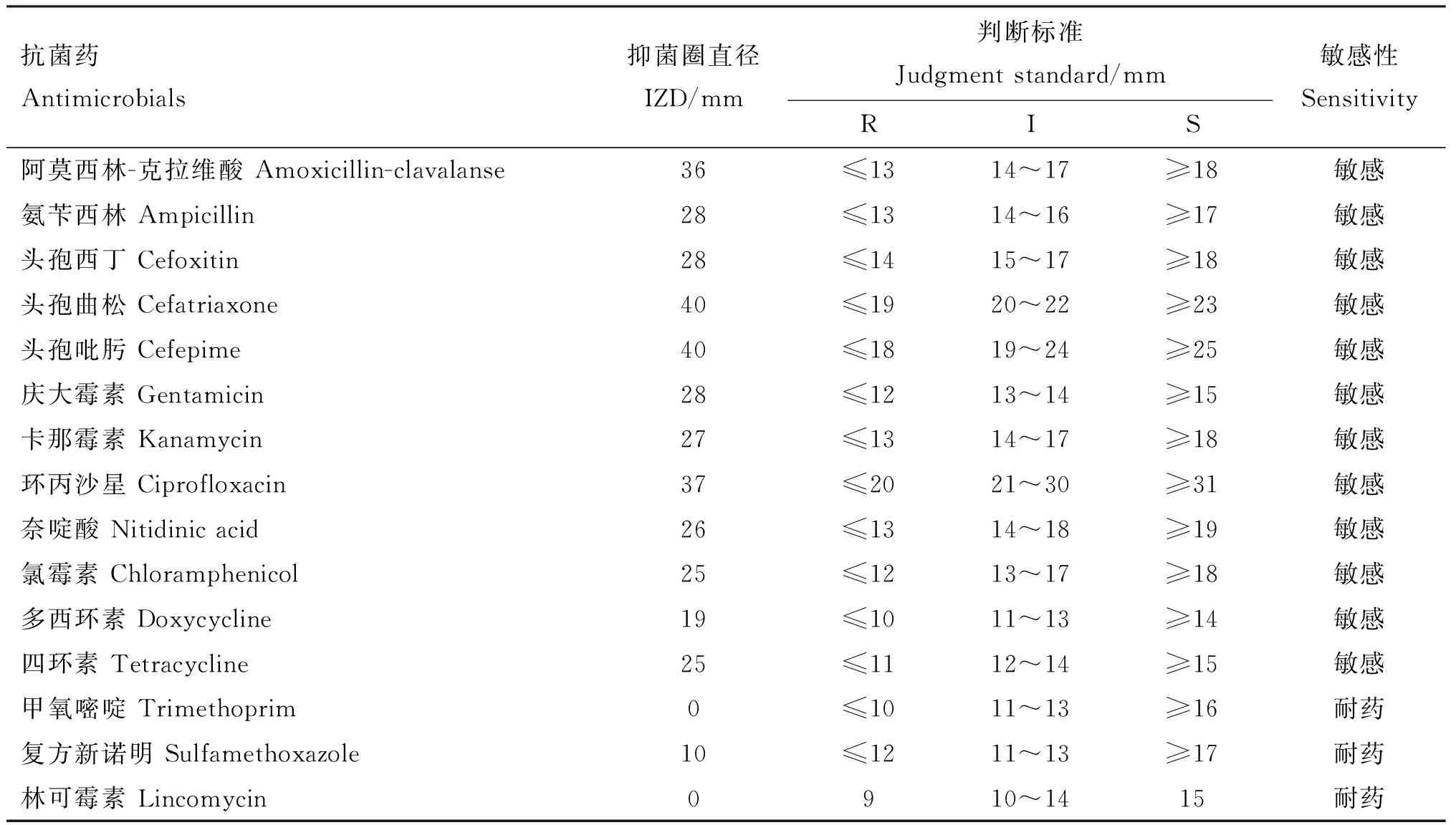
表3 药物敏感性试验结果Table 3 Drug sensitivity test results
3 讨 论
沙门氏菌属肠杆菌科人兽共患革兰氏阴性菌,是食源性疾病的常见病原体,在人上通常引起胃肠性疾病,据统计,在中国有70%~80%的细菌性食物中毒是由沙门氏菌引起的,引起中毒的食品主要为肉、蛋、奶类动物产品[13]。欧盟关于食源性疾病调查显示,肠炎沙门氏菌和鼠伤寒沙门氏菌(SalmonellaTyphimurium)是引起沙门氏菌感染最常见的2种血清型[14-15]。在中国,也有多项研究表明,肠炎沙门氏菌为禽沙门氏菌的优势血清型。如赵建梅等[16]统计了2008-2017年从中国部分地区分离的禽源沙门氏菌分型,结果表明,肠炎沙门氏菌是中国禽沙门氏菌的优势血清型;王迪轩等[17]从华中地区分离的124株沙门氏菌以肠炎沙门氏菌(63.71%)和鸡白痢沙门氏菌(27.42%)为优势血清型。一直以来,肠炎沙门氏菌感染都是世界范围内普遍关注的问题,其流行病学调查具有重要的公共卫生学意义。
本研究从云南某蛋鸡场疑似沙门氏菌病病料中分离出1株肠炎沙门氏菌,并对其致病能力进行了检测。肠炎沙门氏菌宿主谱广泛,在人和禽中的分离率较高,可引发畜禽胃肠炎及人类的肠炎和食物中毒[18]。在禽上,沙门氏菌会引起胃肠道炎症、脾炎、肝炎等疾病,导致鸡免疫功能下降、生长速度降低、死亡率升高[19]。沙门氏菌的致病性与其含有的毒力基因存在着紧密联系,包括毒力岛基因、毒力质粒基因、肠毒素基因等[20]。本研究对分离菌株S2进行了15个毒力基因(invJ、sopA、hilA、ssaB、misL、mgtC、orf319、sopB、fliC、spvA、spvB、spvC、spvR、stn和fimA基因)的检测,其中有2个基因sopA和fliC未被检测到。毒力岛基因invJ、hilA、ssaB、misL、mgtC、orf319、sopB,毒力质粒基因spvA、spvB、spvC、spvR对菌体的致病性均有决定性作用,stn为肠毒素基因,可调节特定血清型菌体产生具有毒性的可溶性蛋白[21];fimA为菌毛基因,可促进细菌对靶位点的黏附和定植[22]。结合动物致病性结果表明,肠炎沙门氏菌菌株S2致病能力较强,对雏鸡的致死率很高,各养殖场应重视并及时做好沙门氏菌的检验和净化工作。
禽源沙门氏菌耐药形势不容乐观,对大部分抗生素的耐药率呈上升趋势[23-25]。研究显示,在中国,禽源沙门氏菌对氨苄西林、四环素、萘啶酸等的耐药率高于50%[26]。汤全英等[27]研究结果显示,在35株肠炎沙门氏菌菌中,氨苄西林/舒巴坦和氨苄西林耐药率为82.9%,四环素和氯霉素的耐药率为71.4%,头孢唑啉耐药率为62.9%,萘啶酸和红霉素耐药率为100%。李廷翠等[28]研究结果显示,肠炎沙门氏菌分离株对青霉素、复方新诺明、强力霉素和四环素4种药物耐药。本研究利用15种抗菌药对分离菌株进行药物敏感性测定,菌株S2对阿莫西林-克拉维酸、头孢西丁、庆大霉素、环丙沙星、氯霉素、四环素等12种抗菌药敏感,对甲氧嘧啶、复方新诺明和林可霉素耐药,这与上述文献报道的肠炎沙门氏菌具有多重耐药性的结果一致,但耐药药物种类有差别,这可能与不同养殖场的抗菌药使用有一定关系。临床用药应根据实际情况而定,建议养殖场定期开展细菌药敏监测,筛选高度敏感药物进行治疗,并且制定合理、科学的使用方法。
4 结 论
本研究分离到1株肠炎沙门氏菌,其毒力较强,携带invJ、hilA、ssaB等毒力基因,用4.2×108CFU/mL的分离菌攻毒健康雏鸡,雏鸡死亡率达100%,同时引起雏鸡肝脏、脾脏、肾脏等组织发生不同程度的病变。分离株对阿莫西林-克拉维酸、头孢西丁、庆大霉素等抗菌药敏感,对甲氧嘧啶、复方新诺明和林可霉素耐药。

