DTI预测及评估宫颈癌新辅助化疗疗效反应的价值
黄秋晗,冯翠,胡道予,王艳春
宫颈癌(cervical cancer,CC)在全球女性中的发病率和死亡率居第四位,是女性最常见的生殖系统恶性肿瘤[1]。新辅助化疗(neoadjuvant chemoradiotherapy,NACT)已越来越广泛地应用于局部晚期宫颈癌的治疗[2],尤其是年轻女性,以减小肿瘤体积和降低肿瘤分期,使患者获得更好的治疗机会。据报道NACT有效率为70%[3],然而NACT治疗仍然存在争议,NACT无反应者可能导致肿瘤进展,使手术难度增加或延误放疗时机[4]。因此,如何在治疗前早期预测NACT疗效反应,对于宫颈癌患者个性化治疗方案的制订具有重要意义[5]。
研究表明MRI弥散加权成像(diffusion weighted imaging,DWI)相关参数、动态增强MRI(dynamic contrast enhanced MRI,DCE-MRI)相关参数以及肿瘤体积变化对预测宫颈癌NACT疗效具有一定价值[5-8]。然而,由于肿瘤的生物异质性,基于DWI的ADC值对预测局部晚期宫颈癌的疗效反应仍有争议[5]。扩散张量成像(diffusion tensor imaging,DTI)是描述活体组织微观结构的无创检查方法,能更加立体的显示及观察病变,其定量参数主要为表观扩散系数(apparent diffusion coefficient,ADC)和部分各向异性分数(fractional anisotropy,FA),能够量化人体水分子的扩散速度和方向,反映组织微观结构及功能信息,近年来DTI应用于子宫的研究也逐渐增加[9,10]。然而,DTI在宫颈癌NACT疗效评估上的研究相对较少,因此,本文旨在评估DTI定量参数对预测、评估宫颈癌NACT疗效反应的价值,为临床在治疗前预测肿瘤对NACT的敏感性提供一定帮助,为患者提供更好的治疗方案。
材料与方法
1.研究对象
本研究经华中科技大学同济医院伦理委员会批准,入组患者签署知情同意书。回顾性搜集2013年3月至2014年9月患者,纳入标准:①病理活检证实为宫颈癌并行NACT治疗;②肾、肝、心、肺和血液功能正常;③NACT治疗前一周内、治疗两周期后3~4周内行MRI检查。排除标准:①图像质量欠佳;②肿瘤体积较小,无法勾画完整感兴趣区(region of interest,ROI);③MRI影像资料不完整。最终纳入36例患者,同时搜集患者的临床病理资料,包括年龄、月经状态、FIGO分期、病理类型以及治疗前SCC指标。
2.NACT治疗方案
NACT治疗方案:第1天静脉注射顺铂(75 mg/m2),第1、2和3天静脉注射多西紫杉醇(25 mg/m2)。NACT包含两个化疗周期,每个化疗周期间隔3周。
3.MRI扫描方法
所有患者均于NACT治疗前1周内和NACT治疗2周期后3~4周内行MRI扫描,采用3.0T MRI(GE Healthcare 750 Discovery,Milwaukee,Wisconsin,USA)扫描仪和32通道相控阵体部线圈。检查前嘱咐患者憋尿,使膀胱适度充盈。扫描序列包括常规轴面T1WI,冠状面、矢状面和轴面T2WI,以及轴面DTI。轴面T1WI扫描参数:TR/TE 360 ms/7.7 ms;层厚/间距3 mm/1 mm;FOV 340 mm×340 mm;矩阵256 ×256;带宽50 kHz。冠状面T2WI扫描参数:TR/TE 68 ms/2600 ms;层厚/间距4 mm/1 mm;FOV 300 mm×300 mm;矩阵320×256;带宽62.5 kHz。矢状面T2WI扫描参数:TR/TE 6181 ms/130 ms;层厚/间距4 mm/0.4 mm;FOV 240 mm×240 mm;矩阵320×320;带宽62.5 kHz。轴面T2WI扫描参数:TR/TE 5004 ms/68 ms;层厚/间距3 mm/1 mm;FOV 340 mm×340 mm;矩阵320×256;带宽62.5 kHz。轴面DTI扫描参数:TR/TE 6000 ms/75.1 ms;层厚/间距3.6 mm/1 mm;FOV 360 mm×360 mm;矩阵192×160;带宽250 kHz;b=700 s/mm2;梯度方向数6次;激励次数2次;扫描时间2 min 34 s。
4.图像分析
将所有患者MRI图像数据传输至GE工作站(Advance Workstation 4.6,GE Medical System,Milwaukee,WI,USA)。将DTI数据集输入Function Tool 软件,选择扩散张量界面,自动生成ADC、FA图。DTI定量参数通过在ADC、FA图上选取肿瘤最大层面并沿肿瘤边缘手动勾画感兴趣区(ROI)来测量,且避开囊变、坏死、出血以及伪影区域[11]。图1和图2分别为有效组和无效组病变的示例。肿瘤大小定义为在冠状面、矢状面或轴面T2WI图像上测量的肿瘤最大直径。1位有5年临床MRI经验的腹部放射科医生为每位患者测量3次,最终ADC值、FA值以及肿瘤最大直径取3次测量的平均值。
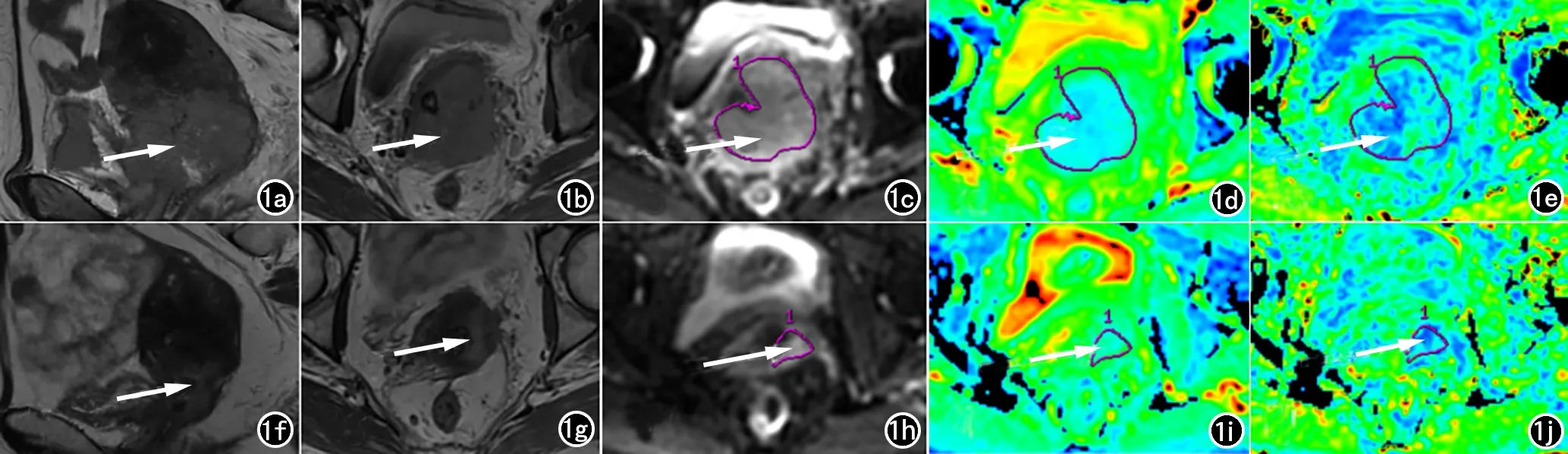
图1 患者,女,55岁,宫颈鳞状细胞癌IVA期,NACT治疗有效组。a) NACT前病灶矢状面T2WI图像(箭, 肿瘤最大直径61mm); b) NACT前病灶轴面T2WI图像(箭); c) NACT前b=700s/mm2时病灶DTI图像(箭);d) NACT前病灶ADC伪彩图(箭,ADC平均值1.030×10-3mm2/s);e) NACT前病灶FA伪彩图(箭,FA平均值0.147);f) NACT后病灶矢状面T2WI图像(箭, 肿瘤最大直径34mm);g) NACT后病灶轴面T2WI图像(箭);h) NACT后b=700s/mm2时病灶DTI图像(箭);i) NACT后病灶ADC伪彩图(箭,ADC平均值1.330×10-3mm2/s);j) NACT后病灶FA伪彩图(箭,FA平均值0.154)。
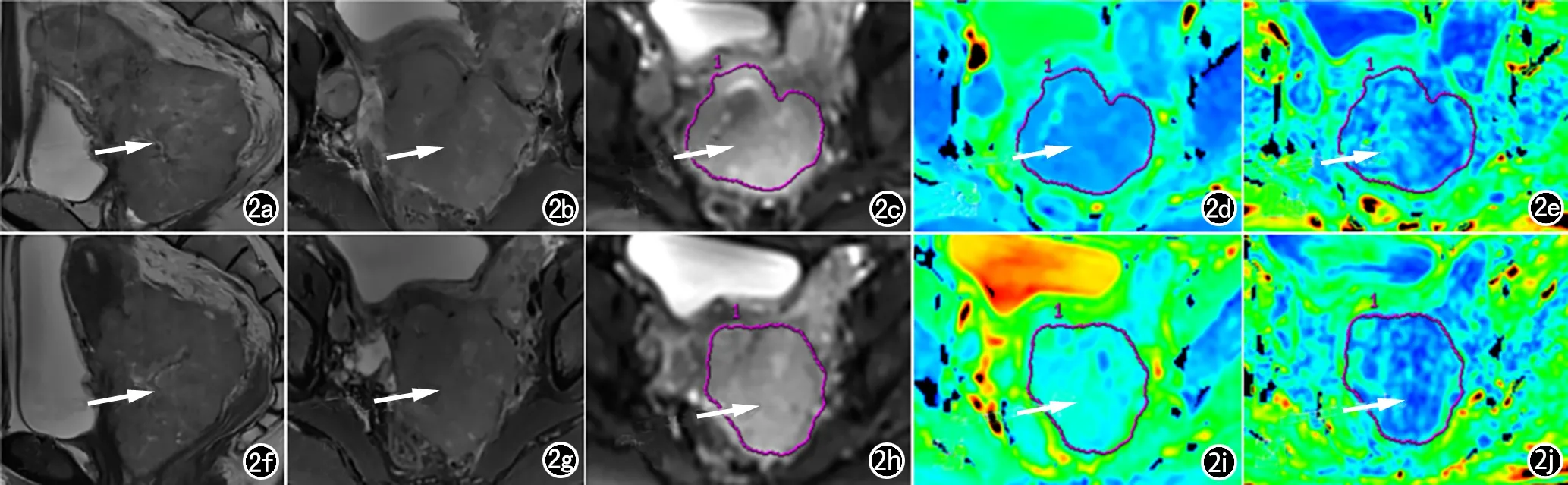
图2 患者,女,41岁,宫颈鳞状细胞癌IIIB期,NACT治疗无效组。a) NACT前病灶矢状面T2WI图像(箭,肿瘤最大直径97mm);b) NACT前病灶轴面T2WI图像(箭);c) NACT前b=700s/mm2时病灶DTI图像(箭);d) NACT前病灶ADC伪彩图(箭,ADC平均值0.645×10-3mm2/s);e) NACT前病灶FA伪彩图(箭,FA平均值0.110);f) NACT后病灶矢状面T2WI图像(箭, 肿瘤最大直径80mm);g) NACT后病灶轴面T2WI图像(箭);h) NACT后b=700s/mm2时病灶DTI图像(箭);i) NACT后病灶ADC伪彩图(箭,ADC平均值1.120×10-3mm2/s);j) NACT后病灶FA伪彩图(箭,FA平均值0.103)。
5.疗效反应分析
在NACT治疗前和NACT治疗2周期结束后3~4周内,分别测量MRI图像上肿瘤大小以确定疗效反应。根据RECIST标准[12],临床上将疗效反应分为4种类型:①完全缓解(complete response,CR) ,无残留肿瘤;②部分缓解(partial response,PR),肿瘤最大直径之和<原始大小的70%;③疾病稳定(stable disease,SD),肿瘤最大直径之和缩小未达PR,或增大未达疾病进展(progressive disease,PD);④疾病进展(PD),肿瘤最大直径之和至少增加20%。将CR或PR患者归为治疗有效组,SD和PD患者归为治疗无效组。
6.统计学分析
结 果
1.临床特征
总共纳入36例患者,治疗有效组20例(CR:3例,PR:17例 ),治疗无效组16例(SD:14例,PD:2例)。所有患者的平均年龄51±9岁,19例患者未绝经,17例患者已绝经。据国际妇产科联盟(FIGO 2018)分期[13],纳入的患者中ⅠB期2例,ⅡA期2例,ⅡB期15例,ⅢA期3例,ⅢB期12例,Ⅳ期2例。31例患者为宫颈鳞状细胞癌,5例患者为宫颈腺癌。据宫颈鳞状细胞癌相关抗原(SCC)检查结果,SCC ≤1.5 ng/mL的患者11例,SCC≥1.5 ng/mL的患者25例。
2.有效组与无效组临床参数的比较
有效组平均年龄53±7岁,无效组平均年龄47±10岁,年龄组间差异具有统计学意义(t=-2.082,P=0.045)。NACT治疗前,有效组SCC指标低于无效组,差异具有统计学意义(χ2=4.425,P=0.035)。月经状态、FIGO分期以及病理类型在有效组和无效组之间差异无统计学意义(P>0.05,表1)。
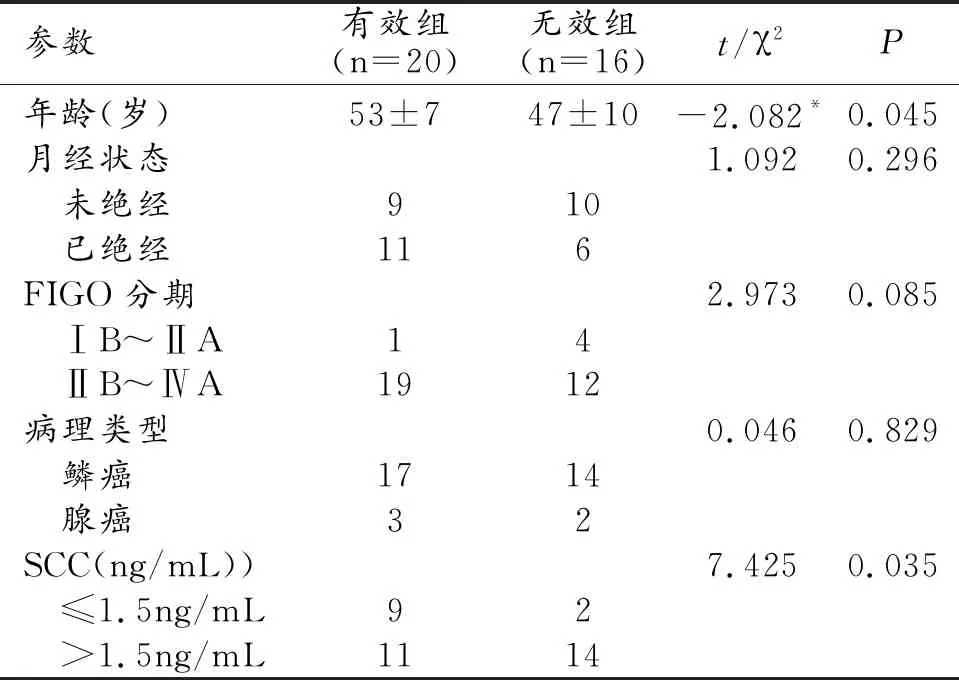
表1 NACT治疗有效组和无效组临床参数的比较
3.有效组和无效组ADC值、FA值以及肿瘤最大直径的比较
NACT治疗前和治疗后,ADC值在有效组和无效组之间的差异具有统计学意义(P<0.05),有效组较无效组具有更高的ADC值,而FA值在两组间差异无统计学意义(P>0.05);治疗前肿瘤大小在两组间无明显差异,而治疗后有效组肿瘤最大直径明显小于无效组(P<0.001,表2)。NACT治疗后肿瘤ADC值较治疗前明显升高,差异具有统计学意义(P<0.001);治疗后肿瘤最大直径较治疗前明显减小,差异具有统计学意义(P<0.001);FA值在治疗前和治疗后无明显变化,差异无统计学意义(P>0.05,表3)。
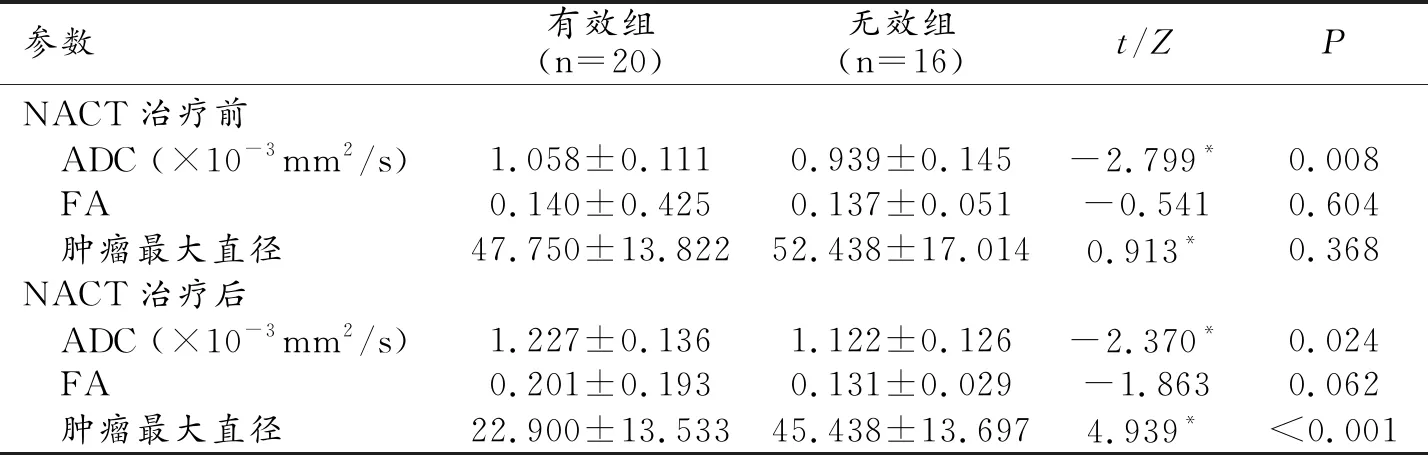
表2 NACT治疗有效组和无效组DTI参数以及肿瘤大小的比较
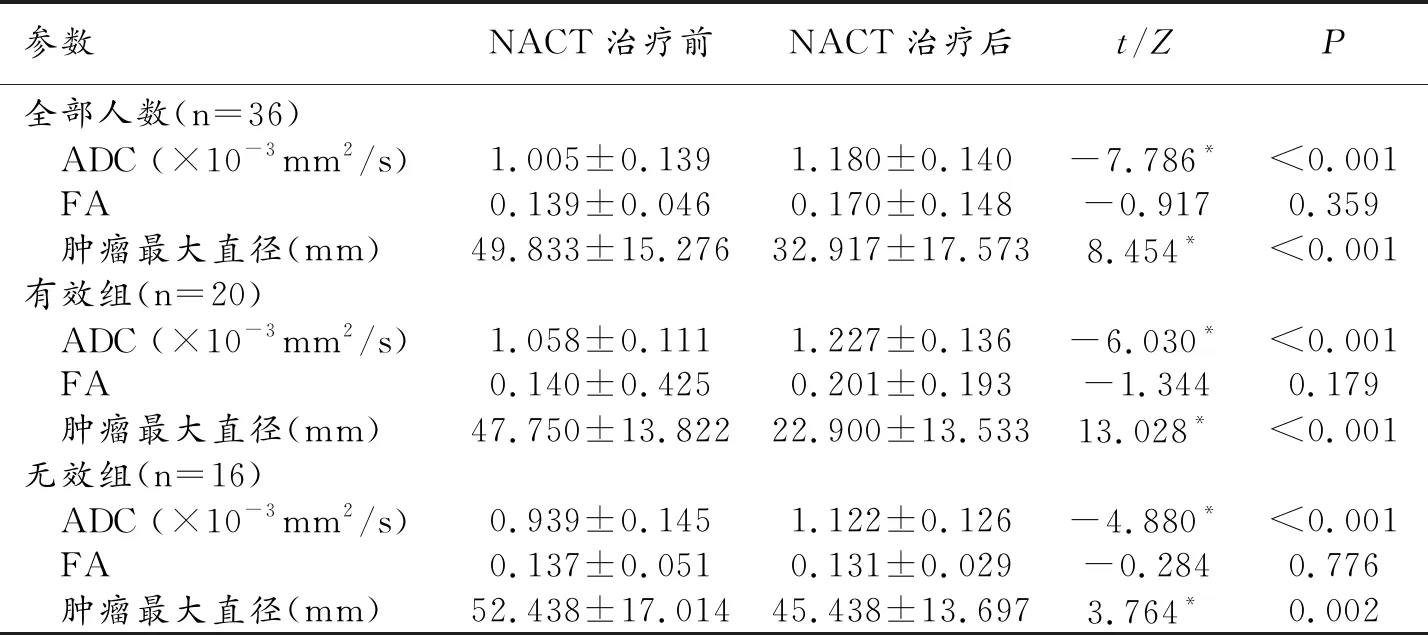
表3 NACT治疗前、后DTI相关参数以及肿瘤最大直径的比较
4.DTI参数以及临床因素预测宫颈癌NACT疗效的诊断效能
治疗前ADC值预测NACT疗效的诊断效能较高,其AUC为0.750,且具有统计学意义(P=0.002),敏感度、特异度分别为50%、93.75%(图3a)。治疗后ADC值以及FA值预测NACT疗效的AUC分别为0.719、0.683,具有统计学意义(P=0.012、0.048),两者敏感度分别为80%、62.5%,特异度分别为62.5%、81.2%(图3b)。临床因素中NACT治疗后肿瘤最大直径和治疗前SCC指标预测NACT疗效的AUC分别为0.891、0.663,且具有统计学意义(P<0.0001、P=0.023),敏感度分别为90%、45%、特异度分别为75%、87.5%(图3c)。NACT治疗前ADC值联合SCC预测NACT疗效的AUC为0.802,且具有统计学意义(P<0.001),且预测NACT疗效的敏感度、特异度分别为90%、62.5%,与单独ADC值和SCC指标相比,联合指标提高了预测NACT疗效的诊断效能(图3d,表4)。
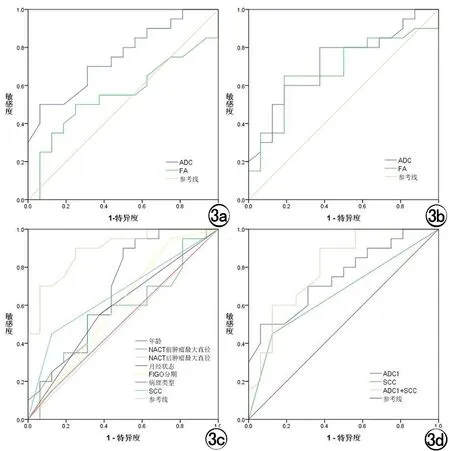
图3 a)治疗前ADC值、FA值预测NACT疗效的ROC曲线;b)治疗后ADC值、FA值预测NACT疗效的ROC曲线;c)治疗前临床因素预测NACT疗效的ROC曲线;d)治疗前ADC值、SCC以及两者结合的联合指标预测NACT疗效的ROC曲线。
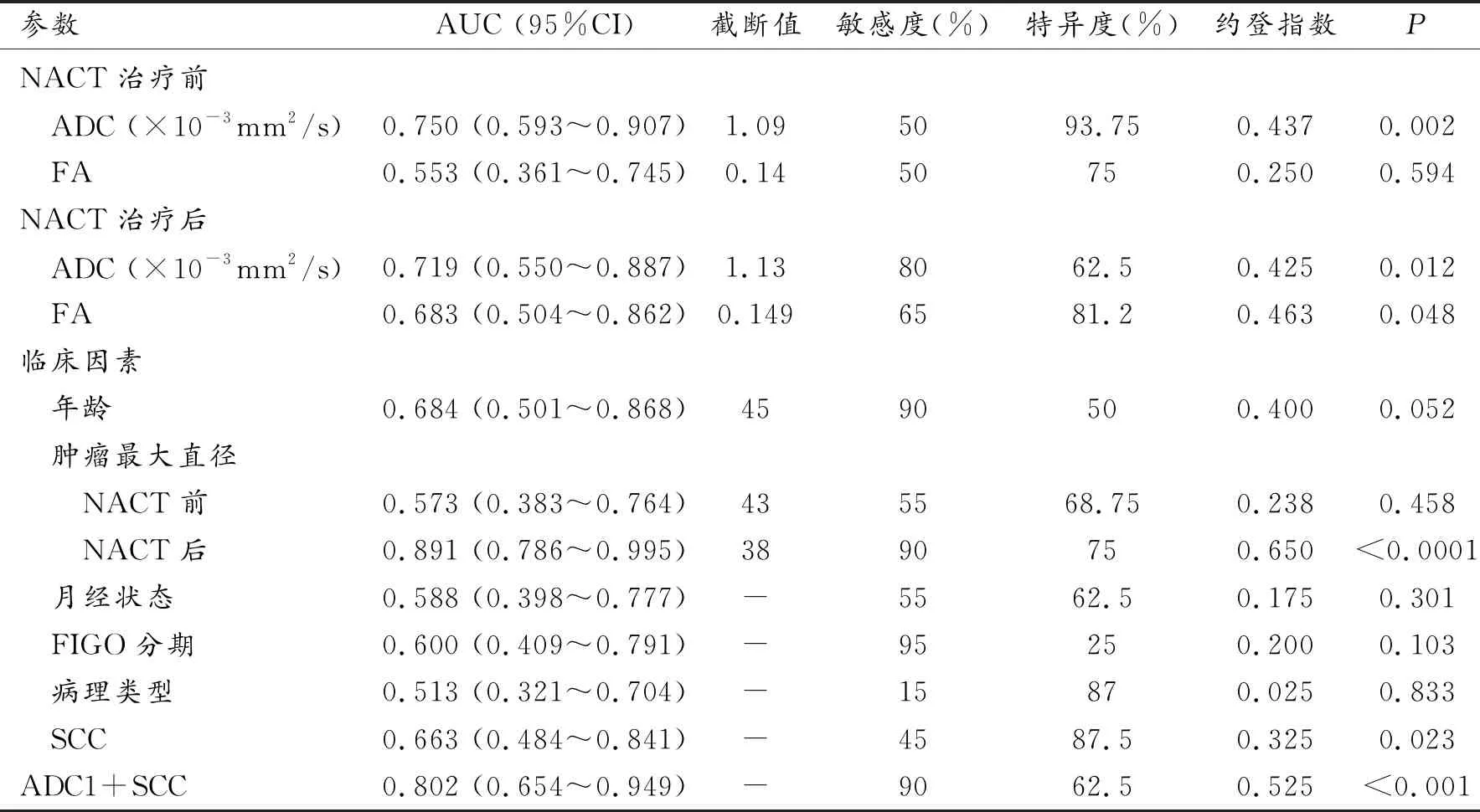
表4 DTI各参数以及临床因素预测宫颈癌NACT疗效的诊断效能
讨 论
本研究评估了DTI定量参数以及临床因素对预测宫颈癌NACT疗效反应的价值,结果表明ADC值以及治疗前SCC指标有助于预测及评估宫颈癌NACT的疗效反应,且具有较好的诊断效能;治疗前ADC值联合SCC指标在预测NACT疗效反应上具有更高的诊断效能。
研究表明无论NACT治疗前还是治疗后,有效组的ADC值均高于无效组(P<0.05)。以往的研究显示ADC值可反映水分子的扩散受限程度和肿瘤细胞的密度[14,15],ADC值越低,肿瘤恶性程度越高[16]。而有效组具有较高的ADC值,说明有效组肿瘤恶性程度低于无效组,对化疗更敏感。已有研究采用IVIM-DWI,测量其定量参数ADC、D、D*、f等评估预测宫颈癌NACT疗效反应[6],或采用DEC-MRI影像方法[17-19],测量Ktrans、Kep等定量参数来评估疗效反应。然而由于肿瘤的异质性,基于DWI的定量参数研究有时会出现具有争议的结果,而DEC-MRI会受到对比剂的影响。因此,我们的研究创新性地采用DTI,其本身是DWI技术改进和发展而来,比常规DWI更具有优势,并且相比DEC-MRI,是无创性检查,能定量分析肿瘤组织微环境的变化[20],更有利于精准诊疗。研究中治疗后的ADC值大于治疗前,而肿瘤最大直径则比治疗前明显减小(P<0.001),这一结论与前人研究结果一致[14,21]。有研究表明宫颈癌NACT治疗后ADC值升高,可能是由于化疗药物破坏肿瘤细胞,使肿瘤细胞通透性增加[22],而肿瘤细胞大量死亡也会造成细胞密度减低,这些因素都导致了水分子扩散受限程度降低,因而使ADC值增加[23]。金艳等[24-26]研究表明宫颈癌化疗后 ADC值的变化率与疗效反应呈正相关。因此,ADC值可以在分子水平早期预测NACT疗效。
本研究还分析了临床因素对预测NACT疗效的作用,表明了SCC可作为预测NACT疗效的独立预测因子。有研究表明SCC对宫颈癌化疗疗效和预后都有影响[17,27-29]。SCC是反映鳞状细胞癌生物学特性的重要肿瘤标志物[30],因此可以认为SCC主要在宫颈鳞癌中对NACT疗效预测有效。研究发现治疗无效组SCC阳性率较治疗有效组高,说明治疗无效组肿瘤恶性程度更大,NACT疗效较差。将治疗前ADC值与SCC指标相结合,所得到的联合指标诊断效能优于单独的ADC和SCC,表明联合指标是预测NACT疗效的具有前景的预测指标。
本研究存在一定局限性。首先,样本量较少,未来的研究中将继续扩大样本量;其次,本次研究为单中心研究,需要前瞻性的多中心研究进一步验证我们的结果。另外,本次研究仅分析DTI定量参数,未能结合其他序列,未来将加入新序列进行联合研究。
综上所述,DTI定量参数ADC值以及临床因素SCC指标可在治疗前预测及评估宫颈癌NACT的疗效反应,这两者的联合指标在预测NACT疗效方面具有更高的诊断效能,有望为宫颈癌NACT治疗方案的选择提供更有效的依据。

