骨密度和肝脏脂肪含量与内脏脂肪含量相关性定量CT研究
祝凤玲, 王植, 孟祥虹, 徐华, 仲玉侨, 樊红星
骨质疏松症(Osteoporosis,OP)是以骨量减少、骨质量受损及骨强度降低导致骨脆性增加、易发生骨折为特征的全身性骨病[1]。人口老龄化日益加重,OP已越来越多地引起广泛关注。非酒精性脂肪肝病(non-alcoholic fatty liver disease,NAFLD)在西方国家已成为慢性肝病的主要病因,代谢综合征(metabolic syndrome,MS)是以腹型肥胖、糖耐量减退、高血压和血脂异常等病变为主的全身疾病,对于腹型肥胖者而言,内脏脂肪组织含量增多(visceral adipose tissue,VAT)为心血管疾病的重要危险因素。研究指出[2-5]OP、NAFLD和MS发病机制相似,如均受到胰岛素抵抗、慢性炎症和体力活动不足等因素的影响,三者密切相关、互相影响、互相作用。
定量CT(quantitative computed tomography,QCT)是利用临床CT扫描的数据,结合QCT的质控体模和软件分析系统测量骨密度的方法。QCT和临床常规CT扫描同步进行,无额外增加的辐射剂量,患者依从性好。目前的QCT设备可一次扫描完成腰椎骨密度、肝脏脂肪含量和腹部内脏脂肪含量的定量测量[6-7]。
但对于OP、NAFLD和MS的大部分研究集中在绝经后女性BMD与VAT的相关性上,而在不同性别间OP、NAFLD和MS之间相关性研究较少。本研究拟应用QCT定量测量、分析不同性别间正常受试者和骨量减低、骨质疏松患者的骨密度、肝脏脂肪含量和内脏脂肪含量相关性。
材料与方法
1.入排标准
回顾性搜集2020年4月-2021年8月因拟入院而行胸部CT平扫及因退变、外伤等原因行胸腰段CT平扫的患者。排除胸、腰椎骨折、手术、感染、肿瘤等疾病患者;排除既往患有病毒性肝炎、自身免疫性肝病、酒精性肝病、药物或毒素诱导性肝损害和肝细胞癌患者。
2.影像学检查
胸部CT平扫采用美国GE公司 64排螺旋 CT(CT660,GE Healthcare,Milwaukee,WI,USA)进行数据采集,视野50 cm,重建视野38 cm,管电压120 kV,管电流200~300 mA,据患者体重自动调节。扫描范围从第1肋骨上方2 cm至第3腰椎下缘水平,应用标准算法进行扫描,层厚1.25 mm。胸腰段CT平扫视野50 cm,重建视野38 cm,管电压120 kV,管电流300 mA,扫描范围自胸11椎体上缘至腰3椎体下缘,应用标准算法进行扫描,层厚1.25 mm。扫描完成后,将数据上传至美国Mindways QCT PRO V6.1工作站。
3.数据测量
由两名经过培训的高年资放射科医师(MXH,从事骨肌系统影像诊断12年;WZ,从事骨肌系统影像诊断33年)完成以下测量,测量结果取二者平均值:
选定要测量的腰1-3椎体,手动选择ROI,ROI中不包含骨岛、椎静脉、病损区域等(图1) 。所有受试者据QCT测量得到的腰椎骨密度平均值分为3组。①骨量正常组:骨密度>120 mg/mm3;②骨量减低组:骨密度80~120 mg/mm3;③骨质疏松组:骨密度<80 mg/mm3[8]。在肝脏显示最大层面,共测量4个ROI,3个放在肝右叶,1个放在肝左叶。在肝右叶,ROI放置在肝右叶的中间位置,需避开胆囊窝以及肝脏边缘空气干扰,ROI面积不宜过大或过小。测量过程中如发现轻微改变ROI的位置或大小,肝脏脂肪测量结果即发生明显变化时,更换层面重新测量(图2)。腰3椎体中部层面进行VAT数据测量[9](图3)。

图1 应用QCT进行腰1-3椎体骨密度测量。a) 腰1横断面ROI选择; b) 腰2横断面ROI选择; c) 腰3横断面ROI选择; d) 腰1矢状面ROI选择; e) 腰2矢状面ROI选择; f)腰3矢状面ROI选择; g)腰1冠状面ROI选择; h)腰2冠状面ROI选择; i)腰3冠状面ROI选择。
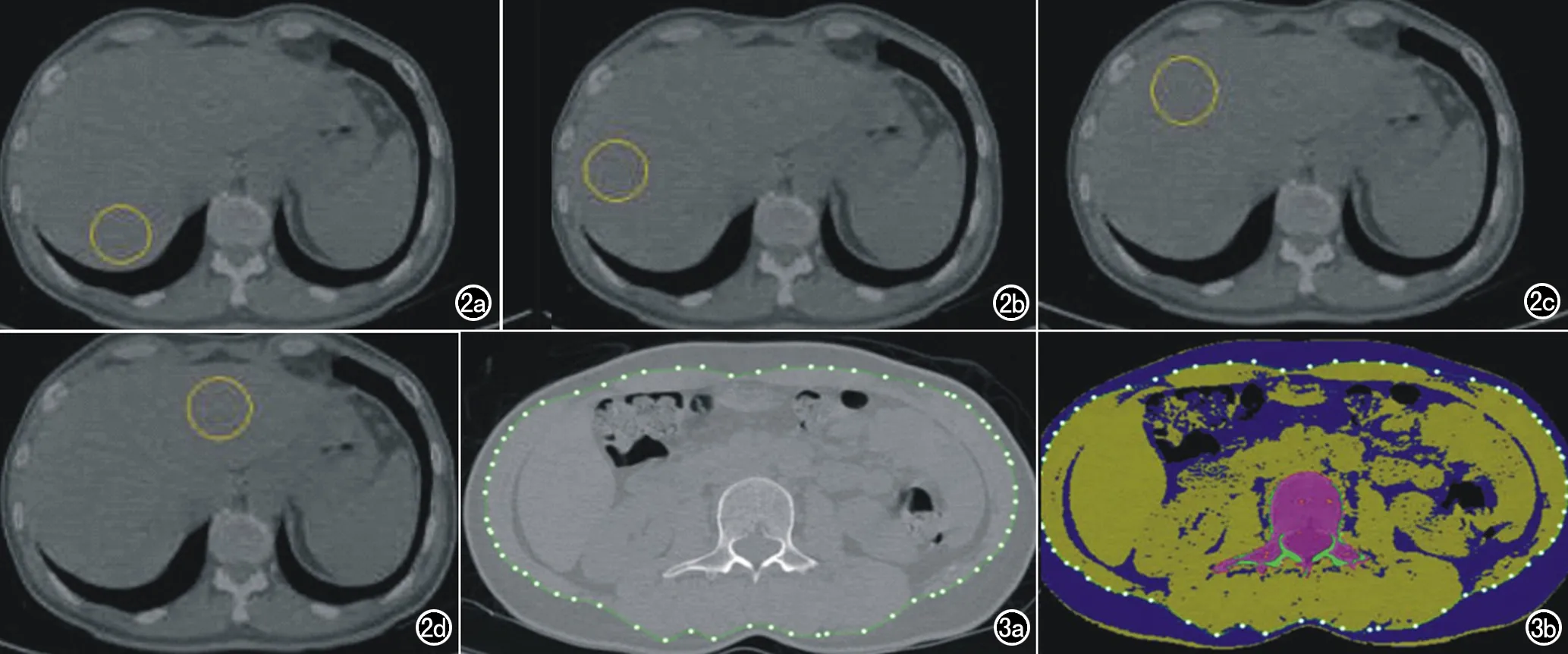
图2 肝脏脂肪含量QCT测量。共测量4个ROI,3个放在肝右叶,1个放在肝左叶。a)肝右叶选择第一个ROI;b) 肝右叶选择第二个ROI;c) 肝右叶选择第三个ROI;d)肝左叶选择一个ROI。 图3 应用QCT在腰3椎体中部层面进行内脏脂肪组织含量测量。a) 选择内脏脂肪含量进行测量的影像图; b) 选择内脏脂肪含量进行测量伪彩图。
4.统计学方法
本研究应用SPSS 26.0(IBM公司,美国)软件进行统计学分析。采用单因素方差分析及LSD检验分别观察男、女性受试者骨量正常、骨量减低、骨质疏松3组肝脏脂肪含量和内脏脂肪含量有无区别; 检验测量数据是否符合正态分布,若符合正态分布,采用Pearson相关分析骨密度、肝脏脂肪含量、内脏脂肪含量在男、女性受试者中有无相关性。P<0.05为差异有统计学意义。
结 果
1.一般资料
本研究共纳入男受试者398人,年龄20~85岁,平均50.0±16.3岁。骨量正常组230人,年龄20~85岁,平均41.7±13.5岁;骨量减低组118人,年龄27~80岁,平均58.0±12.6岁;骨质疏松组50人,年龄49~85岁,平均69.3±8.5岁。
女受试者468人,年龄21~91岁,平均53.5±16.0岁。骨量正常组219人,年龄21~71岁,平均39.0±10.5岁;骨量减低组127人,年龄30~84岁,平均61±7.9岁;骨质疏松组122人,年龄48~91岁,平均69.9±7.3岁。
2.男骨量正常、骨量减低、骨质疏松组间肝脏脂肪含量及VAT含量的差异
肝脏脂肪含量在3组间差异无统计学意义(F=1.248,P=0.288)。VAT含量3组之间差异有统计学意义(F=19.486,P<0.001),骨量正常与骨量减低组(P<0.001),骨量正常与骨质疏松组(P<0.001)差异有统计学意义,骨量减低及骨质疏松组的VAT含量明显高于骨量正常组(表1)。

表1 男受试者骨量正常、骨量减低、骨质疏松组间肝脏脂肪含量及VAT含量的差异
3.女骨量正常、骨量减低、骨质疏松组间肝脏脂肪含量及VAT含量的差异
肝脏脂肪含量3组之间差异有统计学意义(F=6.686,P=0.001),骨量正常与骨量减低组(P=0.001)及骨量正常与骨质疏松组(P=0.015)间差异均有统计学意义,骨量减低、骨质疏松组肝脏脂肪含量高于骨量正常组。VAT含量3组之间差异有统计学意义(F=85.228,P<0.001),骨量正常与骨量减低组(P<0.001),骨量正常与骨质疏松组(P<0.001)差异均有统计学意义,骨量减低及骨质疏松组的VAT含量明显高于骨量正常组(表2)。

表2 女受试者骨量正常、骨量减低、骨质疏松组间肝脏脂肪含量及VAT含量的差异
4.男BMD、肝脏脂肪含量和VAT含量的相关性分析
男BMD与肝脏脂肪含量(R=-0.057,P=0.258)无相关;BMD与VAT含量(R=-0.309,P<0.001)呈负相关;肝脏脂肪含量与VAT含量(R=0.450,P<0.001)呈正相关(图4)。
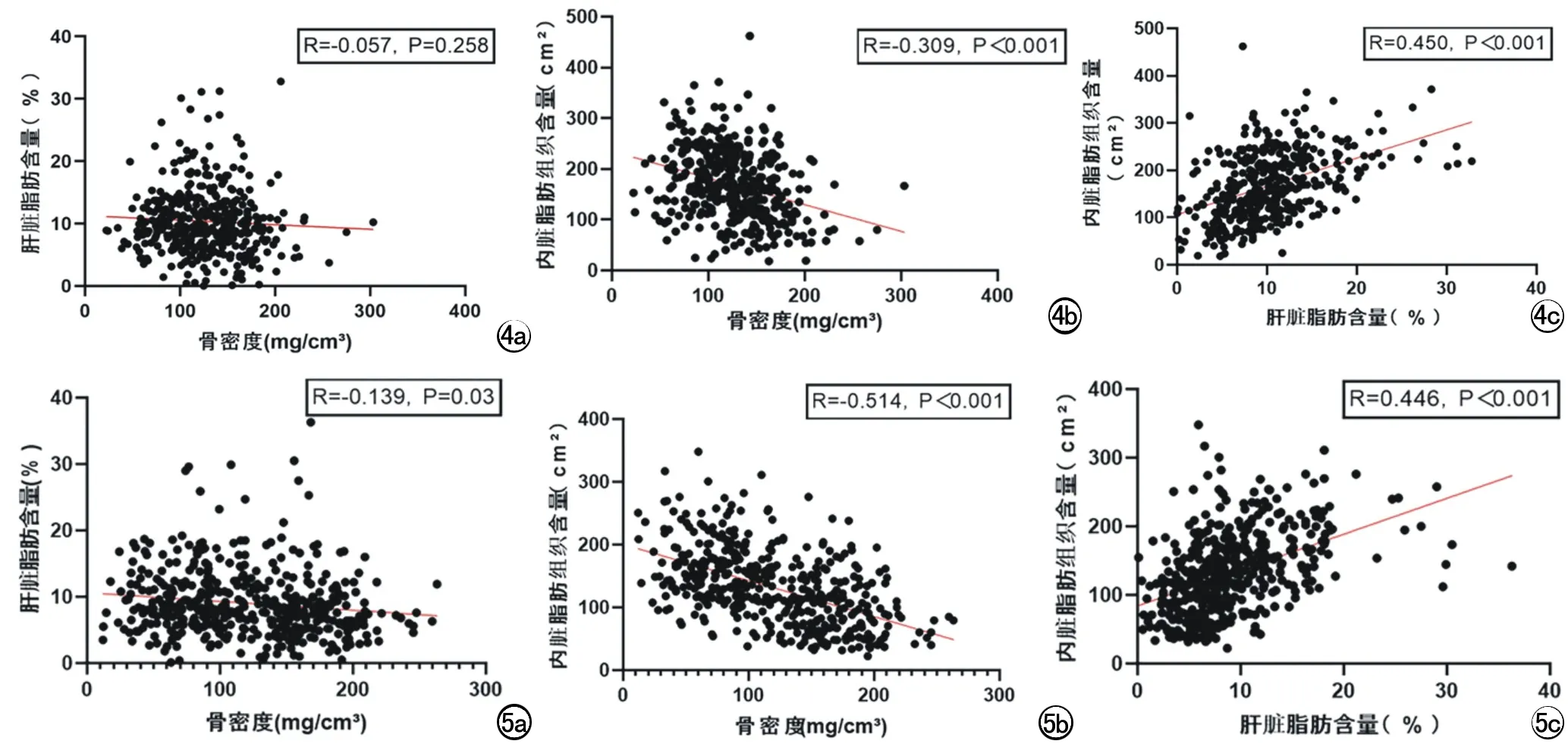
图4 男BMD、肝脏脂肪含量和VAT含量的相关性分析。a)男骨密度与肝脏脂肪含量的相关性分析散点图; b)男骨密度与内脏脂肪组织含量相关性分析散点图; c)男肝脏脂肪含量与内脏脂肪组织含量相关性分析散点图。 图5 女BMD、肝脏脂肪含量和VAT含量的相关性分析。a)女骨密度与肝脏脂肪含量的相关性分析散点图; b)女骨密度与内脏脂肪组织含量相关性分析散点图; c)女肝脏脂肪含量与内脏脂肪组织含量相关性分析散点图。
5.女BMD、肝脏脂肪含量和VAT含量的相关性分析
女BMD与肝脏脂肪含量(R=-0.139,P=0.03)、BMD与VAT含量(R=-0.514,P<0.001)均呈负相关;肝脏脂肪含量与VAT含量(R=0.446,P<0.001)呈正相关(图5)。
讨 论
QCT[10-11]是利用临床CT扫描的数据,结合QCT的质控体模和软件分析系统测量骨密度的方法,QCT可以测量多个部位的骨密度,目前应用比较多的是脊柱和髋部,单独测量胸腰段椎体骨密度即可反应全身骨密度情况。腰椎QCT诊断OP的标准由国际临床骨密度学会[12]于2007年提出,并在中国人群中得到验证,证明该标准适用于中国人群。椎体QCT测量的是椎体中央松质骨的体积骨密度, 单位是mg/cm3。QCT测量的是真正的体积骨密度,测量结果不受脊柱退变、侧弯和体重等因素的影响,可以减少漏诊。DXA[13]只能测量二维的骨密度(mg/cm2),因此很容易受到骨大小、脊柱退变、椎体变形、腹主动脉钙化等因素的影响,这些因素往往会导致测量结果的不准确,尤其是对老年人。以骨小梁数作为骨质疏松症的测量指标,QCT可分别测量骨小梁和皮质骨密度,它可以提供早期骨量的变化的程度,较DXA能更早、更准确地反应BMD的变化。随着设备的发展,目前的QCT设备可在不增加辐射剂量和费用的基础上,在进行骨密度测量的同时准确、定量测量肝脏脂肪含量和VAT含量。同时有研究指出脊柱QCT的骨质疏松检出率高于DXA[14]。
本研究发现男受试者骨量减低、骨质疏松组VAT含量明显高于骨量正常组,骨密度越低,VAT含量越高,而肝脏脂肪含量在3组间无统计学差异。而对于女受试者,骨量减低、骨质疏松组肝脏脂肪及VAT含量明显高于骨量正常组,骨密度越低,肝脏脂肪和VAT含量越高。
目前,国内外学者对BMD、肝脏脂肪含量及VAT含量之间的关联进行研究。Sung等[15]认为NAFLD和BMD之间没有相关,但调整了混杂因素后,NAFLD与女性BMD有较低的相关,与本研究有所不同。本研究男BMD与肝脏脂肪含量无相关,女BMD与肝脏脂肪呈负相关。原因可能与BMD和肝脏脂肪含量的测量方法不同有关,本研究采用的是QCT测量,而Sung等的研究是用超声诊断脂肪肝,用DXA测量骨密度。洪玉芹等[16]通过 CT 定量探讨腹部脂肪分布与 NAFLD严重程度的关系,发现VAT与NAFLD密切相关,VAT能较好地反应NAFLD的严重程度,与本研究结果一致。陈佳等[17]认为成年男腰椎BMD与VAT呈负弱相关(R=-0.129),Zhang等[18]认为女BMD与VAT呈负相关,与本研究一致。杨沛等[19]认为男VAT在60岁以上与BMD正相关,女VAT在60岁以上与BMD呈负相关。张晓东等[20]应用QCT分析测量L3的BMD及相应层面的皮下脂肪、VAT含量并进行相关性分析,结果显示男BMD与皮下脂肪含量、VAT含量均无明显相关,但女BMD与VAT呈负相关。以上两位笔者与本研究结果有所不同。本研究男与女的VAT与BMD 均呈负相关,但男VAT与BMD的相关性弱于女VAT与BMD的相关性。原因可能是研究选取样本量的大小以及年龄组成不一致导致的。另外男与女结果的不同可能与女性内分泌因素特别是绝经后的中老年女性的雌激素分泌减少有关。
OP、NAFLD、MS在发病机制、调节因子等方面密切相关、互相影响、互相作用[21-22]。近年来的研究表明胰岛素抵抗、生长激素和胰岛素样生长因子-1缺乏、骨钙素降低、骨桥蛋白增加、骨保护素降低、瘦素增加、脂联素降低、维生素D缺乏、慢性炎症和氧化应激(TNF-α和IL-6升高等)、体育运动减少等因素会导致骨密度减低、肝脏脂肪变性甚至肝炎、肝硬化以及代谢综合征等的发生发展。
本研究尚有不足。第一,本课题为单中心研究,未去除BMI等因素对脂肪肝、VAT含量的影响,可能造成测量偏倚;第二,本课题未按年龄对受试者进行分组,年轻受试者较少,样本量不足,今后需进一步纳入年轻人的QCT数据。
骨量减低、骨质疏松的男VAT含量明显高于骨量正常者,骨密度越低,VAT含量越高。而对于女性而言,骨量减低、骨质疏松者肝脏脂肪及VAT含量明显高于骨量正常者,骨密度越低,肝脏脂肪和VAT含量越高。QCT可无创、定量、准确、一体化评价BMD与肝脏脂肪和内脏脂肪含量的相关性。

