Her-2阳性乳腺癌患者经曲妥珠单抗与帕妥珠单抗联合化疗的作用研究
唐建勋
(宜兴市肿瘤医院肿瘤内科,江苏 无锡 214206)
乳腺癌为女性最常见的恶性肿瘤之一,具有较高的发病率,随着病情的不断进展,可引起恶病质综合征、全身转移等[1]。人类表皮生长因子受体-2(Her-2)基因扩增或过度表达是乳腺癌患者特殊的临床特点,且报道显示,高达30%的乳腺癌患者会出现上述情况,由于患者早期症状并无特异性,就诊时已处于晚期,多需进行化疗治疗[2]。多西他赛主要通过干扰细胞有丝分裂、分裂间期细胞功能所必需的微管网络,而起到抗肿瘤作用;曲妥珠单抗属于一种靶向治疗药物,可有效作用于Her-2,从而杀伤肿瘤细胞,但仍有部分Her-2过表达患者在治疗过程中产生耐药性,难以有效控制病情发展[3]。帕妥珠单抗为一种Her-2受体拮抗剂,多以Her-2为靶点进行治疗,主要通过抑制配体-启动细胞内信号的两条主要信号通路,使肿瘤细胞生长停止并促进其凋亡,抑制肿瘤细胞增殖,被广泛应用于Her-2阳性转移性乳腺癌的一线治疗与Her-2阳性乳腺癌的辅助治疗[4]。本研究旨在探讨Her-2阳性乳腺癌患者经曲妥珠单抗与帕妥珠单抗联合化疗后,对其临床疗效的影响,现报道如下。
1 资料与方法
1.1一般资料将宜兴市肿瘤医院2018年1月至2021年11月期间收治的Her-2阳性乳腺癌患者60例,按照随机数字表法分为参照组与研究组,每组30例,参照组患者年龄29~55岁,平均(42.00±8.50)岁;病程2~6个月,平均(4.00±0.56)个月;肿瘤TNM分期[5]:Ⅱb期16例、Ⅲa期14例;肿瘤部位:左侧17例,右侧13例。研究组患者年龄28~55岁,平均(41.50±8.45)岁;病程3~5个月,平均(4.00±0.50)个月;肿瘤TNM分期:Ⅱb期17例,Ⅲa期13例;肿瘤部位:左侧16例,右侧14例。两组患者一般资料比较,差异无统计学意义(P>0.05),组间可比。纳入标准:符合《Her-2阳性乳腺癌临床诊疗专家共识》[6]中关于Her-2阳性乳腺癌的诊断标准者;免疫组织化学染色确诊为Her-2阳性者;预计生存期>10个月者;肿瘤未发生远处转移者。排除标准:具有其他恶性肿瘤疾病者;肝、肾功能障碍者;合并血液系统、免疫系统、感染性疾病者;脑膜转移者;无法耐受化疗方案者。院内医学伦理委员会已批准此研究,患者或家属签署知情同意书。
1.2治疗方法患者接受常规对症治疗,包括予以保肝药物、止吐,并给予营养补充疗法[7]。在此基础上采用多西他赛注射液(Sanofi-Aventis Deutschland GmbH,注册证号J20150083,规格:1.0 mL∶20 mg)治疗,75 mg/m2,溶于250 mL的0.9%氯化钠溶液,进行静脉滴注,1次/3周。在上述治疗基础上,参照组患者加用注射用曲妥珠单抗(Genentech Inc.,注册证号S20181016,规格:440 mg/瓶)治疗,静脉滴注,8 mg/kg体质量为初始负荷量,静脉滴注90 min,1次/3周,此为第1个疗程;自第2个疗程起,静脉滴注6 mg/kg体质量,滴注时间1.5 h以内,1次/3周(1个疗程),共治疗4个疗程。在参照组的基础上研究组患者加用帕妥珠单抗注射液(Roche Diagnostics GmbH,注册证号S20180029,规格:420 mg/瓶)治疗,静脉滴注,840 mg/次,1次/3周,此为第1个疗程,自第2个疗程起,将其剂量改为420 mg/次,1次/3周(1个疗程),共治疗4个疗程。
1.3观察指标①参照《Her-2阳性乳腺癌临床诊疗专家共识》[6]中的相关诊断标准评估两组患者肿瘤控制效果,肿瘤完全消失,肿瘤标志物水平处于正常范围,且持续1个月以上为完全缓解;病灶最大直径相加之和缩小30%,肿瘤标志物水平高于正常范围,且持续1个月以上为部分缓解;靶病灶病灶最大直径相加之和缩小≤ 30%或增大<20%为疾病稳定;病灶最大直径之和增大≥ 20%,并出现≥ 1个新病灶为疾病进展。疾病控制率=完全缓解率+部分缓解率+疾病稳定率。②取患者空腹静脉血3 mL,经3 500 r/min转速离心10 min后,取血清,采用电化学发光免疫分析仪(上海聚慕医疗器械有限公司,型号:CL50)检测糖类抗原125(CA125)、癌胚抗原(CEA)、糖类抗原153(CA153)水平。③治疗前后CD3+、CD4+、CD8+百分比,血液采集方法同②,由流式细胞仪(北京赛泰克生物科技有限公司,型号:Aurora)检测,并计算CD4+/CD8+比值。④统计患者治疗期间不良反应(胃肠道反应、关节肌肉痛、皮疹、肝功能损害等)发生情况。
1.4统计学方法采用SPSS 22.0统计学软件分析数据,计数资料(肿瘤控制效果与不良反应发生情况)以[ 例(%)]表示,采用χ2检验;计量资料(CEA、CA125、CA153水平及免疫功能指标)均经K-S法检验证实符合正态分布,以(±s)表示,组内治疗前后比较采用配对t检验,两组间比较采用独立t检验。以P<0.05表示差异有统计学意义。
2 结果
2.1两组患者肿瘤控制效果比较参照组、研究组患者的疾病控制率分别为73.33%、96.67%,研究组显著高于参照组,差异有统计学意义(P<0.05),见表1。

表1 两组患者肿瘤控制效果比较[ 例(%)]
2.2两组患者肿瘤标志物水平比较与治疗前比,治疗后两组患者各项肿瘤标志物水平均显著降低,研究组显著低于参照组,差异均有统计学意义(均P<0.05),见表2。
表2 两组患者肿瘤标志物水平比较( ±s)
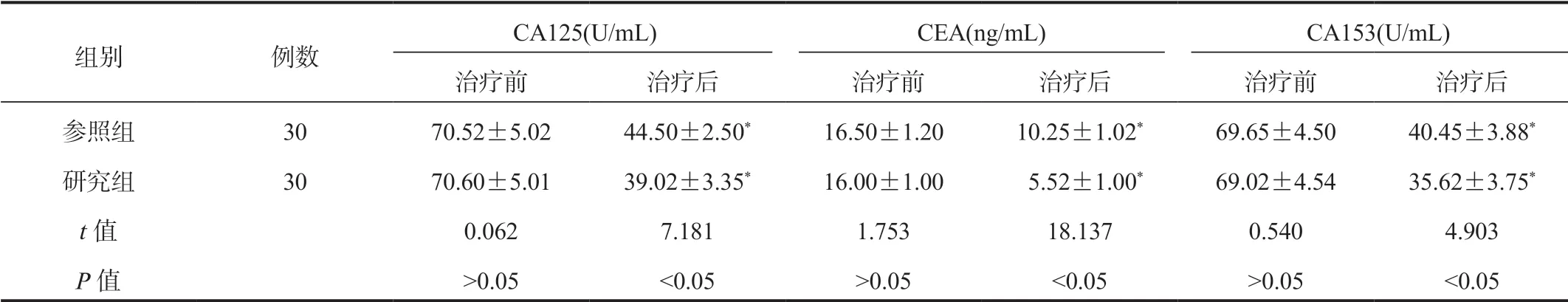
表2 两组患者肿瘤标志物水平比较( ±s)
注:与治疗前比,*P<0.05。CA125:糖类抗原125;CEA:癌胚抗原;CA153:糖类抗原153。
组别 例数CA125(U/mL) CEA(ng/mL) CA153(U/mL)治疗前 治疗后 治疗前 治疗后 治疗前 治疗后参照组 30 70.52±5.02 44.50±2.50* 16.50±1.20 10.25±1.02* 69.65±4.50 40.45±3.88*研究组 30 70.60±5.01 39.02±3.35* 16.00±1.00 5.52±1.00* 69.02±4.54 35.62±3.75*t值 0.062 7.181 1.753 18.137 0.540 4.903 P值 >0.05 <0.05 >0.05 <0.05 >0.05 <0.05
2.3两组患者T细胞亚群水平比较与治疗前比,治疗后两组患者CD3+、CD4+百分比、CD4+/CD8+比值均显著降低,但研究组显著高于参照组;CD8+百分比显著升高,但研究组显著低于参照组,差异均有统计学意义(均P<0.05),见表3。
表3 两组患者T细胞亚群水平比较( ±s)
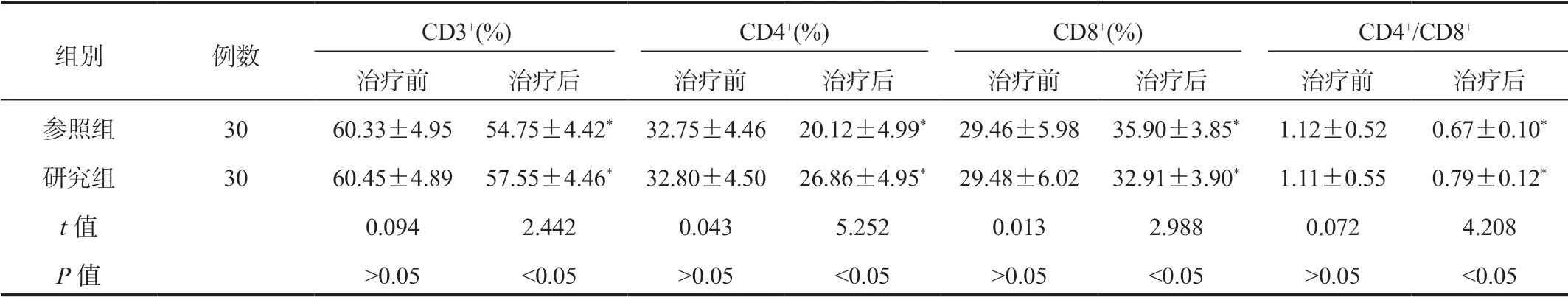
表3 两组患者T细胞亚群水平比较( ±s)
注:与治疗前比,*P<0.05。
组别 例数 CD3+(%) CD4+(%) CD8+(%) CD4+/CD8+治疗前 治疗后 治疗前 治疗后 治疗前 治疗后 治疗前 治疗后参照组 30 60.33±4.95 54.75±4.42*32.75±4.46 20.12±4.99*29.46±5.98 35.90±3.85* 1.12±0.52 0.67±0.10*研究组 30 60.45±4.89 57.55±4.46*32.80±4.50 26.86±4.95*29.48±6.02 32.91±3.90* 1.11±0.55 0.79±0.12*t值 0.094 2.442 0.043 5.252 0.013 2.988 0.072 4.208 P值 >0.05 <0.05 >0.05 <0.05 >0.05 <0.05 >0.05 <0.05
2.4两组患者不良反应发生情况比较参照组、研究组患者不良反应总发生率分别为16.67%、23.33%,组间比较,差异无统计学意义(P>0.05),见表4。
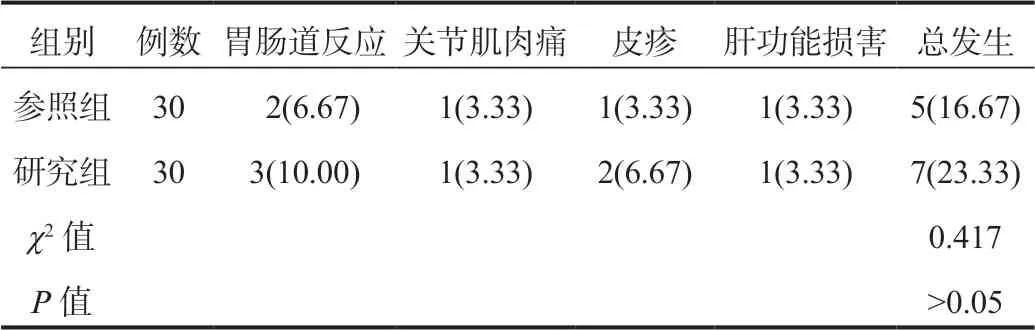
表4 两组患者不良反应发生情况比较[ 例(%)]
3 讨论
乳腺癌主要是发生在乳腺上皮组织的恶性肿瘤,Her-2基因为一种原癌基因,主要位于人体17号染色体长臂上,属于人表皮生长因子受体(Her)家族,具有酪氨酸蛋白激酶活性,会经过多种途径,抑制肿瘤细胞凋亡,促进其增殖,促使肿瘤细胞发生转移。随着抗Her-2靶向药物的出现,乳腺癌的综合治疗方案也在不断更新。多西他赛为治疗乳腺癌的常用药物,可与多种肿瘤细胞内微管蛋白结合,形成稳定的微管,抑制其聚集,从而对肿瘤细胞的有丝分裂进行拮抗,但也会对患者机体内正常细胞产生影响,影响患者免疫功能[8];曲妥珠单抗是治疗乳腺癌的一种Her-2靶向药物,可以选择性地作用于Her-2的细胞外部分,对Her-2介导的信号转导通路具有阻断作用,从而可使细胞膜Her-2蛋白浓度明显降低,促使Her-2受体蛋白加速降解,有效参与抗血管生成,抑制细胞生长,诱导细胞凋亡;但相关研究中显示,相比于单靶向药物联合化疗治疗Her-2阳性乳腺癌患者,双靶向联合化疗治疗的患者临床缓解率更高,且在常规化疗方案的基础上联合双靶药物治疗并未增加Her-2阳性乳腺癌患者的不良反应[9-10]。
帕妥珠单抗是一种人源化的单克隆抗体,能够与Her-2受体选择性的结合,抑制肿瘤细胞的生长与增殖,进而控制病情发展,疗效显著;且帕妥珠单抗通过与Her-2二聚化结构域结合,抑制Her-2与其他Her家族受体的异源二聚化,在扰乱Her家族其他复合物的形成方面较曲妥珠单抗更为有效,因此对于Her-2阳性乳腺癌患者抗肿瘤效果更为显著[11-12]。CEA、CA125、CA153作为常见的肿瘤标志物,在乳腺癌患者体内呈升高表达,其水平越高,病情越严重[13]。本研究中,参照组与研究组患者的疾病控制率分别为73.33%、96.67%,研究组较参照组显著升高,且治疗后研究组患者CEA、CA125、CA153水平均显著低于参照组,提示Her-2阳性乳腺癌患者经曲妥珠单抗与帕妥珠单抗联合化疗后,可有效降低机体的血清肿瘤标志物水平,提高治疗效果。
T淋巴细胞具有多种效应、免疫调节功能等作用,在乳腺癌患者体内,肿瘤免疫缺陷是机体免疫功能低下导致的,自身免疫抑制和对肿瘤细胞免疫应答的减少会降低患者机体识别和杀伤突变细胞的能力,进而促进肿瘤转移[14]。本研究中,较治疗前,治疗后两组患者CD3+百分比、CD4+/CD8+比值、CD4+百分比均显著降低,但研究组显著高于参照组,CD8+百分比均显著升高,但研究组显著低于参照组;对照组、参照组患者不良反应总发生率分别为16.67%、23.33%,组间比较,差异无统计学意义,提示Her-2阳性乳腺癌患者经曲妥珠单抗与帕妥珠单抗联合化疗后,对患者机体细胞免疫功能的影响更小,且安全性良好。分析其原因可能为,常规化疗在杀灭肿瘤细胞的同时,也会对机体正常细胞造成严重的损害,因此需结合靶向治疗药物,减轻化疗对机体免疫力的影响,本研究中,曲妥珠单抗特异性结合Her-2蛋白在细胞膜外的第4个功能域,阻断信号转导,介导细胞免疫作用杀伤肿瘤细胞[15];帕妥珠单抗主要靶向作用于Her-2受体的胞外受体结构域Ⅱ(二聚体区域),可阻断Her-2受体的激活,进而阻断信号转导,特异性地杀死肿瘤细胞,曲妥珠单抗与帕妥珠单抗双靶治疗,常常相得益彰,多靶点攻击肿瘤细胞,对正常细胞损伤小,可减轻对患者机体免疫功能的损伤,改善患者预后[16-17]。
综上,Her-2阳性乳腺癌患者经曲妥珠单抗与帕妥珠单抗联合化疗后,可对血清肿瘤标志物水平进行抑制,疗效显著,同时对免疫功能的影响较小,且不增加不良反应,临床上可推广与应用。

