肠杆菌植酸酶基因的克隆及重组表达
程琪,赵东莹,李杨,包永明,
(1.大连理工大学海洋科学与技术学院,辽宁 盘锦 124221;2.大连理工大学生物工程学院,辽宁 大连 116024)
植酸酶,又称肌醇六磷酸水解酶,可水解植酸,产物为磷酸及肌醇衍生物[1]。植酸酶添加到饲料中,不仅可以提高动物对饲料中磷和其他元素的利用率,还可以减少动物粪便中磷含量,降低对土壤环境的污染[2-3]。根据最适pH值可将植酸酶分为酸性植酸酶、中性植酸酶和碱性植酸酶;根据立体专一性可分为3-植酸酶、5-植酸酶和6-植酸酶;根据催化机理和结构可分为组氨酸酸性植酸酶(HAPhy)、β—螺旋桨植酸酶(BPP)、半胱氨酸磷酸酶植酸酶(CPhy)和紫色酸性磷酸酶植酸酶(PAPhy)。植酸酶在自然界中广泛存在于植物、动物和微生物中,其中由于动植物体内植酸酶产量和酶活性相对较低[4],相关研究也较少。目前工业化生产的植酸酶多来自于真菌,其中曲霉菌属的黑曲霉应用较多,其植酸酶活性虽较高,但pH值适用条件较苛刻,限制其在动物饲料和酶制剂领域的应用[5]。20世纪80年代陆续筛选出产植酸酶的细菌,且产生的植酸酶往往有一些特性,如枯草芽孢杆菌植酸酶的活性与稳定性需要与Ca2+联用才能体现等[6]。由于细菌植酸酶具有较高的热稳定性及蛋白酶水解稳定性,有良好的开发空间[4]。然而,由于细菌植酸酶表达量较低限制其规模化生产与应用,因此克隆细菌植酸酶基因,构建高效表达的工程菌进行异源表达可获得高产量的酶,酶学特性也因其易分离纯化而得到更好的解析。
前期从土壤中筛选出一株可以水解有机磷的菌株,经鉴定为阿氏肠杆菌,命名为Enterobacter asburiaeZSH Y1。本研究利用PCR技术,从其基因组克隆植酸酶基因phyE,构建重组表达载体,在大肠杆菌中实现异源表达植酸酶;分析植酸酶PhyZSHY1-nsp与报道植酸酶的同源性,分离纯化重组植酸酶PhyZSHY1-nsp,研究其酶学性特性,为工业酶制剂的制备提供理论依据。
1 材料与方法
1.1 材料
菌种:本研究中所使用的产植酸酶菌株为前期实验室筛选获得,经过生理生化及分子生物学鉴定确定为Enterobacter asburiaeZSH Y1[7]。重组表达使用菌株E.coliDH5α和E.coliBL21(DE3)为本实验室保藏。
质粒:pET28a(+)为本实验室保存。
培养基:(1)蒙金娜培养基。10.0g·L-1葡萄糖,0.3g·L-1KCl,0.3g·L-1NaCl,0.5g·L-1(NH4)2SO4,0.03g·L-1Mn-SO4·4H2O,0.3g·L-1MgSO4·7H2O,0.03g·L-1FeSO4·7H2O,2.0g·L-1植酸钠,pH值7.0,115℃灭菌20min。(2)LB液体培养基。10.0g·L-1蛋白胨,10.0g·L-1NaCl,5.0g·L-1酵母浸粉,pH值7.5,121℃灭菌20min。固体培养基在其基础上添加20.0g·L-1琼脂粉。
硫酸卡那霉素:配置母液浓度50mg·mL-1,使用终浓度为50μg·mL-1,置于-20℃保存。
IPTG:配置母液浓度为1mol·L-1使用终浓度为1mM,置于-20℃保存。
Tris-HCl缓冲液母液:1mol·L-1Tris-HCl,pH值7.4。
细胞破碎液:50mmol·L-1MTris-HCl,50mmol·L-1NaCl,pH值7.4。
Ni-NTA纯化平衡缓冲液(Binding Buffer):20mmol·L-1Tris-HCl,pH值7.4。
Ni-NTA纯化清洗缓冲液(Wash Buffer):20mmol·L-1Tris-HCl,0.5mol·L-1NaCl,25mmol·L-1咪唑,pH值7.4。
Ni-NTA纯化洗脱缓冲液(Elution Buffer):20mmol·L-1Tris-HCl,0.5mol·L-1NaCl,0.5mol·L-1咪唑,pH值7.4。
透析缓冲液:50mmol·L-1Tris-HCl,40%蔗糖,pH值7.4。
Q柱纯化缓冲液(A液):20mmol·L-1Tris-HCl,pH值7.4。
Q柱纯化缓冲液(B液):20mmol·L-1Tris-HCl,1mol·L-1NaCl,pH值7.4。
以上缓冲液均过膜后,121℃灭菌20min,室温保存。
仪器:酶标仪SpectraMax M2e(美国Molecular Devices)、全温振荡培养箱ZQPL-200(天津莱玻特瑞仪器设备有限公司)、高压蒸汽灭菌锅SS-325(日本TOMY)、超声破碎仪UP 200H(德国Dr.Hielscher)等。
试剂、酶和试剂盒:植酸钠购于Sigma公司;蛋白质标准分子量Marker、BSA标准品购于Solarbio公司;DL10000 DNA Marker、DL2000 DNA Marker、高保真酶PrimeSTAR Max DNA Polymerase(2×)购于Takara公司;限制性内切酶NdeⅠ、XhoⅠ、Quick Ligation™快速连接试剂盒购于New England Biolabs公司;SanPrep柱式质粒DNA小量抽提试剂盒、SanPrep柱式DNA胶回收试剂盒购于上海生工公司;细菌基因组DNA提取试剂盒购于北京天根公司;其余试剂购于天津大茂。
1.2 方法
1.2.1 基因组提取采用天根公司细菌基因组DNA提取试剂盒提取E.asburiaeZSH Y1的全基因组,具体操作步骤与细节参照试剂盒说明书。
1.2.2 菌株E.asburiaeZSH Y1植酸酶基因克隆基于已报道的肠杆菌植酸酶基因进行多重序列比对,选取高度保守的N端与C端区域,设计上下游引物并组合成4对引物(表1)进行PCR扩增。PCR扩增体系为上下游引物各1μL,模板DNA1μL,高保真酶Prime STAR Max DNA Polymerase(2×)25μL,ddH2O22μL。扩增程序为94℃预变性5min,94℃变性30s,60℃退火30s,72℃延伸90s(1kb·min-1),30个循环,72℃延伸7min。

表1 E.asburiae ZSH Y1植酸酶基因克隆引物Table 1 Cloning primer for E.asburiae ZSH Y1 phytase gene
通过NCBI比对分析克隆得到的肠杆菌植酸酶部分基因序列,显示其与数据库中提交的肠杆菌全基因组序列具有较高的相似性,选择、设计用于扩增植酸酶全长基因序列的引物(表2),以E.asburiaeZSH Y1基因组为模板,PCR扩增E.asburiaeZSH Y1的植酸酶全长基因,PCR扩增体系和程序同上,产物通过1%琼脂糖凝胶电泳鉴定后,回收扩增片段,送上海生工测序;测序得到的序列分别进行开放框阅读分析,确定植酸酶编码基因phyE。

表2 植酸酶全基因phyE扩增引物Table 2 Primers for phyE amplificarion
1.2.3 重组表达质粒的构建根据测序获得E.asburiaeZSH Y1植酸酶全长无信号肽基因序列phyE-nsp,设计带有限制性酶NdeⅠ、XhoⅠ位点的引物Fnsp和Rnsp(表3)进行PCR扩增,双酶切phyE-nsp PCR片段和pET28a(+)质粒,T4 DNA连接酶连接,构建重组质粒。

表3 无信号肽基因phyE-nsp带酶切位点扩增引物Table 3 Primers with restriction site for no signal peptide gene phyE-nsp
1.2.4 重组质粒的转化采用热激法,将连接产物转化大肠杆菌DH5α感受态细胞,涂布LB的抗性平皿,培养箱37℃倒置培养12~16h。挑取平板上单一菌落至5mL的抗性LB液体培养基,培养12h。
1.2.5 重组质粒的验证提取单一菌落的质粒,双酶切后,琼脂糖凝胶电泳检测,确认酶切片段与连接前片段大小一致后,重组质粒送至测序公司测序。
1.2.6 重组植酸酶的表达测序正确的重组质粒pET28a(+)-phyE-nsp转化E.coliBL21(DE3)感受态细胞,涂布平皿37℃培养12h,挑取菌落接种于抗性LB液体培养基中,摇床37℃,180r·min-1培养3h,加入IPTG至终浓度为1mmol·L-1,于16℃摇床中180r·min-1培养16h。
1.2.7 重组植酸酶的纯化培养菌液于4℃冷冻离心机中,10000g离心10min,收集菌体,细胞悬浮洗涤两次后,加入适量细胞破碎液和溶菌酶,室温放置15min后超声破碎,破碎液12000g离心10min,收集上清液,0.22μm无菌滤膜过滤后,获得样品。(1)Ni柱亲和层析分离,使用5倍柱体积(CV)的纯水冲洗Ni柱,再用5CV的Binding buffer平衡Ni柱后,样品上样后,用2CV的Wash buffer洗脱未结合的杂蛋白,用2CV的Elution buffer洗脱Ni柱,收集洗脱液,收集样品经浓缩透析脱盐后,测定酶活与蛋白浓度。(2)阴离子交换(Q FF离子)分离,采用Purifier 10(GE Healthcare)使用5CV的纯水冲洗Q柱,再用A液平衡层析柱,Ni柱纯化样品上样,用A液平衡后,采用0~1mol·L-1NaCl梯度洗脱,在线监测OD280值,收集分离组份,样品测定酶活与蛋白浓度后,12.5%SDS-PAGE电泳检测。
1.2.8 植酸酶活力检测按照国标《饲用植酸酶活性的测定—分光光度法》(GB/T 18634—2009)测定样品植酸酶活性。酶活单位定义为:在37℃、pH值5.5的条件下,每分钟从浓度5.0mmol·L-1植酸钠溶液中释放1μmol无机磷,即为一个植酸酶活性单位(U)。
1.2.9 重组植酸酶酶学性质表征(1)最适温度和温度稳定性。在pH值5.5条件下,分别在20~70℃的温度范围内测定纯酶酶活,确定酶的最适温度。将纯化的植酸酶分别在20~60℃孵育180min后,于37℃测定酶活,分析植酸酶的热稳定性。(2)最适pH值和pH稳定性。在37℃条件下,分别在pH值2.0~10.0测定酶活,确定酶的最适pH值。将纯化的植酸酶分别与pH值2.0~10.0的缓冲液孵育1h后测定酶活,分析植酸酶的pH稳定性。所用缓冲液为:pH值2.0~3.5,0.1mol·L-1甘氨酸—HCl缓冲液;pH值4.0~6.0,0.1mol·L-1乙酸—乙酸钠缓冲液;pH值6.5,0.1mol·L-1柠檬酸—柠檬酸钠缓冲液;pH值7.0~9.5,0.1mol·L-1Tris—HCl缓冲液;pH值10.0,0.1mol·L-1甘氨酸—NaOH缓冲液。(3)金属离子和潜在抑制剂。在最适温度和pH的条件下,分别将纯化的植酸酶与终浓度1mmol·L-1和5mmol·L-1的金属离子和潜在抑制剂孵育1h后,测定酶活。(4)酶反应动力学。在37℃、pH值5.5的条件下,分别以不同浓度(0.5,1,1.5,2,2.5,3,4,5,6,8,10mmol·L-1)的植酸钠为底物,测定植酸酶活力,通过Lineweaer-burk双倒数曲线获得动力学参数Km和kcat。
1.3 数据统计与分析
所有试验均设置3组平行,数据由平均值±标准偏差组成,利用Origin 2017制图。采用SPSS 26软件中的ANOVA的单因素方差进行统计分析,p<0.05时表示存在显著差异;p<0.01时,表示差异极显著。
2 结果与分析
2.1 菌株E.asburiae ZSH Y1植酸酶基因克隆
利用肠杆菌来源植酸酶的N-端和C-端保守区域设计引物的4对引物,以E.asburiaeZSH Y1基因组为模板进行PCR扩增,产物经1%琼脂糖凝胶电泳检测结果如图1。引物F1R1与F2R1扩增出与保守序列大小一致的片段,结合菌株在蒙金娜固体培养基平板上出现溶磷圈,证明菌株E.asburiaeZSH Y1有植酸酶的基因,可以表达植酸酶。
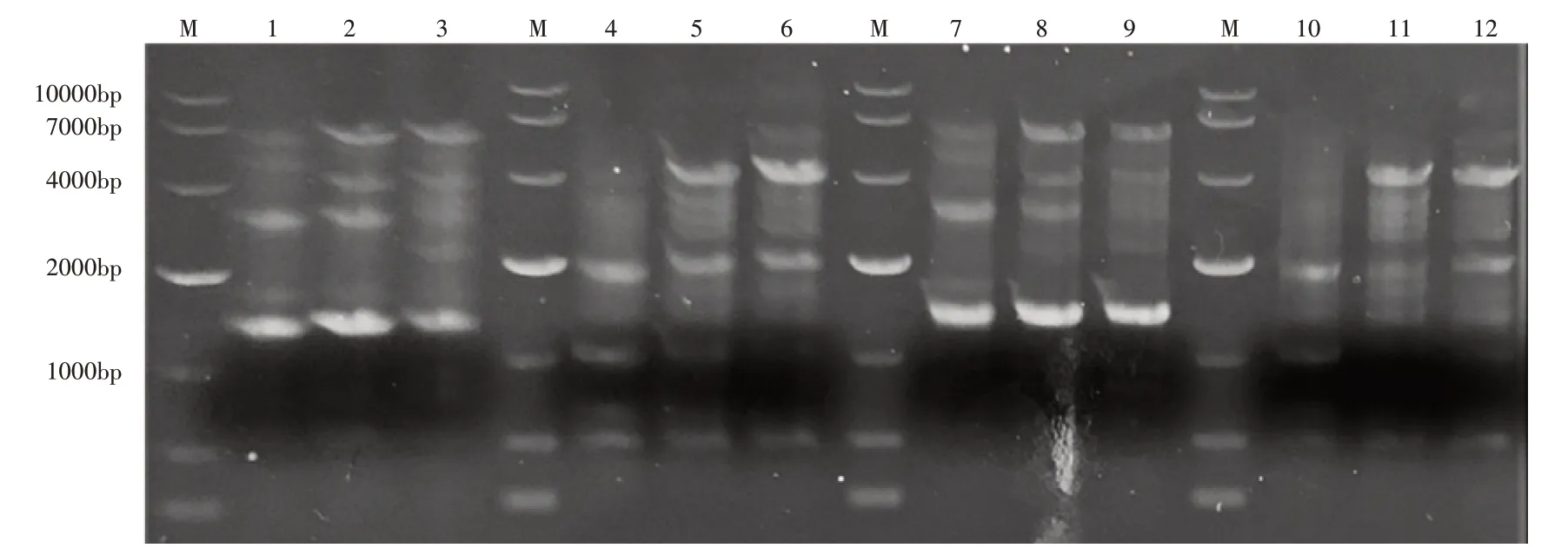
图1 E.asburiae ZSH Y1植酸酶基因克隆Figure 1 Cloning of E.asburiae ZSH Y1 phytase gene
引物TF1TF2、TR1TR2以E.asburiaeZSH Y1的基因组为模板进行PCR扩增,结果如图2。将片段分别纯化回收并测序,对扩增产物1-X(2399bp)、1-S(1735bp)和A1427(1427bp)这3个序列进行开放阅读框分析(Open Reading Flame),在NCBI数据库BlastX分析后,确定了全长植酸酶PhyZSHY1的全基因序列phyE(1359bp)与氨基酸序列(452aa),得到菌株E.asburiaeZSH Y1的理论全长植酸酶基因(图3)。
利用在线软件SignalP 5.0对植酸酶PhyZSHY1的氨基酸序列进行分析,确定了其在N-端包含一个长度为20aa的信号肽序列,信号肽的切割位点在氨基酸A20和A21之间。将去除信号肽的PhyZSHY1-nsp氨基酸序列进行InterPro保守域结构分析后,确定序列含有1个植酸酶家族保守域序列PF13449(P53—F391),表明其具有磷酸二酯酶的活性,属于植酸酶超家族cl26171的一员。在UniProt中比对植酸酶(登录号:Q328Q5)与PhyZSHY1-nsp同源性达88%;基于氨基酸序列多重比对(图4),构建系统发育树(图5),植酸酶PhyZSHY1-nsp与E.hormaechei来源的植酸酶(登录号:WP_157970380)具有100%的同源性,但未见植酸酶(登录号:WP_157970380)的酶学性质、结构与功能报道。
选取植酸酶(登录号:Q328Q5)为模板在SWISSMODEL中对植酸酶PhyZSHY1-nsp进行同源建模(图6),它的结构包括31个β折叠,9个310螺旋和1个α螺旋,判断为α+β类蛋白质。

图2 引物TF1、TR1扩增结果(1-X、1-S)与引物TF2、TR2扩增结果(A1427)Figure 2 DNA 1-X and 1-S from primer TF1TR1 and A1427 from TF2,TR2

图3 ORF分析全长植酸酶PhyZSHY1的全基因序列phyE与氨基酸序列Figure 3 phyE and amino acid sequence of PhyZSHY1 by ORF
2.2 重组菌株构建及诱导表达
2.2.1 PhyZSHY1重组菌株构建重组质粒pET28a(+)-phyE-nsp采用NdeⅠ和XhoⅠ双酶切,琼脂糖凝胶电泳如图7,酶切产物的两条片段,长度分别与目的基因phyE-nsp和pET28a(+)一致,测序结果证明目的基因正确。
2.2.2 重组质粒pET28a(+)-phyE-nsp诱导表达及纯化重组菌株pET28a(+)-phyE-nsp/BL21(DE3)经低温诱导16h后,离心收集菌体,破碎菌体、离心收集上清液,HisTrap分离纯化后,收集活性组分,进行第二步Q Sepharose Fast Flow分离纯化,洗脱曲线如图8,活性峰为0.1mol·L-1NaCl的洗脱峰。经SDS-PAGE分析,获得纯化的重组植酸酶PhyZSHY1-nsp(图9)。
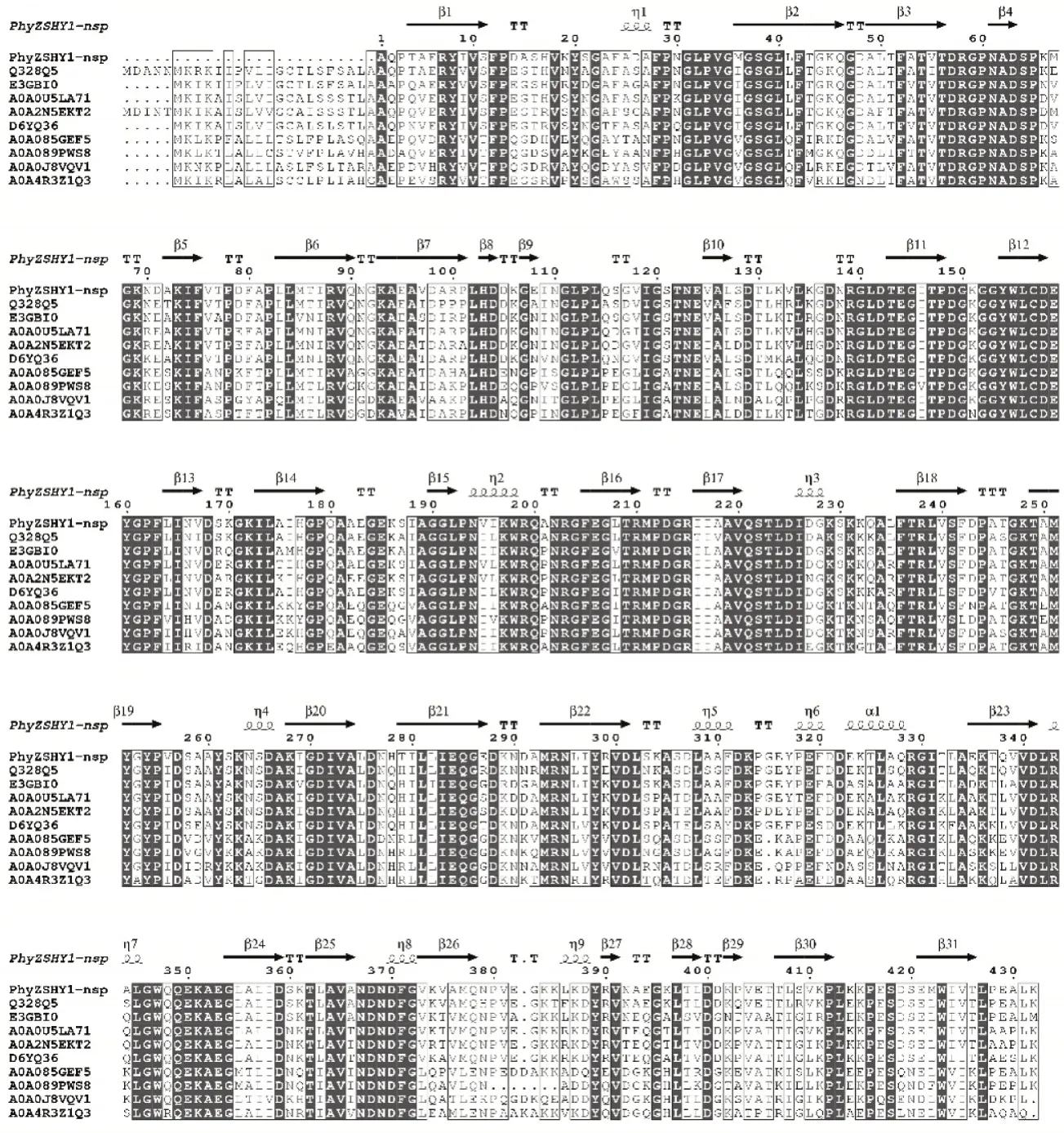
图4 植酸酶PhyZSHY1多重序列比对Figure 4 Alignment of amino acid sequences for PhyZSHY1
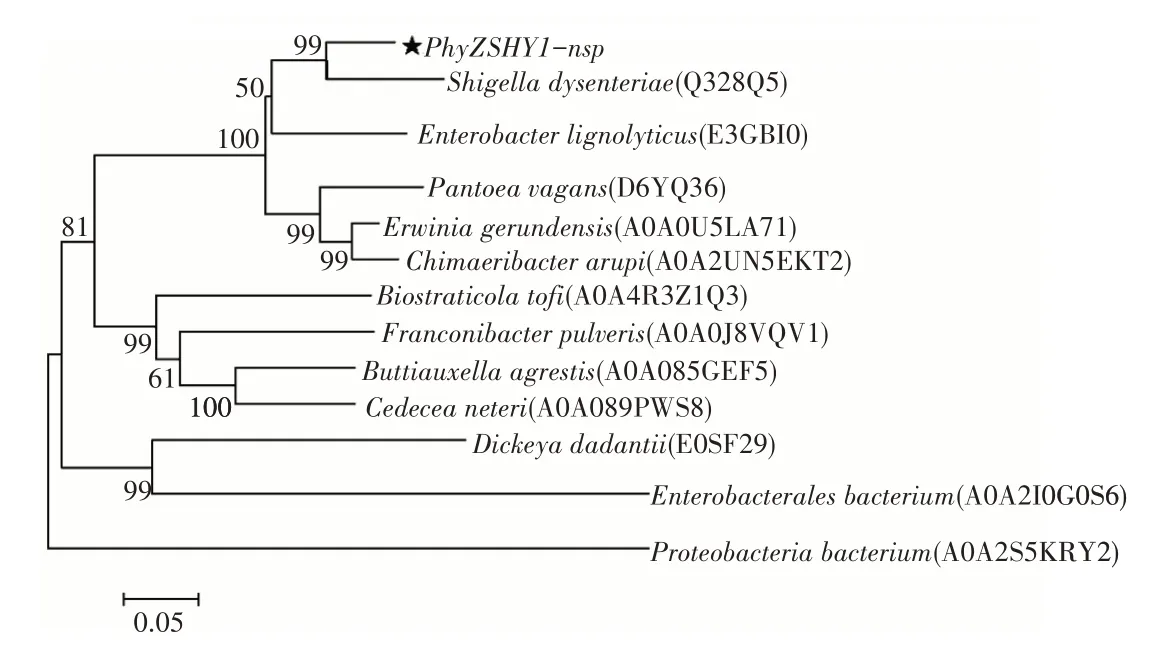
图5 植酸酶PhyZSHY1-nsp的氨基酸序列系统发育树Figure 5 Phylogenetic tree base on amino sequences of PhyZSHY1-nsp
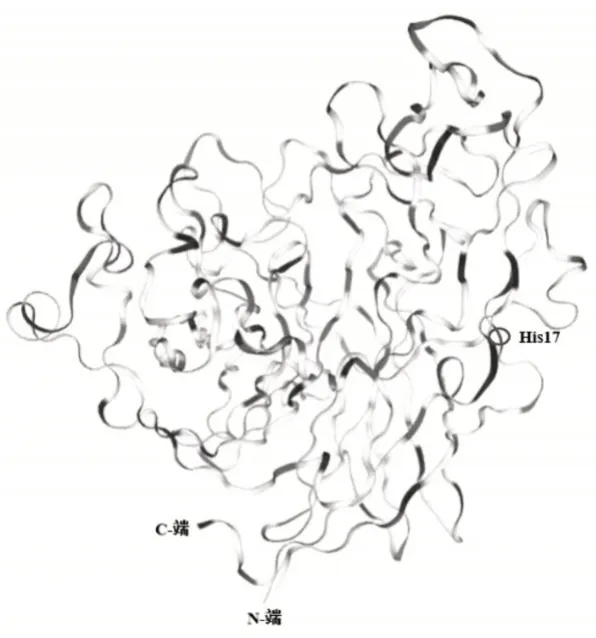
图6 植酸酶PhyZSHY1-nsp同源建模三级结构Figure 6 Homology modeling structure of Phytase phyZSHY1-nsp
2.2.3 植酸酶PhyZSHY1-nsp精确分子量测定 通过在线软件ExPASy对重组植酸酶PhyZSHY1-nsp分析,得到其理论分子量和等电点分别为48817.21Da和5.72。将获得的纯化样品进行四极杆-静电场轨道阱高分辨液相色谱质谱联用分析,得到其实际分子量为48817.87Da(图10),与预测结果一致,证明获得纯化的植酸酶。
2.3 重组植酸酶PhyZSHY1-nsp的酶学性质分析
2.3.1 最适温度与温度稳定性以5℃的梯度考察温度对PhyZSHY1-nsp活性的影响,PhyZSHY1-nsp的最适作用温度为60℃(图11)。
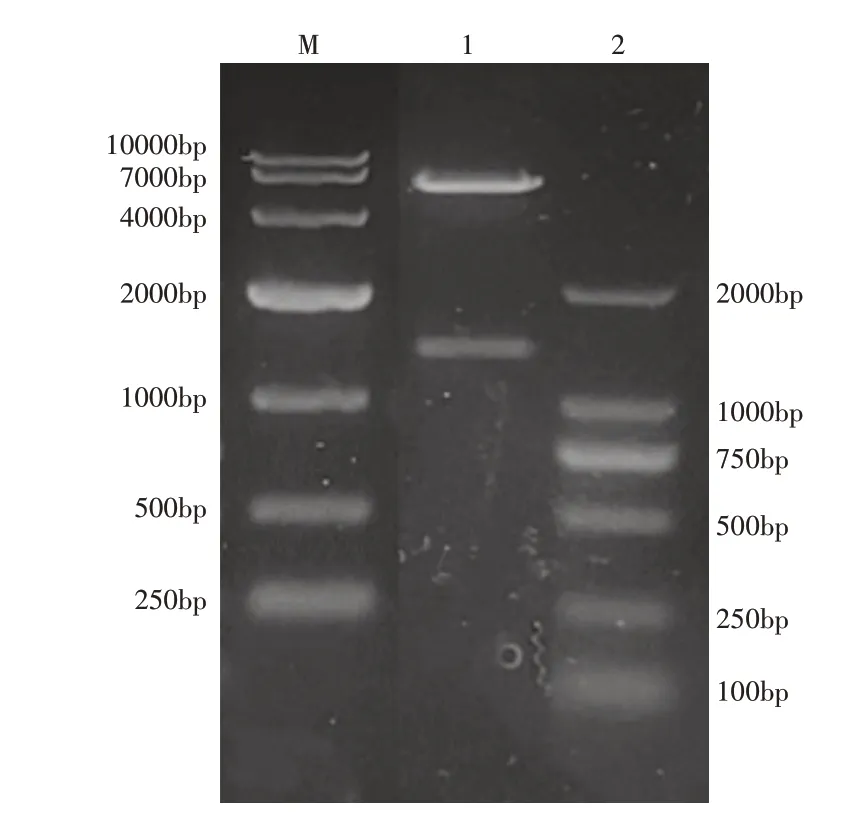
图7 重组质粒pET28a(+)-phyE-nsp酶切验证Figure 7 Identification of recombinant plasmid pET28a(+)-phyE-nsp by enzyme digestion
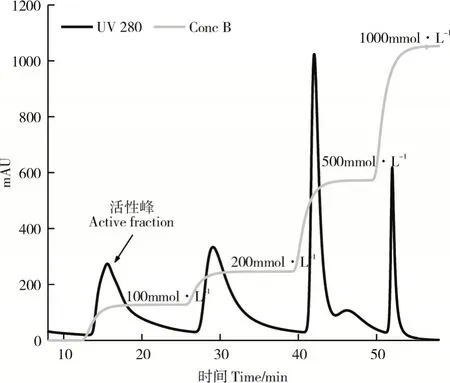
图8 重组植酸酶PhyZSHY1-nsp离子交换层析洗脱曲线Figure 8 Ion exchange chromatography elution curve of PhyZSHY1-nsp
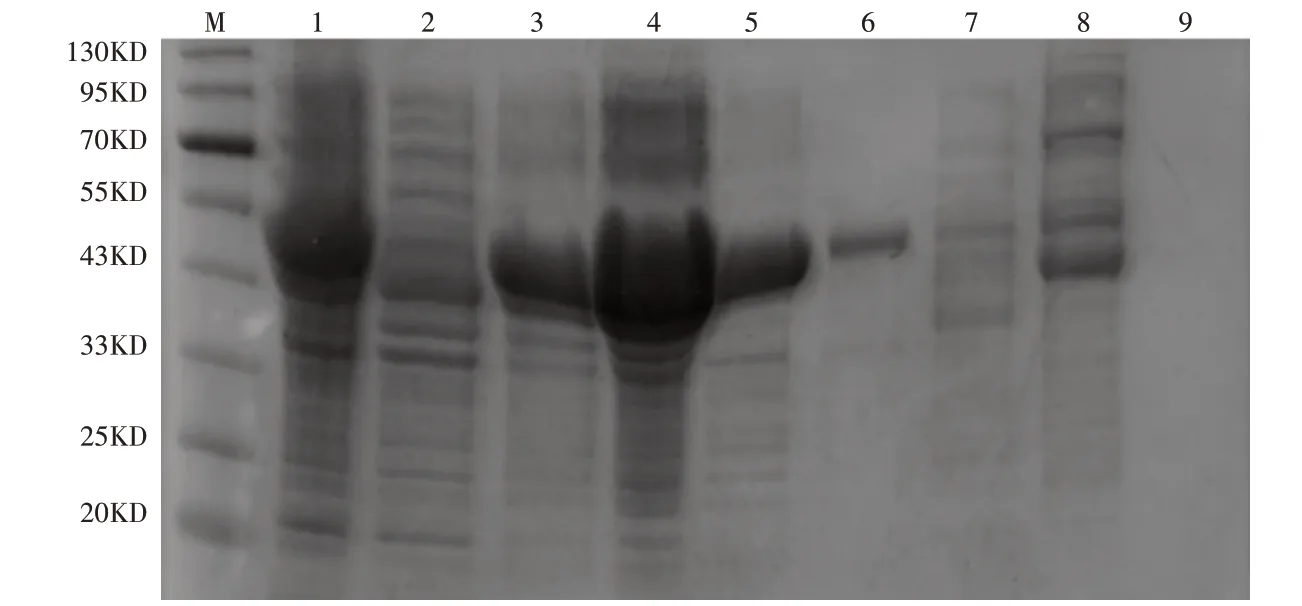
图9 纯化重组植酸酶PhyZSHY1-nsp的SDS-PAGE电泳图Figure 9 SDS-PAGE analysis of the purified PhyZSHY1-nsp
植酸酶PhyZSHY1-nsp的温度稳定性如图12,在低于40℃的温度下较稳定,其活性保持在60%以上,50℃孵育后,植酸酶活性维持在最大活性的50%以上,60℃孵育30min后失活,证明植酸酶PhyZSHY1-nsp为中温植酸酶。
2.3.2 pH值对重组植酸酶PhyZSHY1-nsp活性的影响植酸酶PhyZSHY1-nsp的最适pH值为4.5。当pH值小于4.0或大于7.0时,活性显著降低(图13)。当PhyZSHY1-nsp在pH值4.0~5.5范围内的缓冲液中孵育1h后,酶的相对活力均保持在90%以上,在酸性缓冲液中酶活力明显高于碱性缓冲液中,并且活力相对稳定(图14),说明PhyZSHY1-nsp是酸性植酸酶。
2.3.3 金属离子和抑制剂对植酸酶PhyZSHY1-nsp活性的影响PhyZSHY1-nsp与1mmol·L-1和5mmol·L-1的金属离子和潜在抑制剂分别孵育后(表4),Cu2+、Co2+对植酸酶有抑制作用,其中Cu2+浓度越高抑制作用越强。Na+、Ca2+、K+、Mg2+、Zn2+、Mn2+、Fe2+对植酸酶有促进作用,其中Na+、Ca2+在浓度为5mmol·L-1时激活作用强于1mmol·L-1;而K+、Mg2+、Zn2+、Mn2+、Fe2+在浓度5mmol·L-1时激活作用弱降低;EDTA对植酸酶活性影响不大;SDS会明显抑制活性。

图10 植酸酶PhyZSHY1-nsp的精确分子量Figure 10 Accurate molecular weight of PhyZSHY1-nsp

图11 植酸酶PhyZSHY1-nsp的最适温度Figure 11 Optimal temperature of PhyZSHY1-nsp

图12 植酸酶PhyZSHY1-nsp的温度稳定性Figure 12 Thermostability of PhyZSHY1-nsp

图13 植酸酶PhyZSHY1-nsp的最适反应pHFigure 13 Optimal pH of PhyZSHY1-nsp
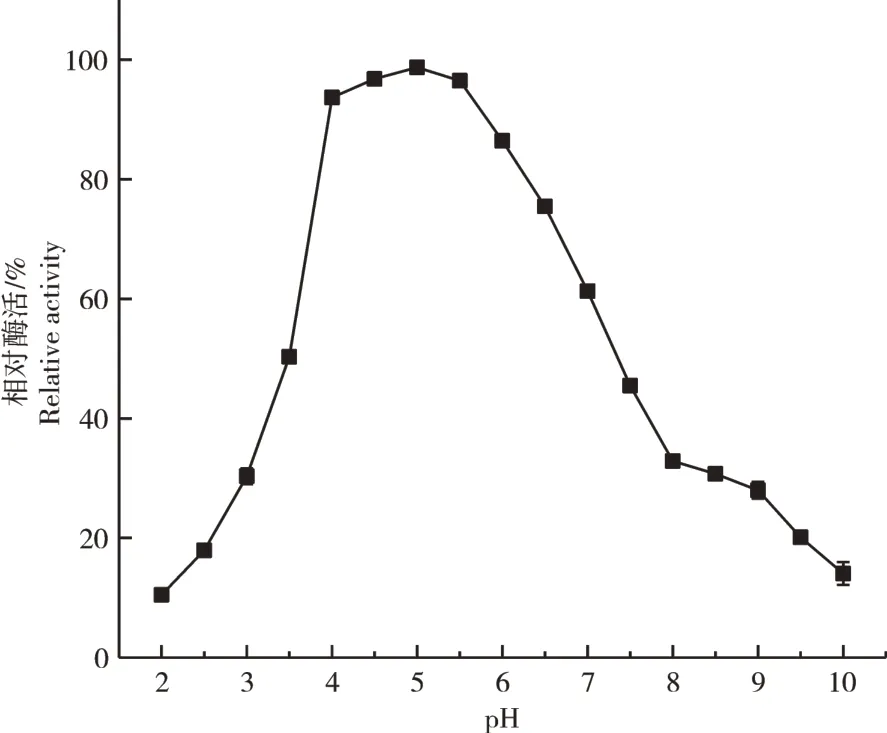
图14 植酸酶PhyZSHY1-nsp的pH稳定性Figure 14 pH stability of PhyZSHY1-nsp
2.3.4 植酸酶PhyZSHY1-nsp的动力学性质在37℃,pH值5.5的条件下,利用不同浓度的植酸钠为底物测定植酸酶的反应初速率,采用Lineweaver-Burk双倒数作图法作图,经线性回归计算反应动力学参数(图15):植酸酶对植酸钠的水解作用符合米氏方程,求得植酸酶的米氏常数Km为0.86mmol·L-1,最大反应速率Vmax为0.62μmol·min-1mgprotein-1,kcat为16.04s-1,kcat/Km为18.66L·s-1·mmol-1。

表4 金属离子与潜在抑制剂对PhyZSHY1-nsp活性的影响Table 4 Effect of metal ions and potential inhibitor on activity of PhyZSHY1-nsp
3 讨论与结论
目前,来源于微生物的植酸酶多数是组氨酸酸性磷酸酶植酸酶(HAPhy),其空间构象中,活性部位的一些保守氨基酸形成一个可以与底物结合的口袋,活性部位通常包括两个功能部位,一是位于N端的“RHGXPXP”元件的“结合部位”,另一个是位于C端的“HD”元件的“催化部位”[8]。杆菌植酸酶通常不存在保守元件“RHGXPXP”,其活性和稳定性由Ca2+保持[9],来自B.amyloliquef aciens植酸酶的活性部位有4个Ca2+,且还有两个不同作用的磷酸位点(Pho1和Pho2)[10]。解析植酸酶PhyZSHY1-nsp的氨基酸序列,未发现HAPhy植酸酶常规的活性部位。根据同源建模得到的三维结构分析,PhyZSHY1-nsp活性中心为His17,活性中心位于N端一个β折叠邻近的loop环区[11]。

图15 植酸酶PhyZSHY1-nsp LineWeaver-Burk图Figure 15 Lineweaver-Burk graph of PhyZSHY1-nsp
由于植酸分子的特殊立体构象,植酸酶水解又具有立体专一性,国际纯粹与应用化学联合会-国际生物化学与分子生物学联合会(IUPAC-IUBMB)目前认可3类植酸酶:3-植酸酶、6-植酸酶和5-植酸酶。3-植酸酶首先释放C3位的磷酸基团开始水解植酸,随后释放其他位置的磷酸基团,绝大多数微生物可产3-植酸酶[12],如Aspergillus niger[13]和Klebsiellasp.ASR1[14]菌株产3-植酸酶,且水解植酸终产物为2-磷酸肌醇单酯。通过在UniProt数据库中与肠杆菌科Shigella dysenteriae植酸酶[15](登录号:Q328Q5)保守性比对达88%,发育树分析也处于同一分支,植酸酶Q328Q5属于3-植酸酶,因此植酸酶PhyZSHY1-nsp可能属于3-植酸酶,后续需进行试验,根据其水解产物判定植酸酶PhyZSHY1-nsp的分类。
细菌植酸酶因其产量低限制其在工业生产中的应用,分离新的植酸酶基因,构建筛选高产量的重组菌株仍是目前植酸酶研究领域的重点[16-20]。利用大肠杆菌作为宿主菌株异源表达植酸酶已有报道,如GULATI等[21]优化培养基后使得芽孢杆菌植酸酶活性可达到2.9573U·mL-1,芽孢杆菌MD2植酸酶通过生物反应器高效表达,酶活性达327U·mL-1[22]。植酸酶PhyZSHY1-nsp的酶活为1.74U·mL-1,后续可通过蛋白质工程技术如理化设计等提高酶活性。
本研究中,以E.coliBL21(DE3)菌株作为宿主菌株获得的植酸酶PhyZSHY1-nsp为可溶性表达的。经过Ni-NTA和Q FF纯化后,获得了电泳纯的植酸酶,经四极杆-静电场轨道阱高分辨液相色谱质谱联用分析后,分子量为48817.87Da,与报道的大多数细菌植酸酶(37~55kDa)一致[23-25]。
植酸酶PhyZSHY1-nsp的最适反应温度为60℃,高于来源于Bacillus subtilis US417植酸酶最适温度为55℃[26];而Pedobacter nyackensis植酸酶最适温度仅为45℃[27]。在中低温的环境中,PhyZSHY1-nsp酶活性,即使在50℃孵育3h后,仍能保持50%的活性,可以认为是中温植酸酶。
在酸性环境(pH值4.0~7.0)中,PhyZSHY1-nsp可以发挥60%以上酶活,但在碱性环境中活性骤减,稳定性也不如酸性条件下。多数细菌植酸酶最适pH为酸性,如植酸酶E.coliappA-Q258N/Q349N的最适pH值为4.5[28],PhyZSHY1-nsp的最适pH值为4.5,属于酸性植酸酶。
通过测定不同金属离子对PhyZSHY1-nsp的影响,发现螯合剂EDTA对酶的活性(5mmol·L-1)没有显著影响,表明该酶不是金属酶[29]。变性剂SDS抑制PhyZSHY1-nsp活性,与文献报道一致[29]。一般来说,除了芽孢杆菌植酸酶活性依靠Ca2+,如B.subtilis植酸酶PhyC必须依靠Ca2+才能发挥催化活性[30-31];植酸酶活性不需要金属离子[29],这类植酸酶属于β-螺旋桨植酸酶(BPP),通常是碱性植酸酶[12]。二价金属离子Fe2+和Cu2+对PhyZSHY1-nsp的抑制作用与报道的其他植酸酶一致[24;32]。
植酸酶的开发利用中,将植酸酶制成酶制剂添加进动物饲料中仍是主流,在制粒过程中,高温加热会损害植酸酶的一定活性,因此开发耐热植酸酶依旧是研究的重点。进一步的研究中,可以考虑对重组植酸酶PhyZSHY1-nsp进行定向进化,对其序列中的氨基酸进行定点突变,提高酶的高温稳定性。
本研究基于肠杆菌E.asburiaeZSH Y1降解植酸的特性,筛选、设计引物通过PCR技术克隆植酸酶基因,构建pET28a(+)重组表达质粒,在E.coliBL21(DE3)中实现异源表达。重组植酸酶PhyZSHY1-nsp,采用Ni-NTA和Q-Sepharose Fast Flow进行柱层析纯化;酶学分析表明植酸酶PhyZSHY1-nsp属于3-植酸酶,包含432个氨基酸,重组植酸酶的分子量为48817.21Da,等电点为5.72;酶催化反应的最适温度60℃,最适pH值为4.5,Mg2+、Cu2+、Zn2+、Al3+等金属离子及SDS对酶促反应有抑制作用;底物为植酸钠时,植酸酶Km为0.86mmol·L-1,kcat为16.04s-1,kcat/Km为18.66L·s-1·mmol-1。

