不同温度和盐胁迫下紫花苜蓿MsNAC2和MsNAC3基因提高毕赤酵母耐受性分析
申玉华,白玉东,范天宁,李守坤,梁耕源,陈焕,任秀鹏,郭芡芡,王浩安,林景卫
(1.赤峰学院化学与生命科学学院,内蒙古 赤峰 024001;2.沈阳农业大学生物科学技术学院,沈阳 110161)
转录因子作为分子开关与其靶基因上的顺式作用元件在时间与空间上调控基因的表达[1]。NAC蛋白是植物中已知最大的特异转录因子家族之一,1992年首次在拟南芥中报道NAC蛋白编码基因RD26[2],随着基因克隆技术的发展,已经在植物中鉴定出110多个NAC同源蛋白[3]。NAC蛋白N端高度保守,大约由160多个氨基酸残基组成,并且该家族所有蛋白质都有一个保守的N-末端DNA结合域,称为NAC结构域,该结构域最先在无顶端分生组织(NAM)、拟南芥转录激活因子(ATAF1/2)和杯状子叶蛋白(CUC2)中被鉴定[4],其C端保守性较低,但已有不少例子证明,其C端有转录激活功能[5-7]。NAC超家族的成员不仅存在于被子植物中,同时也存在于松树和苔藓植物中。其参与植物发育和非生物或生物胁迫反应有着紧密的关联[8]。功能研究表明,NAC蛋白在植物的生长发育中起重要作用,包括芽顶端分生组织的形成和维持、花的发育和形成、侧根的发育、激素信号、种子萌发和衰老等[9-11]。不仅如此,NAC转录因子还具有调节免疫作用,NAC基因可以在植物受到创伤或在细菌感染期间上调来增强免疫能力,也可以抵抗病毒的感染[12-13]。NAC基因表达量的降低也会导致植物免疫能力的下降。水稻中OsNAC6基因的敲除会损害植物对富营养化白粉病真菌的抗性[14]。绝大多数NAC基因对非生物胁迫敏感,并起着重要的调节作用。在分析拟南芥和水稻中的几种全基因组表达时,发现NAC基因至少由一种非生物胁迫诱导,如盐度、干旱、寒冷或ABA等[15-16]。NAC控制的过程主要取决于它们的转录特性,NAC既可以作为激活剂,也可以作为抑制剂。此外,它们的同源/异源二聚化能力也会影响其与DNA结合和激活特性[17]。由于NAC调节植物的生长发育和胁迫反应,因此对它们的深入了解有助于指导未来的作物改良研究。
紫花苜蓿是豆科蝶形花亚科苜蓿属,多年生优质牧草,富含蛋白质、维生素和多种矿物质元素,有着“牧草之王”的美誉[18]。申玉华等[19-20]利用RT-PCR和RACE技术在紫花苜蓿中克隆得到了2个新基因MsNAC2和MsNAC3,对其进行生物信息学分析和亚细胞定位试验,结果表明紫花苜蓿MsNAC2和MsNAC3属于NAC家族转录因子。运用real-time PCR方法研究在多种非生物逆境胁迫下的表达特性,表明MsNAC2和MsNAC3基因可能参与紫花苜蓿冷害、干旱、盐和ABA等非生物胁迫的生理响应。为进一步了解MsNAC2和MsNAC3的生物学功能,本研究从紫花苜蓿cDNA中克隆MsNAC2和MsNAC3基因,将其构建到pPIC9载体上,转化野生毕赤酵母,并以转pPIC9空载体酵母作为对照,在逆境胁迫条件下对转基因株系进行相关表型分析,为揭示Ms-NAC2和MsNAC3在紫花苜蓿逆境调控中的分子遗传机制奠定基础,同时为应用苜蓿NAC转录因子基因开展紫花苜蓿抗逆基因机理研究,以及通过转基因技术改善紫花苜蓿抗逆能力和提高其品质奠定基础,为进一步通过基因工程手段应用于植物抗逆转基因育种提供了理论依据。
1 材料与方法
1.1 材料
1.1.1 供试材料紫花苜蓿(Medicago sativaL.)、野生毕赤酵母、毕赤酵母对照株系(CK:转pPIC9载体)、pPIC9载体为实验室保存,大肠杆菌TOP10感受态细胞购自天根生化科技有限公司。
1.1.2 试剂盒和药品质粒小提试剂盒、胶回收试剂盒、pGM-T试剂盒、Frozen-EZ Yeast TransformationⅡKit-TM试剂盒为北京天根生化科技有限公司产品。氨苄青霉素、X-Gal、IPTG、限制性内切酶和T4连接酶购自大连Takara公司。
1.1.3 培养基LB培养基:蛋白胨10g·L-1,酵母粉5g·L-1,NaCl 10g·L-1(NaOH调节pH值至7.0)固体培养基添加琼脂粉15g·L-1,121℃,灭菌25min。YPD培养基:胰蛋白胨20g·L-1,酵母粉10g·L-1,葡萄糖20g·L-1(固体培养基加琼脂粉15g·L-1)110℃灭菌30min。BMMY培养基:YNB13.4g·L-1,胰蛋白胨20g·L-1,生物素4×10-5g·L-1,磷酸钠缓冲液20mL·L-1,甲醇1%(使用磷酸调pH=5.0)过滤灭菌30min。MD培养基:YNB13.4g·L-1,生物素4×10-5g·L-1,葡萄糖20g·L-1(pH溶于自然,固体培养基加琼脂粉15g·L-1),过滤灭菌30min。
1.1.4 PCR引物根据已知基因序列,通过primier5.0设计并合成MsNAC2和MsNAC3基因的全长引物,分别命名为A2-R、A2-F、A3-R和A3-F,在其C端引入6×His标签编码序列,并添加酶切位点(表1)。
1.2 方法
1.2.1 目的片段的基因克隆提取野生紫花苜蓿基因组DNA,用A2和A3上下游引物扩增MsNAC2和MsNAC3基因。反应程序:94℃3min;94℃30s;60℃30s;72℃30s(30个循环);72℃10min。PCR产物进行琼脂糖凝胶电泳检测,分别回收1020bp(MsNAC2)和1014 bp(MsNAC3)的片段,与克隆载体pGM-T连接,送上海生工测序。
1.2.2 pPIC9-His-MsNAC2、pPIC9-His-MsNAC3的载体构建MsNAC2和MsNAC3基因分别与T载体连接,测序。载体pGM-T-MsNAC2和pGM-T-MsNAC3和pPIC9分别用EcoRI和NotI进行酶切,胶回收,连接转化,测序。
1.2.3 重组载体转化酵母和PCR检测重组表达载体pPIC9-His-MsNAC2、pPIC9-His-MsNAC3用SacⅠ线性化,回收。用Frozen-EZ Yeast TransformationⅡKitTM试剂盒进行酵母转化,菌液涂布MD固体培养基30℃黑暗培养2d进行筛选,挑取MD培养基上的单菌落进行PCR检测。
1.2.4 重组酵母NAC蛋白检测SDS-PAGE检测:吸取PCR阳性菌株菌液加入YPD液体30℃培养至OD=1.0,将培养完的菌液离心,重溶于BMMY液体培养基30℃黑暗培养4d,每24h进行一次1%甲醇补加并继续诱导培养。离心取发酵液上清,水浴锅变性5min,进行SDS-PAGE凝胶电泳,G250考马斯亮蓝染色。West Bolt检测:将样品进行SDS-PAGE凝胶电泳,转膜、封闭、一抗和二抗孵育、ECL显色、PVDF膜直接显色。
1.2.5 重组酵母温度胁迫酵母细胞在30°C的YPD培养基中培养至对数中期。离心收集细胞沉淀,并用无菌生理盐水清洗。将细胞悬液浓度调整为OD600=1.0。制备细胞悬液的10-1,10-2,10-3系列稀释液用于斑点试验。于37℃和16℃在固体YPD板上观察等量的细胞生长状况拍照记录。
1.2.6 重组酵母盐胁迫酵母细胞在30℃的YPD培养基中培养至对数中期。离心收集细胞沉淀,用无菌生理盐水清洗。将细胞悬液浓度调整为OD600=1.0。制备细胞悬液的10-1,10-2,10-3系列稀释液用于斑点试验。在100mmol·L-1和200mmol·L-1NaCl浓度的固体YPD板上观察等量的细胞生长状况,2d后拍照记录。
2 结果与分析
2.1 MsNAC2和MsNAC3克隆
由图1可知,在引物上C端引入6×His标签克隆MsNAC2和MsNAC3基因,在1020bp和1014bp处目的条带单一,胶回收与克隆载体pGM-T连接,测序结果正确,表明MsNAC2和MsNAC3基因被成功克隆。
2.2 pPIC9-His-MsNAC2和pPIC9-His-MsNAC3重组表达载体构建
用EcoRI和NotI进行分别对克隆载体pGM-T-MsNAC2、pGM-T-MsNAC3和pPIC9进行双酶切,回收,连接,转化。对菌落进行菌落PCR鉴定,提质粒,进行双酶切检测。由图2可知,酶切结果和已知克隆片段大小一致,成功构建酵母重组表达载体pPIC9-His-MsNAC2和pPIC9-His-MsNAC3(图3)。

图1 MsNAC2和MsNAC3基因PCR结果Figure 1 MsNAC2和MsNAC3 gene PCR result
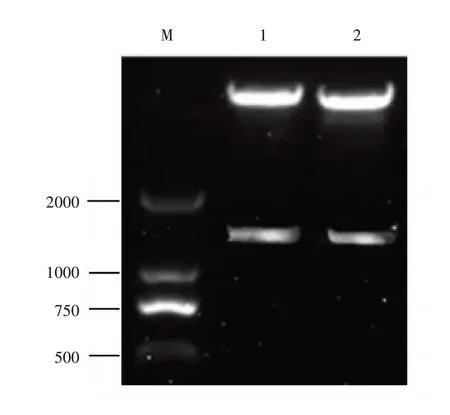
图2 pPIC9-His-MsNAC2、pPIC9-His-MsNAC3酶切结果Figure 2 pPIC9-His-MsNAC2,pPIC9-His-MsNAC3 digestion
2.3 重组酵母转化PCR鉴定
分别将重组载体pPIC9-His-MsNAC2和pPIC9-His-MsNAC3用SacⅠ进行单酶切,酶切回收产物用酵母转化试剂盒转入野生毕赤酵母当中,对长出的单菌落进行PCR鉴定,在1000bp处存在明显DNA条带,表明线性化载体成功转入毕赤酵母当中,确定了阳性转化子进行下一步试验(图4)。
2.4 重组酵母NAC蛋白鉴定
对重组酵母转化子的发酵液上清进行SDS-PAGE和Western Bolt检测,图5中1号泳道为野生毕赤酵母,2号和3号泳道为MsNAC2重组酵母,4号和5号泳道为MsNAC3重组酵母。在2号、3号、4号和5号泳道中可见明显单一蛋白条带。其为Western bolt结果与SDS-PAGE结果对应,表明重组蛋白rMsNAC2和rMsNAC3得以表达,重组酵母正确,并分别将MsNAC2和MsNAC3的重组转化子命名为A2和A3。
图3 表达载体pPIC9-His-MsNAC2和pPIC9-His-MsNAC3示意图Figure 3 pPIC9-His-MsNAC2 and pPIC9-His-MsNAC3 vector
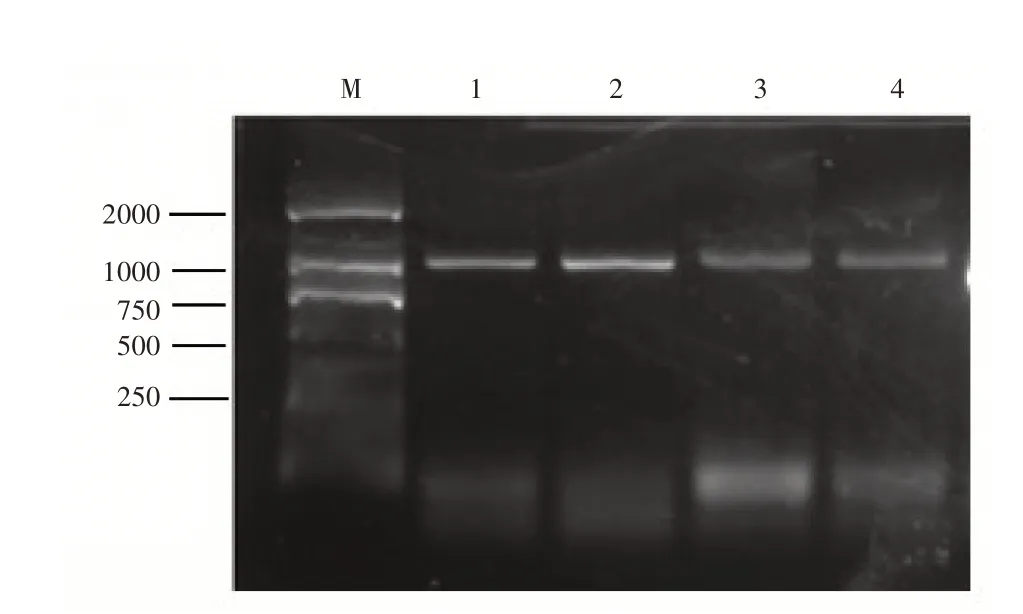
图4 pPIC9-His-MsNAC2和pPIC9-His-MsNAC3毕赤酵母转化子菌落PCR鉴定图Figure 4 PCR of pPIC9-His-MsNAC2 and pPIC9-His-Ms-NAC3 P.pastoris transformants colonies
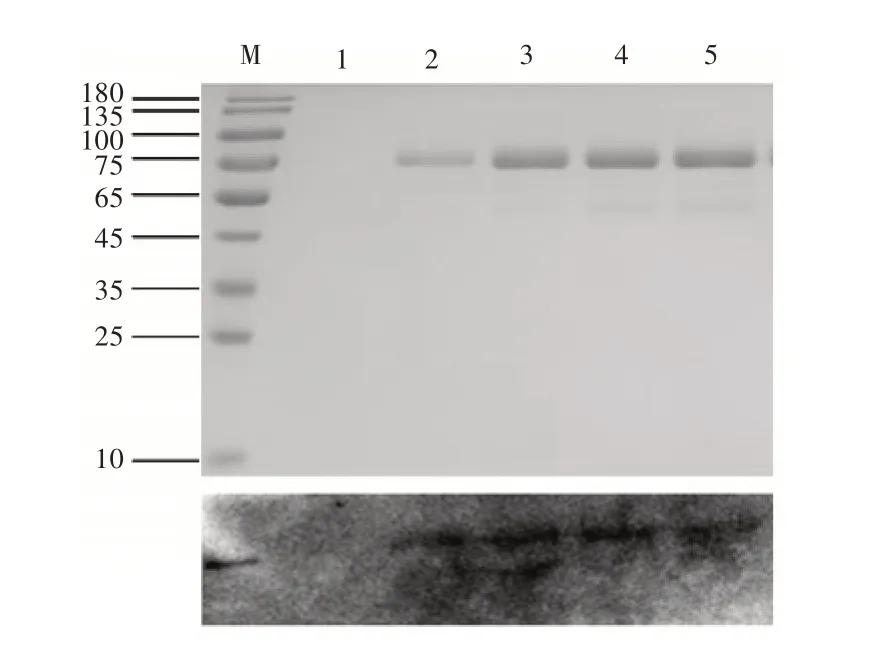
图5 rMsNAC2、rMsNAC3的SDS-PAGE和Western Bolt检测结果Figure 5 SDS-PAGE detection results of rMsNAC2 and rMsNAC3
2.5 重组酵母抗逆性验证
由图6可知,A2、A3和CK在非胁迫条件下(30℃,YPD)表现出相似的生长力,生命力和成活率无明显差异,表明转入MsNAC2和MsNAC3对酵母的正常生长发育未产生较大的影响。在16℃处理5d时,CK几乎不生长,A2和A3仍可以生长,并且A2表现出更好的耐受性;在37℃处理2d时,酵母稀释10倍的情况下,明显可以看出A2和A3依然保持着较高的成活率,而CK的成活率明显低于A2和A3。在温度胁迫下,转基因酵母成活率明显高于野生型,且A2>A3>CK。在100mmol·L-1NaCl处理2d,酵母稀释1000倍的情况下,A2和A3的生长情况略好于CK;将NaCl浓度提高到200mmol·L-1时处理2d,酵母稀释10倍的情况下,CK无生长迹象,而A2和A3依然可以生长,并且A2成活率最高。试验表明,酵母中转入MsNAC2和MsNAC3有助于提高其对温度、盐胁迫的耐受性,且酵母A2在成活率和生命力上表现得最为优异。
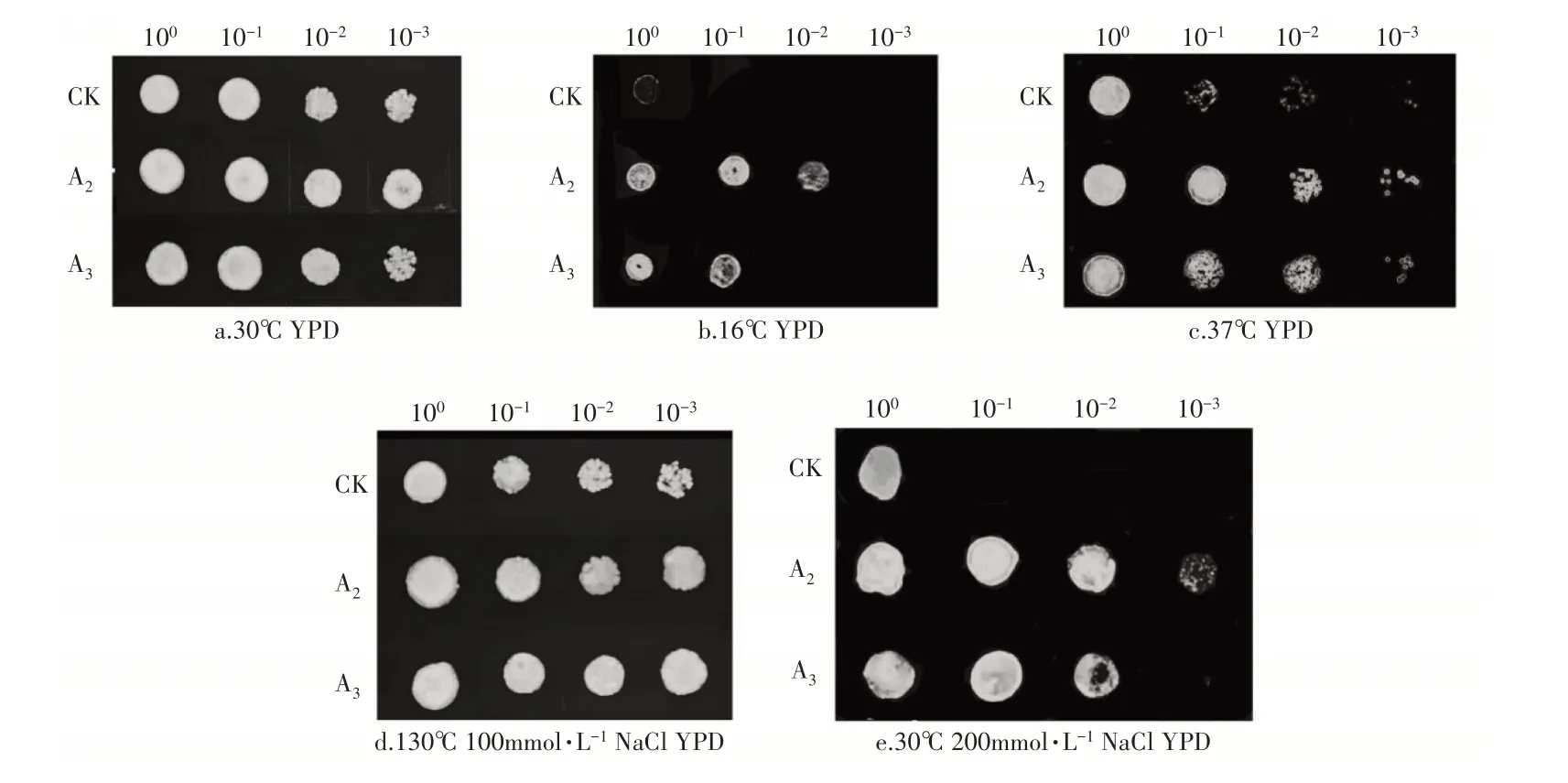
图6 CK、A2、A3酵母在不同处理下斑点图Figure 6 Spots of CK,A2 and A3 yeast under different treatments
3 讨论与结论
非生物胁迫对植物生长和农业生产有着不利的影响。NAC蛋白作为植物中最大的转录因子家族之一,在调节植物生长发育过程和非生物胁迫反应中起着重要作用。大量研究表明,许多响应胁迫的NAC转录因子已被用于基因工程来提高作物的抗逆性。
近年来,利用酵母表达系统对抗逆基因的功能进行分析已经成为常规手段。GAO等[21]将ThVHAc1基因转入酵母,对其进行抗盐、干旱、活性氧、重金属、低温、高温等胁迫的功能分析。杨桂燕等[22]从柽柳中克隆获得ThGSTZ1基因,将其构建到表达载体pYES2上,转化酵母并获得了过表达酵母株系(pYES2-ThGSTZ1),对过表达ThGSTZ1基因酵母进行不同的胁迫处理,从而研究该基因在酵母中的抗逆功能。这种例子还有很多,如粟莉圆等[23]将转JrDSTau1基因酵母进行盐、镉、温度的胁迫处理,相较于对照组,转基因酵母展现出更强的生命力和更高的成活性。众多的试验也证明了酵母表达系统是研究抗逆基因功能的良好材料。本研究也利用了酵母表达系统,先在紫花苜蓿cDNA中克隆MsNAC2和MsNAC3基因,构建pPIC9-His-MsNAC2和pPIC9-His-MsNAC3真核穿梭载体,转入毕赤酵母,最后通过PCR、SDS-PAGE、West bolt的分子手段鉴定得到MsNAC2和MsNAC3转基因株系A2、A3。在试验设计中,为保证转基因菌株筛选正确,规避PCR检测的假阳性,在基因的C端引入组氨酸标签用来蛋白表达检测。刘昀等[24]在探究外源PM2蛋白及缺失多肽的表达可提高酵母的耐盐能力时,分别用了带组氨酸标签和不带组氨酸标签的转基因菌株进行了试验,两种方法耐盐的保护作用大小均为:PM2C>PM2B>PM2A≈PM2,表明组氨酸标签的存在并未影响LEA3融合蛋白的耐盐能力[24]。说明引入组氨酸标签不仅不会影响基因在酵母中的功能,并且有利于转基因酵母的筛选和鉴定。
NAC转录因子一旦被激活,可以与基因启动子中的NAC识别序列(NACR)结合,通过调节下游非生物胁迫耐受性的靶基因转录从而提高植物的耐受性。本研究以转pPIC9空载体酵母作为对照,比较MsNAC2和Ms-NAC3转基因菌株A2、A3与CK的抗逆能力差异。试验结果表明,在盐胁迫处理下A2、A3和CK具有明显差异,酵母的成活率呈现出A>A3>CK的趋势。在香蕉中用组成型启动子过表达MusaNAC68基因,其许多应激反应基因的表达量有所提高,包括DREB、CBF和LEA基因等,并提高了香蕉的耐盐性[25]。根据XU等[26]的研究表明,马铃薯StNAC2基因可以响应多种非生物胁迫和SA、AB的应用诱导,其过度表达还赋予转基因马铃薯植株耐旱和耐盐性。类似的,菊花DgNAC1基因在转基因烟草中的过度表达明显增强了烟草对盐的耐受性[27]。鹰嘴豆CANAC3基因和番茄SlNAC3的异源表达分别提高了转基因杨树和番茄的耐旱性和耐盐性[28-29]。在番茄中沉默SlNAC11基因降低了番茄耐盐性和耐旱性,并影响了一些生理指标[30]。大多数NAC基因具有耐盐和耐旱性,但在一些例子中也显示了其具有耐温度胁迫的能力。拟南芥中过度表达小麦TaNAC2L转录因子,可以激活下游AtHsfA3、AtDREB2A、LEA等热相关基因的表达来增强植株耐热性;在拟南芥植株中过度表达Gm-NAC20和GmNAC11基因分别增强了植株冷和盐的耐受性,可能与这些基因参与DREB/CBF途径和其他胁迫相关基因的交互作用导致的[31]。本研究中也对MsNAC2和MsNAC3基因响应温度胁迫进行了试验,温度胁迫处理下A2、A3和CK也同样有显著差异,在37℃和16℃条件下酵母的成活率呈现出A2>A3>CK的趋势。本研究表明,紫花苜蓿MsNAC2和MsNAC3可以提高酵母的抗逆性,MsNAC2基因的抗逆功能优于MsNAC3,推测可能与有转录激活功能又高度变异的C端有关。MsNAC2和MsNAC3基因能积极地响应非生物胁迫应答,Ms-NAC2和MsNAC3基因可作为植物逆境适应机制研究的重要候选基因。

