欧亚类禽H1N1猪流感病毒研究进展
李海玲,张世伟,冯亚莉,冷昊钰,吕嘉铭,徐艺娜,苏超凡,汤思淇,王永涛,张莹
(沈阳农业大学动物科学与医学学院,沈阳 110161)
猪的呼吸道上皮细胞中存在SA-α-2,3-Gal(禽)和SA-α-2,6-Gal(人)受体,对禽流感病毒和人流感病毒的敏感性增强,可以充当甲型流感病毒(IAV)的中间宿主。并且在猪感染了猪流感病毒后,还可以同时感染禽流感病毒和人流感病毒,使猪、禽和人流感病毒之间发生重新组合,从而突破物种屏障,造成流感病毒的大流行。因此,猪被称为是“流感病毒的混合容器”[1]。猪可以感染不同亚型的流感病毒,包括H1、H2、H3、H4、H5、H7和H9亚型,其中H1N1亚型在猪群中最为流行,其次是H1N2和H3N2亚型[2]。H1N1亚型的猪流感病毒又可分为经典猪流感病毒(Classical swine H1N1,CS H1N1)、欧亚类禽H1N1猪流感病毒(Eurasian avian-like H1N1,EA H1N1)和2009年大流行H1N1病毒(2009 Pandemic H1N1,2009/H1N1)等。1979年,在比利时的猪群中发现了与1976~1977年间在南美和联邦德国的野禽中分离到的H1N1病毒的抗原性上有紧密联系的流感病毒。此后,该病毒便开始在欧洲和亚洲的猪群中流行,并形成了一个单独的分支,将其称为EA H1N1猪流感病毒[3-4]。随着养殖业的发展,猪群的数量也逐渐庞大起来,流感病毒便有了更多数量的传播媒介。VIJAYKRISHNA等[5]研究发现,自2005年起,EA H1N1猪流感病毒在猪群中就逐渐成为了流感病毒传播的主力。通过在禽、猪和人类之间的跳跃,病毒自身也在不断重组。针对其能够在人群和猪群中传播,且在猪流感病毒传播过程中占据着主导地位,本研究对EA H1N1猪流感病毒在国内外的流行状况、基因片段的重组、在哺乳动物中发生适应性突变而产生的功能影响和当前对其较为有效的防治措施方面进行综述,阐明了EA H1N1猪流感病毒能够在各个国家甚至世界范围内都占据主要的传播地位的原因,并分析了主流防治策略的现状。
1 欧亚类禽H1N1猪流感病毒的流行状况
1.1 欧亚类禽H1N1猪流感病毒在国内的流行状况
中国是全球范围内最大的生猪养殖和猪肉消费国,因此更需关注猪群之间的病毒传播。EA H1N1猪流感病毒在中国流行的时间轴如图1。GUAN等[6]研究发现,在中国,除了1993年在猪群中分离得到的两株“纯禽源”猪流感病毒外,1998年之前所发现的猪流感病毒均属于CS H1N1猪流感病毒谱系。通过主动检测,于2001年首次在香港特别行政区的猪群中发现EA H1N1猪流感病毒。中国的猪群对这种病毒的抗体交叉反应率在2000年仅为15%,2004年略微升高至26%,再加上EA H1N1猪流感病毒具有快速复制的能力,使其在中国猪群中的传播逐渐占据了主导,取代了当时流行的经典猪流感病毒和三重排猪流感病毒[5]。2007~2008年,在中国部分省市(福建省、山东省和北京市)共分离出10株EA H1N1猪流感病毒,与当时在欧洲地区流行的病毒(A/swine/Cotes d’Armor/1488/99)有着密切的联系[7]。可见,EA H1N1猪流感病毒在中国的传播速度之快,分布范围之广。2009年5月,2009/H1N1猪流感病毒在中国首次被发现,并在全国范围内进行传播[8],为EA H1N1猪流感病毒基因片段的重组提供了更多的选择。2009~2010年在中国南方部分地区(广西壮族自治区和广东省)的屠宰厂内,共分离得到19株EA H1N1猪流感病毒,其中10株的HA和NA基因来自EA H1N1猪流感病毒谱系;PB2、PB1、PA、NP、NS和M基因来自2009/H1N1猪流感病毒谱系。该重组病毒不仅能改变传播方式,还可以在人类体外的肺部细胞中复制[9]。由于中国庞大的猪群数量以及较低的疫苗普及率[10],不同亚型的猪流感病毒或多种基因型的EA H1N1猪流感病毒在猪群中共同传播的现象时有发生[11-13],这种共同传播可能会加速猪流感病毒的重组,产生的重组EA H1N1猪流感病毒在病原学上发生了一定程度的改变。于2011年开始为期8年,对中国10个生猪密度较高的省份开展猪流感检测项目。研究发现,中国猪群之间流行的流感病毒中,EA H1N1为最主要的亚型(179株猪流感病毒中占比92.2%)。并且根据其基因片段的差异可进一步划分成6种基因型(G1~6基因型,各自基因片段的来源如表1),其中,G4基因型的EA H1N1猪流感病毒的潜在危害较大,在人类中的感染率逐年增加,特别是18~35岁年龄段的年轻的猪养殖工作者,在所测样本中的血清阳性率为20.5%(9/44)。这种基因型的猪流感病毒可以优先结合SA-α-2,6-Gal(人)受体,在人群中的传播能力增强,并且还可以通过气溶胶的传播方式感染雪貂。相较于G1基因型的EA H1N1猪流感病毒,其不仅在小鼠体内表现出了更强的致病力[14],在猪体内还保持着更快的复制速率、更强的致病性和更高的聚合酶活性,逐渐成为EA H1N1猪流感病毒中的优势基因型[15]。CHEN等[16]在广西省的犬体内分离出1株G4基因型的EA H1N1猪流感病毒,证明其实现了从猪到犬的跨物种传播。提示,犬相比于其他动物与人类活动更为密切,频繁的接触为流感病毒的扩散提供了有利的条件,应尤为注意。此外,李梓等[13]于云南分离出的G4基因型的EA H1N1猪流感病毒在氨基酸位点和抗原性上与现阶段世界卫生组织(WHO)推荐的疫苗株A/Hunan/42443/2015(G5基因型)有明显不同,且目前存在的人流感病毒疫苗已无法提供有效的保护。因此,针对其具有威胁公共卫生安全的潜力,及时组建更加合适的疫苗株,制定更加有效的防控措施很有必要。2011年,江苏省出现了1例人类感染EA H1N1猪流感病毒的临床案例,证实了EA H1N1猪流感病毒可以突破物种屏障,在人群中进行传播的猜想[17-18]。该病毒与2010~2011年间在江苏省分离得到的部分EA H1N1流感病毒的8个基因片段的同源性为99.1%~99.8%,表明在中国的猪群中EA H1N1猪流感病毒的传播具有地方性的特点[8]。值得一提的是,该地区屠宰场42.8%的猪血清对EA H1N1猪流感病毒呈阳性[19]。2012年12月,河北省出现人感染EA H1N1猪流感病毒的病例,该病毒与2011年在江苏省发现的病毒同源性为98.9%~99.6%[20]。2015年,在湖南省发现的1株重组EA H1N1猪流感病毒,其HA、NA和M基因来自EA H1N1猪流感病毒谱系;PB2、PB1、PA和NP基因来自2009/H1N1猪流感病毒谱系;NS基因来自CS H1N1猪流感病毒谱系。这种重组的EA H1N1猪流感病毒在被感染的儿童身上表现出更明显的临床症状,在小鼠体内也表现出更强的传播和复制能力[21]。在这之后,将这一毒株分别接种于小鼠和雪貂,发现其在小鼠模型上的毒力比以往其他的分离株更强,并且具有通过空气中的飞沫在雪貂之间传播的能力[22]。2016年,在福建省1名患者的咽部分离得到的EA H1N1猪流感病毒(A/Fujian-cangshan/SWL624/2016),其HA和NA基因来自EA H1N1猪流感病毒谱系;PB2、PB1、PA、NP和M基因来自2009/H1N1猪流感病毒谱系;NS基因来自CS H1N1猪流感病毒谱系。这种基因型的EA H1N1猪流感病毒具有在人群中传播的潜能,在哺乳动物体内的毒力较强,并且产生了一定程度的耐药性,有利于其传播[23]。2018年,天津市疾控中心从1名伴有明显流感症状的男孩身上分离出1株发生重组的EA H1N1猪流感病毒,其重组方式与A/Fujian-cangshan/SWL624/2016相似[24],展现了EA H1N1猪流感病毒强大的跨地区传播能力。ZHOU等[25]于中国南方的部分地区(广东省、浙江省、云南省和福建省)采集了1180个猪血清样本,其中219个样本对EA H1N1猪流感病毒的抗体呈阳性,这些省份都是禽类养殖的主要地区。由此可见,EAH1N1猪流感病毒的出现,不断冲击着生猪养殖行业,偶尔还会与不同谱系的猪流感病毒发生重组,产生不同的基因型,再一次巩固了其在猪流感病毒传播中的地位。
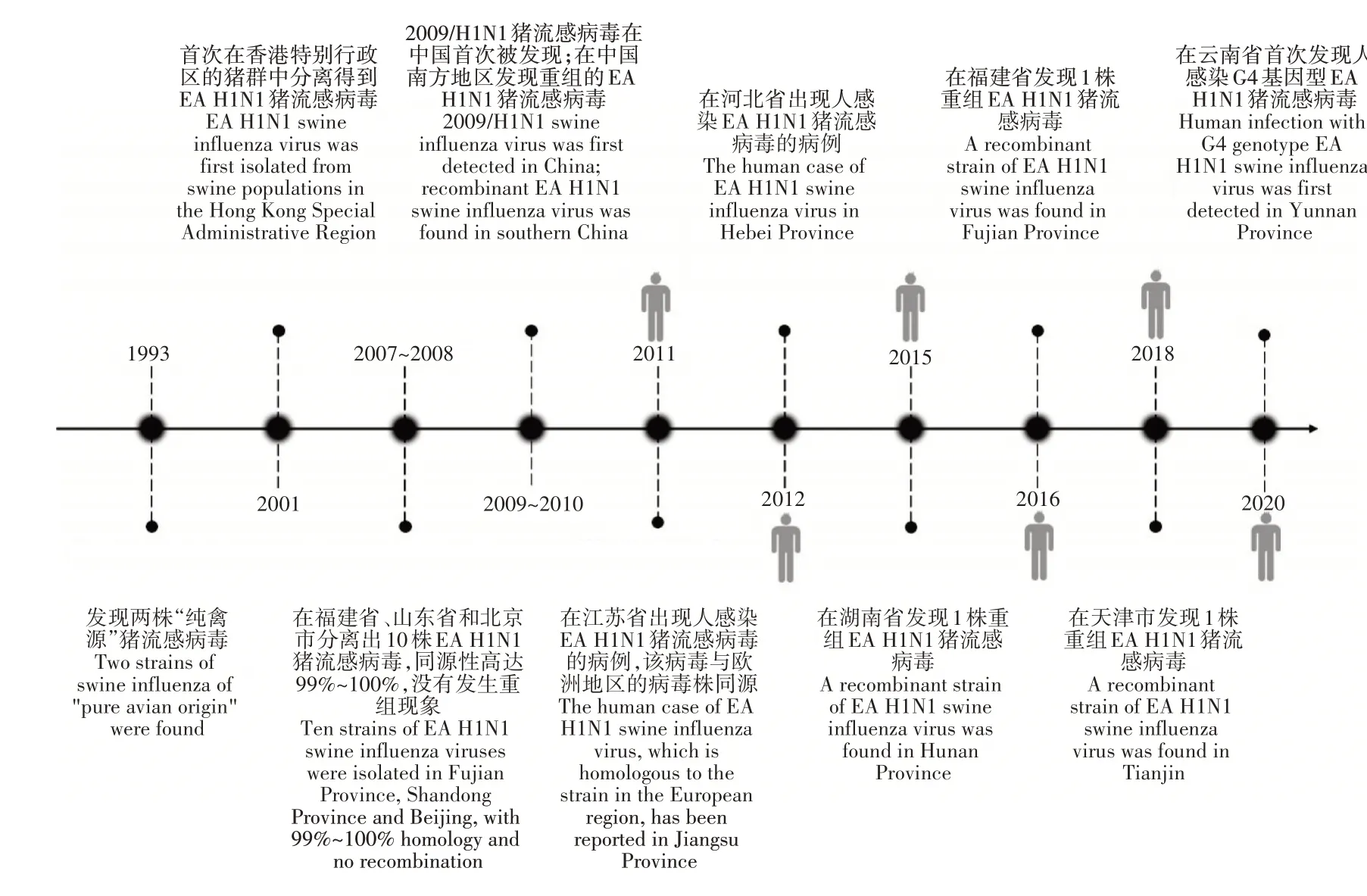
图1 EA H1N1猪流感病毒在国内流行的时间轴Figure 1 Timeline of the domestic epidemic of EA H1N1 swine influenza virus

表1 2011~2018年中国10个省份6种基因型的EA H1N1猪流感病毒Table 1 Six genotypes of EA H1N1 swine influenza virus in 10 provinces of China,2011-2018
1.2 欧亚类禽H1N1猪流感病毒在国外的流行状况
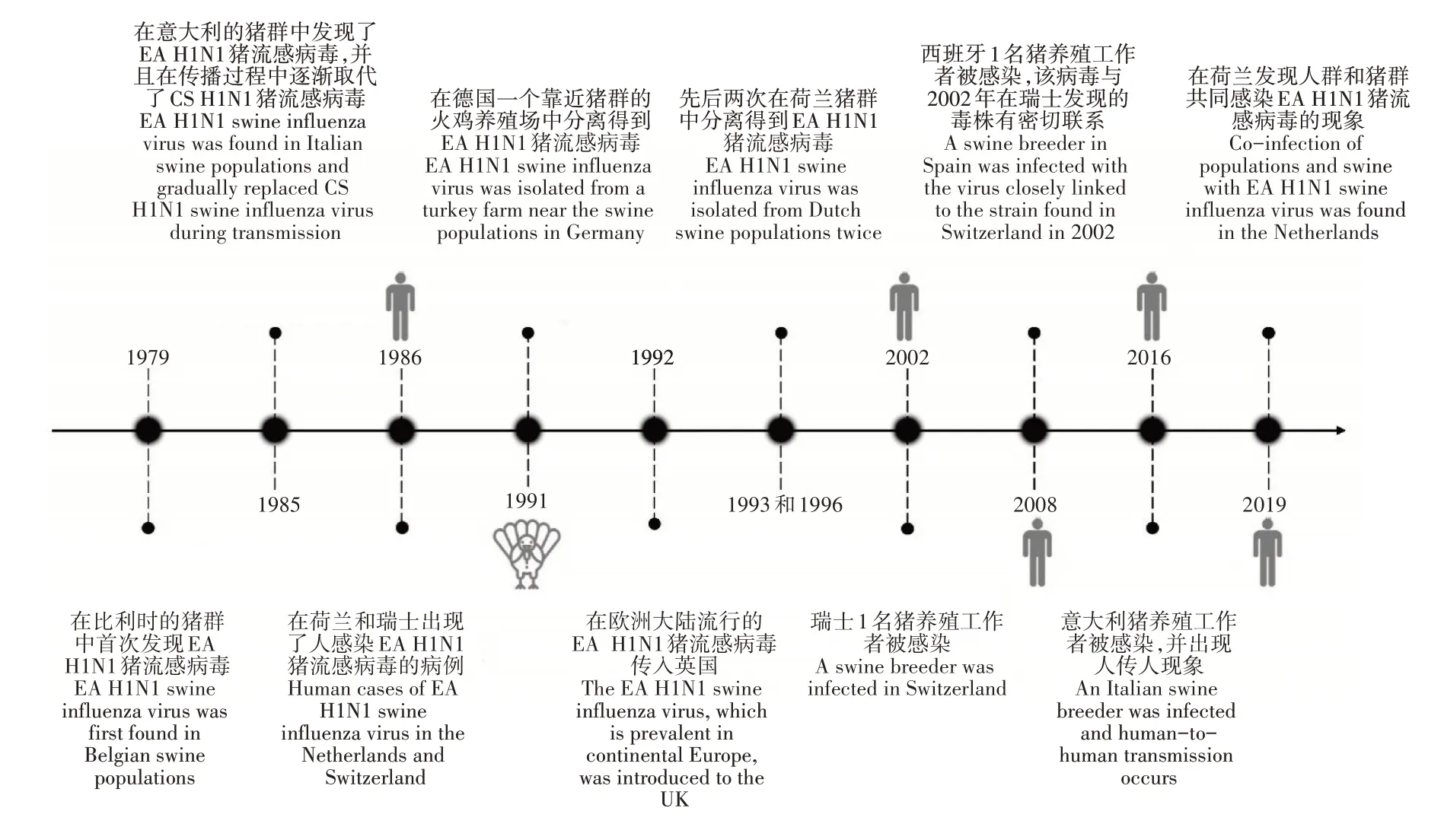
图2 EA H1N1猪流感病毒在国外流行的时间轴Figure 2 Timeline of EA H1N1 swine influenza virus epidemic in foreign countries
OTTIS等[4]研究发现,禽源的H1N1猪流感病毒株可以感染猪,并通过接触在猪群中进行传播。欧洲地区(意大利)的猪群对EA H1N1猪流感病毒的适应可以表明,与其他猪流感病毒相比,EA H1N1猪流感病毒在猪群中的传播更有优势,其在抗原和基因上与人类H1N1流感病毒存在差异,这种差异将会导致疫苗间不能发生交叉保护,具有造成下一次流感大流行的潜力[26]。与此同时,由于猪群对禽类病毒较为敏感[27],是来自禽源的EA H1N1猪流感病毒较为适宜的宿主,为EA H1N1猪流感病毒的生存和传播提供了支持。EA H1N1猪流感病毒于1979年被发现后,在欧洲和亚洲猪群中便开始迅速传播,偶尔可突破物种屏障造成人类感染(图2)。1985年在意大利的猪群中出现,并在传播过程中逐渐取代了当时流行的CS H1N1猪流感病毒,在猪流感病毒的传播中占据主要地位[28]。1986年,在瑞士和荷兰的患者体内[29]与1991年在德国的一个靠近猪群的火鸡养殖场中都发现了EA H1N1猪流感病毒,进一步证实了该病毒具有跨物种传播的可能性[30]。1992年欧洲地区中流行的EA H1N1猪流感病毒侵入到了英国[31]。于1993年和1996年,先后两次在荷兰的猪群中分离得到了EA H1N1猪流感病毒,主要在猪群中传播,暂时没有与人类或禽类病毒发生重组,且并未出现抗原漂移的现象[32-33],表明在该地区,病毒正进行着稳定且持续的传播。通过在不同物种之间不断地跳跃,EA H1N1猪流感病毒的传播速度和范围也在逐渐变大。2002年,瑞士1名猪养殖工作者的感染,在时间上展现了其较强的持续传播能力[34]。2008年,在西班牙也发现1名猪养殖工作者感染EA H1N1猪流感病毒的临床案例,通过基因测序发现其与2002年在瑞士分离得到的流感病毒株(A/Swiss/8808/2002)具有密切的亲缘关系,在空间上则体现了其较广的传播范围[35-36]。2016年,意大利的1名患者与一对在猪养殖场工作并且最近出现轻微呼吸道症状的兄弟接触后,表现出了较为明显的流感症状。对兄弟2人所在养殖场的猪群进行病毒学调查,发现呈IAV阳性,并分离得到1株EA H1N1猪流感病毒,其8个基因片段均来自EA H1N1猪流感病毒谱系[37]。2017~2018年,VANDOORN等[38]研究发现,比利时免疫功能正常的人群对于EA H1N1猪流感病毒的血清抗体反应率普遍不高(≥24%),奠定了其在该地区流行的基础。2019年,在荷兰发现了人和猪群共同感染EA H1N1猪流感病毒的情况,但没有进一步人传人的报告出现,未发生重组[39]。CHEPKWONY等[40-42]对从荷兰和比利时分离出的89株猪流感病毒样本进行统计发现,EA H1N1猪流感病毒占比最高,为44.9%(40株),且相较于欧洲类人H1亚型的猪流感病毒和CS H1N1猪流感病毒进化得更快。同样,在德国分离的850株猪流感病毒中占比35.7%[43],在法国分离的887株猪流感病毒中占比69.6%[44]。可以看出,EA H1N1猪流感病毒在一些国家出现后,分布广泛,承担了主要的传播责任。此外,与中国的观察结果相似,2009/H1N1猪流感病毒在欧洲的出现,也提高了该地区EA H1N1猪流感病毒发生重组的概率。HENRITZI等[45]研究表明,其通过与来自2009/H1N1猪流感病毒的内部基因片段组合,产生了多种不同的基因型,其中仅M基因被替换的病毒株占比高达12.9%(30/233),但其是否具有更大的威胁,还需要进行更加深入的研究。综上,相比于中国,EA H1N1猪流感病毒在这些国家的传播相对稳定,很少发生基因片段的重组,可能与不同国家针对猪养殖的策略或疫苗的普及程度有关。因此,鉴于各个地区流感病毒复杂的流行特点,为防止新的重组病毒的产生,应在疾病出现前采取有效的预防措施或在发病初期及时施加合理的治疗手段,以避免不同亚型或不同基因型的EA H1N1猪流感病毒的共同传播。
2 在分子水平上分析为何欧亚类禽H1N1猪流感病毒具有适应性优势
IAV是裂解性RNA病毒,其变异速度比逆转录病毒高出一个数量级。2009~2013年,将中国进行的猪流感病毒检测项目期间分离出来的属于EA H1N1猪流感病毒谱系的3个毒株与用于疫苗研制的毒株进行比较,发生了1~11个氨基酸位点突变[46]。这种改变产生的未知影响削弱了人们对EA H1N1猪流感病毒的控制,使其在传播过程中逐渐掌握了主动权,本研究涉及到的关键氨基酸位点如表2。
2.1 HA蛋白关键氨基酸位点
血凝素(HA)将含唾液酸的细胞表面糖蛋白识别为受体并与之结合,诱导膜融合并转导病毒进入细胞质中,从而引发感染[47]。HA蛋白由HA1和HA2两种多肽组成。与HA2多肽相比,HA1多肽似乎更容易发生突变,对病毒在哺乳动物的适应性方面有重要的影响[48]。并且与CS H1N1猪流感病毒相比,EA H1N1猪流感病毒的HA蛋白进化的速度更快,优先与SA-α-2,6-Gal(人)受体结合[10],这种变化也可能是EA H1N1猪流感病毒在猪群中可以持续而又快速的传播的因素之一[31]。WANG等[49]利用反向遗传学的方法产生突变体并在豚鼠体内进行试验,发现EA H1N1猪流感病毒的HA1中发生了G225E氨基酸位点的突变,这种改变使病毒的复制加快。该发现将会在猪流感病毒传播能力强弱的预测中起关键作用。EA H1N1猪流感病毒的HA中存在着D127E和D222G氨基酸位点的突变,这两种改变可使2009/H1N1猪流感病毒在小鼠体内的适应性增强[50-51]。除此之外,在中国流行的EA H1N1猪流感病毒的HA中还存在着E190D氨基酸位点的突变,携带这种突变氨基酸的病毒更易与SA-α-2,6-Gal(人)受体结合,使其在人群中的传播变得更加高效[52]。HA1中氨基酸位点突变的积累通常会导致抗原漂移,持续的抗原漂移会促使流感病毒逃避宿主的免疫反应,严重影响疫苗作用的发挥。抗原决定域Sa位于与受体结合的近端,其中G158E氨基酸位点的突变,降低了HA蛋白与抗体结合的亲和力,且由于氨基酸的替换,HA蛋白的空间结构上也发生了一定程度的改变,共同促使EA H1N1猪流感病毒发生抗原漂移,有利于其在猪群和人群中的传播[53]。
2.2 PB2蛋白关键氨基酸位点
PB2蛋白能够识别并结合宿主mRNA,协助病毒mRNA的合成[54]。CAI等[55]通过产生重组病毒并进行对比,发现PB2蛋白是病毒在小鼠中致病性强弱的主要决定因素。通过进一步分析表明,PB2-R251K氨基酸位点的突变可以增强EA H1N1猪流感病毒(A/swine/Guangdong/MS285/2017)的毒力。冯兆民等[56]经序列分析并对比2株从人体内分离出来的EA H1N1猪流感病毒发现,A/Hunan/42443/2015(H1N1,HuN)和A/Jiangsu/1/2011(H1N1,JS1)在PB2蛋白的第271位上的氨基酸不同,分别为A和T,从而得出结论,PB2-T271A氨基酸位点的突变增强了EA H1N1猪流感病毒在宿主细胞中的复制能力、聚合酶活性和在小鼠体内的致病力。病毒株(A/Hunan/42443/2015)上PB2-T588I氨基酸位点突变的出现,使其在哺乳动物体内的复制效率提高,在小鼠体内的致病性上也表现出了一定程度的增强,并且显著提升了PB2蛋白抑制干扰素生成的能力,影响机体抗病毒反应[57]。XU等[11]通过对比从中国辽宁省屠宰场的猪群中分离出来的两株EA H1N1猪流感病毒[A/swine/Liaoning/ZD71/2015(ZD71)和A/swine/Liaoning/SY130/2015(SY130)]发现,ZD71病毒株PB2蛋白的氨基酸位点上出现了T431M突变,通过影响病毒核糖蛋白复合物(RNP)的聚合酶活性,使其在小鼠体内的毒力增强,但在病毒的传播方面是否有影响尚不清楚。此外,EA H1N1猪流感病毒的PB2蛋白上还存在着L89V、Q591R、E627K或D701N突变,同样可以增强EA H1N1猪流感病毒在宿主细胞中的适应性[23,58-60]。
2.3 PA蛋白关键氨基酸位点
PA蛋白主要在流感病毒聚合酶复合物组建的过程中发挥作用,参与流感病毒RNA的转录与复制过程[61]。研究发现,分别于长沙市、福州市和天津市分离得到的3株EA H1N1猪流感病毒(A/Hunan/42443/2015、A/Fujian-cangshan/SWL624/2016和A/Tianjin-baodi/1606/2018)中都存在L336M、K356R和S409N氨基酸位点的突变,使病毒在小鼠体内的聚合酶活性升高,增强其在哺乳动物体内的适应性[23-24]。
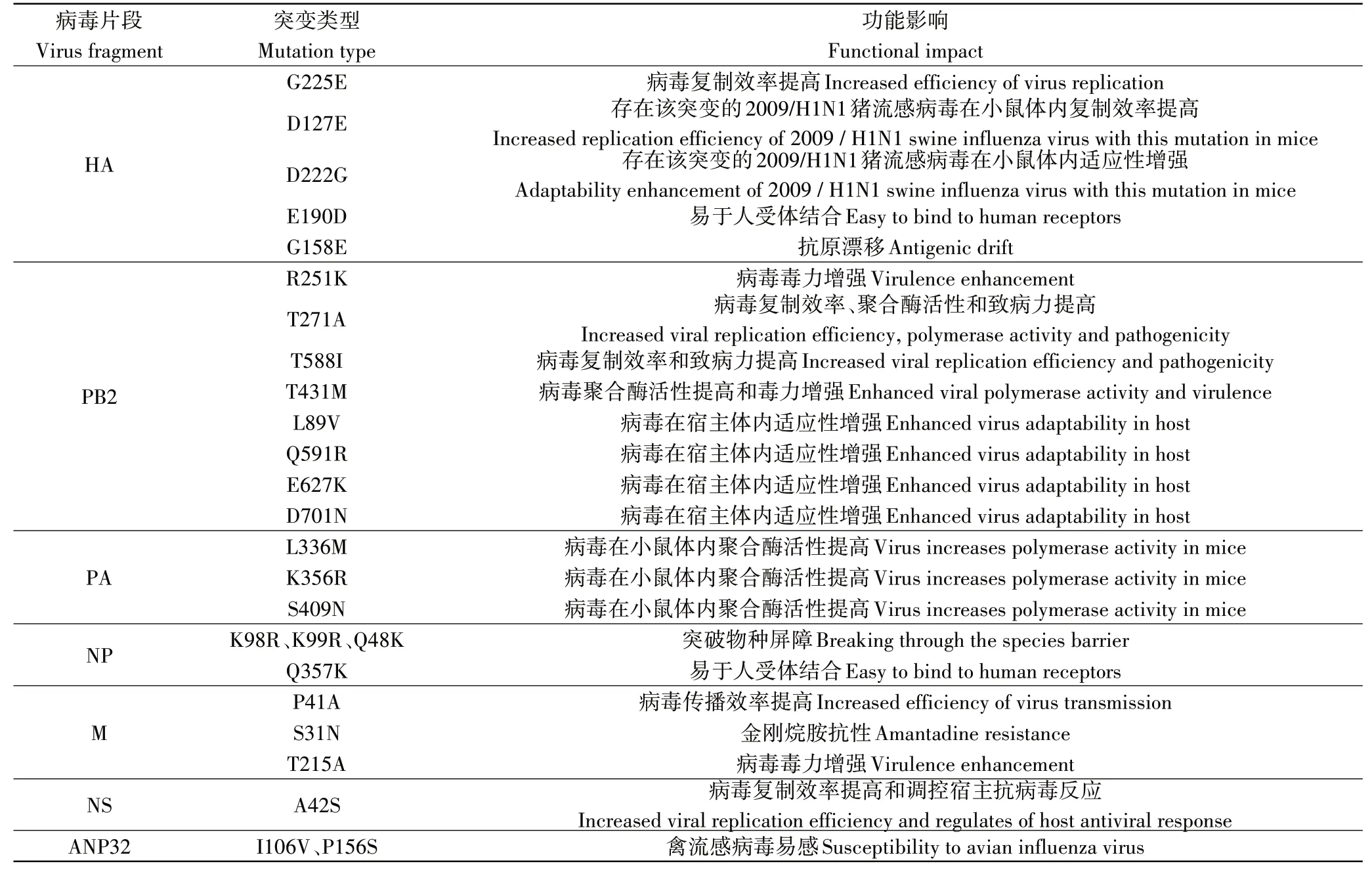
表2 EA H1N1猪流感病毒关键氨基酸位点Table 2 Key amino acid sites of EA H1N1 swine influenza virus
2.4 NP蛋白关键氨基酸位点
核蛋白(NP)和病毒基因组能与PB2、PB1和PA共同组成的流感病毒聚合酶复合物结合成RNP,在病毒的转录、复制和翻译的过程中发挥关键作用[62]。MxA蛋白有效的抑制了IAV和其他几种人类RNA病毒在宿主体内的复制[63-64]。MÄNZ等[65]研究发现,所有能适应人类的IAV,都会在其NP蛋白中发生适应性突变,使它们能够避开MxA蛋白的限制。EA H1N1猪流感病毒(A/Swine/Belzig/2/2001)NP蛋白中的K98R、K99R和Q48K突变使其突破了MxA蛋白的限制。因此,发生了这3个氨基酸位点突变的EA H1N1猪流感病毒可以突破物种屏障,在人群中传播,扩大了适合其寄生的宿主的范围[66]。此外,NP蛋白中Q357K氨基酸位点的突变也是EA H1N1猪流感病毒逐渐适应哺乳动物而产生的标志,其在禽类中主要以NP-357Q的形式存在,在猪中则突变为NP-357K。比较而言,携带NP-357K的EA H1N1猪流感病毒更容易在人体内传播,因此具有更大的潜在威胁[67]。
2.5 M蛋白关键氨基酸位点
流感病毒基质蛋白(M)包括基质蛋白M1与膜蛋白M2。M1蛋白位于包膜下方,是病毒中含量最丰富的蛋白质,主要在病毒的组装和萌发过程中发挥作用。M2蛋白作为离子通道,是金刚烷胺的作用位点[68]。其中,M1蛋白的P41A氨基酸位点的突变,使EA H1N1猪流感病毒的粒子形态发生了改变,提高了EA H1N1猪流感病毒的传播效率[69]。其上的T215A氨基酸位点的突变则增强了EA H1N1猪流感病毒在小鼠体内的毒力[24]。金刚烷胺是1种有效的抗病毒药物,被批准应用于流感病毒的防治。EA H1N1猪流感病毒中M2蛋白的氨基酸位点上出现了S31N取代,使其产生了对金刚烷胺的抗性[70]。具有该适应性突变的猪流感病毒株的出现,势必会降低人类对EA H1N1猪流感病毒的可控性。
2.6 NS蛋白关键氨基酸位点
非结构蛋白NS1和NS2由病毒RNA编码,主要在流感病毒的发育增殖周期中发挥作用。NS1蛋白能够抑制干扰素的抗病毒作用,阻抑宿主免疫反应,NS2蛋白则与病毒的组装相关[71]。LI等[72]研究发现,EA H1N1猪流感病毒中NS1蛋白A42S氨基酸位点的突变,能够提高病毒的复制效率,且在调控宿主细胞的抗病毒反应中起关键作用。
2.7 宿主蛋白关键氨基酸位点
酸性(含亮氨酸)核磷蛋白32家族可与流感病毒聚合酶相互作用,其中的ANP32A和ANP32B蛋白的存在对于IAV的复制来说是不可或缺的条件[73]。猪的ANP32A蛋白在ANP32蛋白中是一个独特的存在,为禽流感病毒的聚合酶活性和病毒的复制提供了帮助[74]。ZHANG等[75]研究发现,由于猪的ANP32A蛋白出现了I106V和P156S氨基酸位点突变,因此,对禽流感病毒聚合酶活性的支持较ANP32B或其他哺乳动物的ANP32蛋白更强。证明了猪群在禽、猪和人3个物种之间的病毒传播中承担了桥梁的连接作用。EA H1N1猪流感病毒通过在猪群和人群之间的快速传播,使得其氨基酸位点不断发生突变,产生了与哺乳动物更加适合的基因型。
EA H1N1猪流感病毒在哺乳动物中产生的不同类型的适应性突变使人们需要不断调整对其的防控措施,所造成的功能上的影响也是动态的,暂时无法使用一种通用的手段将其完全遏制,其通过这种变化保证了在猪流感病毒传播中的地位。
3 欧亚类禽H1N1猪流感病毒的诊断和防治
3.1 欧亚类禽H1N1猪流感病毒的诊断
通过对患病动物进行流行病学的调查,并结合其临床症状表现及病理解剖,有助于做出EA H1N1猪流感病毒感染的初步诊断(体温升高并伴有呼吸系统症状等),基于此,还需结合更加准确的实验室诊断方法进一步确诊。其中应用较为广泛的包括病毒的分离与鉴定、血凝(HA)和血凝抑制(HI)试验、酶联免疫吸附试验(ELISA)和聚合酶链式反应(PCR)等。传统的诊断方法(病毒的分离和鉴定与HI和HA试验等)在病毒的初步分离和鉴定中占重要地位,而分子生物学诊断技术(PCR、核酸探针技术与蛋白芯片等)则更加快速、准确和便捷,但所需的试剂较为昂贵,不利于其推广[76]。因此,在以后的研究中,需将两者高效结合,为EA H1N1猪流感病毒的诊断提供更加有力的技术支持。
3.2 欧亚类禽H1N1猪流感病毒的防控
现阶段,接种疫苗是防控猪流感病毒感染最主要的措施。大多数国家广泛使用的流感病毒灭活疫苗(IIV)可有效预防与其同源或基因相似的病毒感染[77],但是对于目前流行的EA H1N1猪流感病毒的防护仍然有限,其研发进度落后于病毒抗原变化速度,且在不同亚型的病毒间不能提供良好的交叉保护[78],主要应用于繁殖母猪。研究表明,NS1和M1蛋白内可能存在多个适合抗病毒药物或疫苗开发的靶点[79-80]。一种通过修饰猪流感病毒NS1蛋白构建的活疫苗(LAIV)已被批准应用于降低猪群中流感的发病率[81],但其易与地方性病毒发生重组[82],并且猪体内流感病毒的多样性也限制了LAIV作用的发挥,需因地制宜[83]。HERNANDEZ等[84]研发的亚单位疫苗,可以有效地抵抗猪流感病毒的感染,并能减少被感染动物肺部组织的损伤,拥有良好的安全性,但其缺点是制造成本高且所需疫苗剂量较大,因此需进行更深入的研究并改进。在免疫接种上,使用异源IIV加强免疫策略有助于保护猪群,减少病毒感染[85]。另外,在单次注射LAIV后,继续提供多价异源IIV加强免疫也是有效的[86]。值得一提的是,由于非洲猪瘟的爆发,中国猪养殖场生物安全防控措施的规范,一定程度上也减缓了猪流感病毒的传播[87]。
3.3 欧亚类禽H1N1猪流感病毒的药物治疗
目前,针对EA H1N1猪流感病毒,临床上主要应用金刚烷类药物和神经氨酸酶抑制剂类药物来控制其发展,前者为M2通道阻滞剂,抑制病毒的复制过程。后者可以黏附在病毒的神经氨酸酶上,阻止聚集在宿主细胞表面的子代病毒的释放。而较为严重的病例,还需采取额外的辅助治疗(抗生素、肠外营养和静脉补液等),控制继发感染[88]。研究表明,部分EA H1N1猪流感病毒的M2蛋白上已发生S31N氨基酸位点的突变,使其对金刚烷胺敏感性降低[23-24,72],但并未出现与神经氨酸酶抑制剂类药物抗性有关的突变(NA蛋白上的H275Y和N295S氨基酸位点的突变),说明在治疗早期使用神经氨酸酶抑制剂类药物可以在一定程度上限制疾病的进程。除以上两种主流药物外,还发现了其他抗病毒制剂,可用于作为治疗流感病毒感染的备选药品,如聚合酶抑制剂(利巴韦林)、透明质酸抑制剂(阿比多尔)和NP抑制剂(姜黄素)等[89]。此外,出现PB2蛋白的T588I或NS1蛋白的A42S氨基酸位点突变的病毒株,可以通过抑制干扰素的抗病毒作用来调控宿主的免疫反应[57,72]。因此,应高度关注并持续监测此类氨基酸位点的变化,开发更加高效的新型药物,在临床治疗中需选择合适的抗病毒药物,合理联合用药,以降低耐药性产生的风险。
4 结语
现阶段,EA H1N1猪流感病毒在猪群中的传播仍然占据着主导地位[5,25,40-44]。提示,与普通人群相比,猪养殖工作者患病的概率更大。SUN等[14]通过对照试验发现,普通人群和猪养殖工作者对G4基因型的EA H1N1猪流感病毒的血清阳性率分别为4.4%和10.4%,对G1基因型的EA H1N1猪流感病毒的血清阳性率分别为2.2%和6.5%。可以推断,如果人类与猪群接触越密切,被感染的概率也就越大。猪作为“流感病毒的混合容器”[1],可以感染不同亚型的流感病毒,加大了重组病毒产生的概率,尤其是2009/H1N1猪流感病毒的出现,为EA H1N1猪流感病毒的重组提供了更多可以选择的基因片段[8]。发生重组的EA H1N1猪流感病毒在传播性和致病性上呈现出不同程度的增强[14,21]或产生耐药性[23],削弱了人们对其的控制能力,为EA H1N1猪流感病毒在人群和猪群中的传播提供了帮助。在其不断突破屏障跨物种传播的过程中[17-18,30,37]部分氨基酸位点也发生了改变。这种变化使EA H1N1猪流感病毒更加适应哺乳动物,如复制效率提高[49]、抗原漂移[53]和金刚烷胺抗性[70]等。与此同时,猪群和人群中还缺乏相应的抗体[5,14,38],且现阶段针对其的防治手段也较为有限,多种因素共同促使EA H1N1猪流感病毒在传播过程中占据了主导,逐渐取代了CS H1N1猪流感病毒,具有造成下一次流感大流行的潜力。
综上,应该继续加深在EA H1N1猪流感病毒传播机制、突变类型和药物及疫苗预防等方面的研究,为下一次流感大流行的预测和防控提供更加有力的支持。

