基于β-catenin介导金郁欢抗抑郁的初步研究
刘宏,黄杨,张雨薇,仲丽丽,代巧妹,杨婧,倪雪妍,李冀
(1.黑龙江中医药大学,黑龙江 哈尔滨 150040;2.黑龙江中医药大学附属第一医院,黑龙江 哈尔滨 150040)
抑郁症是一种常见的精神疾病,也是全世界残疾的主要原因之一[1],其主要临床表现为显著而持久的心境低落、思维迟缓、认知功能损害[2]以及自我毫无价值感和反复出现的自杀念头、食欲和体质量显著变化(增加或减少)等[3]。对于中医而言,抑郁症属于“郁证”的统筹范围。近年来中药因其多成分、多环节、多靶点和毒副作用小的优势成为抗抑郁药物研究中的热点领域[4]。根据中医对抑郁症的病机认识,本实验通过慢性轻度不可预知应激加孤养(CMUS)方法建立大鼠抑郁模型,采用中药复方金郁欢为干预方药,选用在临床上应用多年并取得满意治疗效果的乌腺金丝桃和郁金、合欢花水提取物[5]进行配伍应用,以β-catenin信号通路为切入点,观察金郁欢对小鼠海马组织损伤修复和β-catenin蛋白的影响,从而初步探索金郁欢治疗抑郁症的作用及其机制。
1 材料
1.1 动物
清洁级ICR小鼠60只,购自黑龙江中医药大学实验动物中心,动物生产许可证:SCXK(黑)2018-003。小鼠体质量(20±2)g,鼠龄8~10周,雌雄不限,正常昼夜节律条件,温度18~25 ℃,湿度55%~65%,自由进食和饮水。
1.2 药物与试剂
金郁欢汤剂,药物组成为乌腺金丝桃30 g,郁金15 g,合欢花15 g,(购自北京同仁堂药店,鉴定为正品)。另取单味药乌腺金丝桃60 g,单味药郁金30 g,单味药合欢花30 g,乌腺金丝桃与郁金、合欢花配伍比例为2∶1∶1。提取时,用水浸泡药材2 h,10倍量的水进行提取后浓缩至所需体积。
盐酸氟西汀(百忧解)(礼来制药公司,美国)。在0.5%羧甲基纤维素钠水溶液中溶解成混合悬浮液。
Rabbit Anti-β-catenin(北京博奥森,货号bs-23663R,lot:BA01048540);蛋白酶抑制剂(Roche, Indianapolis, IN, USA);Super-GL ECL 超敏发光液(艾博思生物);Lowry蛋白测定试剂盒(Meiji Biotech,中国上海有限公司);RT试剂盒(Novland公司);Trizol试剂(Invitrogen公司);TAE缓冲液、琼脂糖等。
1.3 主要仪器
旷场实验装置:一个底部方形(60 cm×60 cm×20 cm)的开箱,自制;NIKON显微镜(ECLIPSE-50I,日本);轮转式切片机(R138,湖北泰维科技实业有限公司);JD-801形态学图像分析系统(捷达公司,南京);Power PacTMHC电泳仪(bio-rad);VE-180垂直电泳槽(天能);DY-B1脱色摇床(上海青浦沪西仪器)等。
2 方法
2.1 动物分组及模型的建立
将60只ICR小鼠随机分为5组:control组(Control)、model组(Model)、金郁欢(低、高)剂量组(JYH-L、JYH-H)、fluoxetine组(Fluoxetine),每组12只。采用CMUS法,每天使用不一样的刺激方法建立小鼠抑郁模型,采取了7种刺激方法,每天随机选择1种刺激,且刺激的方法不同,保持一段时间不间断。具体刺激方法如下:(1)潮湿鼠笼,24 h;(2)固定小鼠,时间2 h;(3)在冰水(4 ℃)中游泳,时间3 min;(4)电击小鼠足部,10 s;(5)在热水中游泳,时间3 min;(6)夹尾,时间2 min;(7)禁水,时间24 h;(8)歪斜小鼠笼,时间24 h;(9)绝食,时间24 h。
2.2 给药途径及剂量
JYH-L、JYH-H组分别给予金郁欢提取物0.2 g/kg、0.8 g/kg;fluoxetine组以0.02 g/(kg·d)剂量给予氟西汀悬浮液灌胃。control组和model组小鼠灌胃等体积生理盐水。以上各组小鼠每日给药1次,连续给药3周后进行行为学实验。
2.3 样本制备
行为学测试后,每组6只大鼠深度麻醉后灌入400 mL生理盐水、1 mol/L磷酸盐缓冲盐水(PBS),然后用500 mL 4%多聚甲醛溶液固定,pH 7.4。脑组织在视神经交叉后4 mm处,即海马平面做冠状切片(1.5 cm×1 cm×5 cm)。组织块4 ℃低温固定48 h。脑组织用石蜡包埋并切片至所需的厚度(5 mm)。
2.4 旷场实验(OFT)
将一个方形底部(60 cm×60 cm×20 cm)的开箱,分成36个大小相等的网格。用酒精去除实验空间的气味后,将小鼠放置在每个象限的中心。记录各组小鼠5 min内在箱中水平移动得分(后腿跨越方格数)和直立得分(前肢站立次数)以测量探索行为。
2.5 Nissl染色观察海马神经元形态
将切片浸入1%甲苯胺蓝溶液中染色,50 ℃ 20 min,用蒸馏水快速冲洗并分化。用苏木精复染色,脱水后,清洗并安装载玻片。
每只小鼠脑组织1张切片,每张切片选取10个不重叠连续高倍(×400)视野观察,JD-801形态学图像分析系统分析各组小鼠海马CA3区尼氏小体总面积(S总)。
2.6 免疫组织化学法及Western blot法检测β-catenin蛋白水平
将组织块进行梯度酒精逐级脱水(70%→80%→95%→100%),从低浓度向高浓度脱水(各1~2 h),二甲苯透明20~30 min,DAB显色,苏木素复染。
将海马组织加RIPA裂解缓冲液和蛋白酶抑制剂,离心收取总蛋白,电泳,加入增强化学发光(ECL)液计算蛋白含量。
2.7 RT-PCR法检测β-catenin基因表达水平
采用Trizol-A+试剂提取各组小鼠缺血侧脑皮质半暗带区总RNA,用小鼠莫洛尼白血病病毒逆转录酶从RNA中合成cDNA,紫外线下电泳。
2.8 统计学分析
本研究的数据以平均数±标准差表示。使用统计软件SPSS19.0软件(SPSS Inc.,Chicago,IL,USA)进行数据处理。组间比较采用方差分析。在方差齐性的情况下采用Bonferroni’s方法进行两两比较,在方差不齐的情况下采用Welch’s方法进行比较。P<0.05为差异有统计学意义。
3 结果
3.1 旷场实验
与control组比较,model组水平移动得分无明显差别(P>0.05);与model组比较,JYH-L组、JYH-H组、fluoxetine组水平移动得分无明显差别(P>0.05)。与control组比较,model组直立得分降低(P<0.01);与model组比较,JYH-L组直立得分无显著差别(P>0.05),JYH-H组、fluoxetine组直立得分显著增加(P<0.01),见表1。
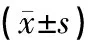
表1 各组小鼠探索行为得分比较
3.2 金郁欢对CMUS小鼠海马CA3区神经元细胞尼氏小体S总的影响
定量分析显示,与control组比较,model组S总显著降低(P<0.01);与model组比较,JYH-L组、JYH-H组上述指标增高(P<0.05,P<0.01),fluoxetine组上述指标亦表现为增高(P<0.01),见表2。
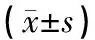
表2 各组小鼠海马CA3区尼氏小体总面积比较
3.3 免疫组织化学法检测β-catenin蛋白表达结果
光镜下观察到,β-catenin阳性细胞主要分布于皮质及海马区。DAB染色显示,棕黄色颗粒出现在β-catenin阳性细胞的细胞浆,control组切片着色非常浅或不着色,见图1。测定各组小鼠海马阳性细胞β-catenin的IOD,IOD值大小代表蛋白阳性表达量的多少。测定结果显示,与control组比较,model组 β-catenin 表达下降(P<0.01);与model组比较,JYH-L组β-catenin表达升高(P<0.05),JYH-H组β-catenin 表达显著升高(P<0.01),fluoxetine组β-catenin表达显著升高(P<0.01),见表3、图1。
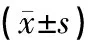
表3 各组小鼠海马β-catenin表达情况
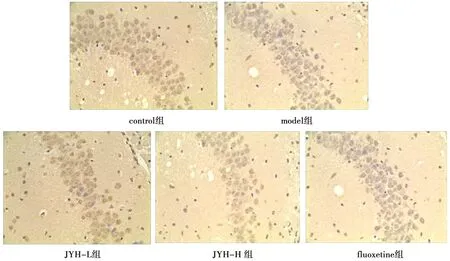
图1 各组小鼠海马β-catenin表达(DAB染色,10×20)
3.4 Western blot法检测β-catenin蛋白表达结果
结果分析显示,与control组比较,model组小鼠海马β-catenin蛋白含量明显降低(P<0.01),与model组比较,JYH-L组、JYH-H组海马β-catenin含量明显升高(P<0.05,P<0.01),fluoxetine组海马β-catenin含量明显升高(P<0.01),见表4。
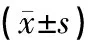
表4 各组小鼠海马β-catenin蛋白表达比较
3.5 RT-PCR法检测β-catenin mRNA表达结果
结果显示,与control组比较,model组小鼠海马β-catenin mRNA表达降低(P<0.01);与model组比较,JYH-L组、JYH-H组小鼠β-catenin mRNA表达均明显升高(P<0.01),fluoxetine组提示小鼠β-catenin mRNA表达亦明显升高(P<0.01),见表5。
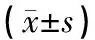
表5 各组小鼠海马β-catenin mRNA表达比较
4 讨论
抑郁症是一种复杂而又发作频繁的疾病,相关研究表明与抑郁症相关的健康状况比其他慢性疾病有明显的衰退[6]。随着时代的发展,研究者越来越关注抑郁症发展机制。然而其发病机制相当复杂,涉及到遗传、应激、单胺类物质缺乏、下丘脑-垂体-肾上腺轴(Hypothalamic-pituitary-adrenal,HPA)失调、免疫、内分泌和神经发生等多种因素[7-8],但其中最经典的莫过于Wnt/β-catenin学说[9]。进化保存的Wnt/β-catenin通路启动信号级联,在正常胚胎发育期间和每个组织器官系统有机体的整个生命中都至关重要。在中枢神经系统内,Wnt信号级联协调神经元功能的所有方面,包括分化,突触形成和可塑性、神经生成和再生[10-11]。相关研究[12]表明抑郁行为与海马组织Wnt信号通路功能紊乱有关,在wnt通路中一个很重要的因子就是β-catenin,它负责将核外应激信号传递到核内,由此可见β-catenin的表达让整个Wnt信号通路的生物学效应受到了影响。许多研究表明,β-catenin信号与抑郁症的病理生理学和治疗有牵连[13-14]。YANG等[15]学者研究发现,通过RES治疗提高了神经营养因子的海马蛋白水平以及p-β-catenin/β-catenin的相对比率,通过降低HPA轴多动性、增加BDNF表达和等离子IL-6、CRP和TNF-α浓度以及调节海马Wnt/β-catenin通路,改善了CUMS大鼠的抑郁行为。QIN等[16]学者通过EA治疗降低了β-catenin的mRNA和蛋白表达水平。随着β-catenin表达水平逐渐降低,显示Wnt信号通路正逐渐从激活状态向抑制过程移动。β-catenin的表达显示出抗抑郁作用,表明EA可以通过Wnt/β-catenin信号通路刺激神经生成,保护海马神经元免受抑郁大鼠的伤害,并在一定程度上产生抗抑郁作用。
近年来,中医药在抗抑郁方面发挥了重要作用,单独应用中药或中西药联合应用显示出快速抗抑郁作用[17-18]。中医将抑郁症归于“郁病”的范畴。目前主流观点认为抑郁症的病机是肝气郁滞、脾气郁结。正由于身体内部的气机不畅,使得疾病进一步发展从而由气及血,最后导致脏腑功能失调,气血阴阳紊乱[19],加重了病情,所以治疗上应疏肝健脾。通过筛选发现,中药合欢花具有解郁安神之功效。施学丽等[20]学者发现合欢花可以增加大鼠海马区神经元细胞数量,这使得大鼠海马神经元得到了有效的修复,改善了大鼠的抑郁行为。郁金有行气解郁,清心凉血之功效,有研究指出郁金中的有效成分谷甾醇在抑郁症发作过程中可以通过调节多巴胺、五羟色胺受体等,对抑郁症产生的焦虑行为起到一定的缓解作用[21]。乌腺金丝桃经李冀等[22]学者实验研究发现其具有抗抑郁、镇痛、抗菌、抗炎等作用。本研究将通过此3者搭配而成的金郁欢汤剂,研究其对小鼠抑郁行为的调节是否有作用。本实验通过不可预见慢性刺激的方法复制抑郁动物模型,观察金郁欢对模型动物行为学、海马组织内神经元细胞形态和海马CA3区尼氏小体总面积(S总)以及分子β-catenin蛋白的影响。
本研究发现,在旷场实验中,与模型组对比,金郁欢高、低剂量组小鼠的水平得分不是特别明显,这可能与实验误差有关,在日后实验中需特别注意此类问题,实验前应去除房间有可能刺激小鼠的气味。与对照组相比,模型组小鼠直立得分降低,与模型组比较,金郁欢组直立得分升高,说明药物治疗在一定程度上改善了抑郁造成的快感缺失[23],增强了小鼠活动的积极性。
有相关研究表明药物的定期日常治疗可以有效地改善接受CUMS程序的小鼠的行为改变[24]。慢性应激还会引起神经细胞形态改变,降低细胞内脑源性神经营养因子水平,从而导致抑郁症发生[25]。Nissl染色也显示,与模型组比较,JYH-H组与fluoxetine组海马组织中神经元细胞面积范围更大,尼氏小体总面积有所增高。尼氏小体面积的增大可以看出金郁欢对海马神经元的保护起到了一定的作用,修复了部分受损神经元。这与有关研究的结果具有一致性[26]。因此可以假设,外界的应激影响了Wnt/β-catenin信号通路,这使得神经系统的活性受到了影响,然后改变了海马区的神经功能,从而导致小鼠产生不同程度的抑郁和焦虑样行为。但JYH-L组的尼氏小体变化不大,提示我们需要注意金郁欢复方剂量的问题,低剂量的金郁欢对小鼠脑组织结构的影响不是特别明显,免疫组织化学检测和Western Blot法中也显示,与模型组对比,JYH-H组与fluoxetine组β-catenin表达显著升高(P<0.01)。利用RT-PCR法检测β-catenin mRNA表达的结果也同样显示出,与model组比较,其余3组用药组β-cateninmRNA表达均明显升高。LI等[27]人的研究中发现,在Wnt信号出现后,β-catenin表达水平显著升高,这与本实验结果也是符合的。本研究表明金郁欢抗抑郁的作用可能与β-catenin上调有关,影响了β-catenin蛋白表达水平,从而影响抑郁症的发生发展,这也为临床用药提供了一个新的思路。
总之,金郁欢复方的应用可以提高抑郁性失眠动物自主活动和主动探索陌生环境的能力,使得抑郁小鼠脑内海马组织形态及功能得到了明显改善,保护了海马神经元细胞,提高脑内β-catenin蛋白的表达水平,从而发挥改善抑郁行为功效的能力。这为临床治疗抑郁症提供了有效的实验数据。但典型的Wnt/β-catenin信号通路在神经系统疾病中的变化存在复杂性,Wnt信号的失活(下调)导致β-连环蛋白降解并促进神经发生多种疾病[28-29],抑郁症发病机制是复杂多变的,样本数据量的多少以及气候环境等因素的不可控性,金郁欢的药材产地以及药量多少和配伍比例也需要进一步明确,其抗抑郁的作用机制仍待进一步研究。

