血管活性肽对血管紧张素Ⅱ诱导高血压大鼠血管胶原重构的作用机制
陈光远,王秀艳,刘星群,温霞
(1.内蒙古自治区人民医院 体检科,内蒙古 呼和浩特 010017;2.内蒙古自治区人民医院 急诊科,内蒙古 呼和浩特 010017)
高血压是最常见的心血管疾病,它能提高中风、心脏病等心脑血管疾病的风险[1]。血管紧张素Ⅱ(angiotensinⅡ, AngⅡ)是调节人体心血管系统的一种重要活性物质,能够作用于血管平滑肌使血管收缩,从而使得血压升高[2]。研究表明AngⅡ在多种心血管疾病发生过程中,发挥重要作用,能够促进心肌细胞及血管平滑肌细胞中胶原的合成[3],而血管胶原合成是多种心血管疾病发生的重要病理生理过程[4]。血管活性肽(intermedin,IMD)属于降钙素基因相关肽(calcitonin gene related peptide,CGRP)超家族成员,它能通过降钙素受体样受体或者受体活性修饰蛋白发挥作用[5],是重要的内源性心脏-肾脏保护因子,具有降低血压、扩张冠脉、调节水和电解质平衡、调节垂体激素分泌等作用[6-7]。既往研究显示IMD能够通过改善血管平滑肌细胞舒张功能,代偿性拮抗内膜增殖,进而影响损伤血管狭窄的形成[8],但是有关IMD对AngⅡ诱导的高血压血管胶原重构的机制尚不完全清楚。因此,本研究拟通过研究血管中胶原合成和重构的过程来评价IMD在AngⅡ诱导高血压中血管胶原重构中的作用机制。
1 材料与方法
1.1 实验材料
1.1.1动物来源 12周龄雄性Sprague Dawley(SD)大鼠(购自北京大学医学院实验动物中心)36只,体质量(403.4±5.3)g,普食喂养、自由摄食、进水,温度25 ℃,湿度(60±10)%。
1.1.2主要试剂与仪器 苏木精-伊红(hematoxylin-eosin staining,HE)试剂盒、β-actin小鼠单克隆抗体、一抗稀释液、二抗稀释液及电化学发光液(electrochemiluminescence,ECL;上海碧云天生物技术),AngⅡ和IMD(美国Sigma),酶联免疫吸附剂测定(enzyme linked immunosorbent assay,ELISA)试剂盒(北京中杉金桥),RNA逆转录试剂盒(上海生工生物工程),TRIzol RNA提取试剂(中国赛默飞世尔科技),磷酸化丝氨酸/苏氨酸激酶(phosphorylated-Akt,p-Akt)兔单克隆抗体和丝裂原活化蛋白激酶(phosphorylated-MAPK,p-MAPK)兔单克隆抗体(美国Cell Signaling Technology);G22-W型高速离心机(湖南湘仪实验室),SuPerMax 3000FA型多功能酶标仪(中国赛默飞世尔科技),M371450型组织涡旋仪(武汉维塞尔生物),TC-XDS-500C型荧光倒置显微镜(日本奥林巴斯),Western blotting检测装置和GoodLook-1000型成像系统(美国Bio-Rad),Applied Biosystems ABI 7500聚合酶链式反应(polymerase chain reaction,PCR)仪(中国Thermo Fisher Scientific)。
1.2 实验方法
1.2.1动物分组 36只大鼠随机均分为AngⅡ组、AngⅡ+IMD组及对照组,AngⅡ组大鼠于下肢远端缝匠肌肌内局部注射10-7mol/L AngⅡ(生理盐水配制)0.2 mL,AngⅡ+IMD组大鼠采用同样的方法注射10-7mol/L AngⅡ(生理盐水配制)0.2 mL和IMD 150 μg/kg(生理盐水配制),对照组仅注射相同体积的生理盐水[7, 9],1次/d。所有大鼠干预时间为2周。
1.2.2尾动脉容积法测量大鼠尾动脉血压 各组大鼠处理2周后测量其尾动脉血压,将其置于大鼠血压心率测量仪的37 ℃保温箱中使大鼠体温上升,鼠尾套入气囊套,待动物安静后充气,测定收缩压,重复3次,取平均值。
1.2.3ELISA法检测血清Ⅰ、Ⅲ型胶原蛋白 60 mg/kg水和氯醛腹腔注射麻醉大鼠,经内眦静脉抽血,3 000 r/min离心5 min,分离血清,取96孔酶标板,每孔加血清100 μL,加pH 7.4的PBS 100 μL,4 ℃反应过夜;PBS冲洗后用2%H2O2-乙醇溶液封闭内源过氧化物酶活性,加1%BSA溶液封闭非特异性抗体结合位点,PBS洗涤后加1∶1 000稀释的分别加入Ⅰ、Ⅲ型前胶原的特异性抗体,37 ℃反应2 h,洗去多余抗体;加1∶200稀释的生物素标记的山羊抗大鼠二抗,37 ℃反应1.5 h,洗去多余二抗;加OPD显色液在室温下显色反应6 min,加 0.2 mmol/L H2SO4终止反应;利用酶标仪检测血清Ⅰ、Ⅲ型胶原蛋白的含量。
1.2.4HE染色 60 mg/kg水合氯醛腹腔注射麻醉大鼠,打开胸腔,取胸主动脉中段长度为0.5 cm的血管,40 g/L多聚甲醛固定、石蜡包埋,其余的血管组织样本用液氮低温保存。石蜡包埋的组织连续切片4张、厚度5 μm,60 ℃烘烤30 min,二甲苯中脱蜡15 min;梯度酒精浸泡除去二甲苯,蒸馏水浸泡冲洗2次,吸取水分;晾干后苏木精染色15 min,蒸馏水冲洗2遍;1%盐酸酒精分化30 s,蒸馏水浸泡15 min,吸干水分后于1%伊红染色液中染色3 min;70%酒精冲洗后利用梯酒精浸泡脱水,二甲苯酒精(1∶1)中浸泡5 min,二甲苯中浸泡5 min,换二甲苯中浸泡15 min,取切片,滴加树胶封片,染色切片;通过ImageJ软件自动图像分析系统分析不同区域组织像素差异,测定胸动脉壁厚/腔径比值(wall thickness/lumen diameter of thoracic artery,W/C)和胶原面积百分比(percentage of collagen area,VFC)[10]。
1.2.5p-Akt及p-MAPK蛋白表达 取1.2.4项下液氮冻存的各组大鼠胸主动脉血管组织200 mg,于液氮中研磨为粉末,加预冷的细胞裂解液裂解,4 ℃反应过夜,12 000 r/min离心10 min,取上清进行SDS-PAGE电泳分析;抽提总蛋白,利用SDS-PAGE电泳法分离不同蛋白,通过电转法将总蛋白从凝胶中转移至PVDF膜上;5%脱脂奶粉37 ℃封闭1 h,TBST洗涤加一抗工作液(一抗分别为p-Akt、p-MAPK特异性鼠源抗体),4 ℃孵育过夜;TBST洗去多余一抗,加辣根过氧化酶标记山羊抗大鼠IgG二抗(1∶1 000),室温孵育1h;TBST洗膜后加新鲜配制的DAB显色液避光显色10 min,蒸馏水洗停止显色;将Western-Blot结果图像输入计算机,利用凝胶成像分析系统检测条带的积分灰度值[11]。
1.2.6p-AktmRNA和p-MAPKmRNA表达 根据Akt和MAPK的序列(GeneBank登录号分别为NM_001165894 及X58712)设计用于RT-PCR的引物,引物序列见表1。取液氮冻存血管组织,通过TRIzol RNA提取试剂盒提取组织中的总RNA,进行RT-PCR检测,利用RT-PCR一步法试剂盒在Real-Time PCR仪(Bio-Rad)进行RT-PCR反应,RT-PCR反应条件为95 ℃、3 min,60 ℃、15 s,72 ℃、30 s,40个循环;使用仪器配套分析软件V2.02进行分析以β-actin作为内参照,结果用以2-ΔΔCt来表示[12]。
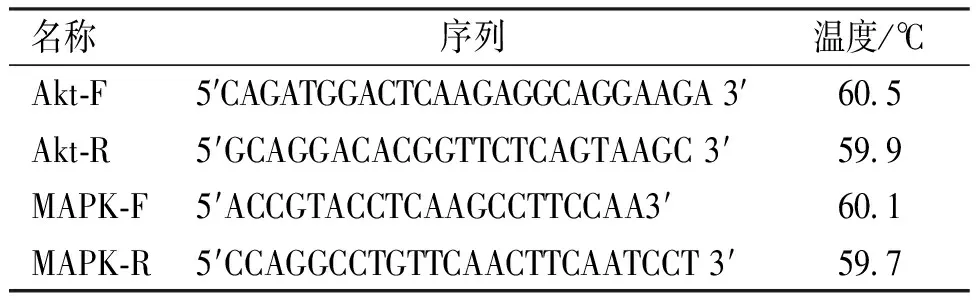
表1 RT-PCR引物
1.3 统计学分析
2 结果
2.1 尾动脉血压
与对照组相比,AngⅡ组大鼠尾动脉血压明显升高,差异有统计学意义(P<0.01);与AngⅡ组相比,AngⅡ+IMD组大鼠尾动脉血压降低,差异有统计学意义(P<0.05,图1)。
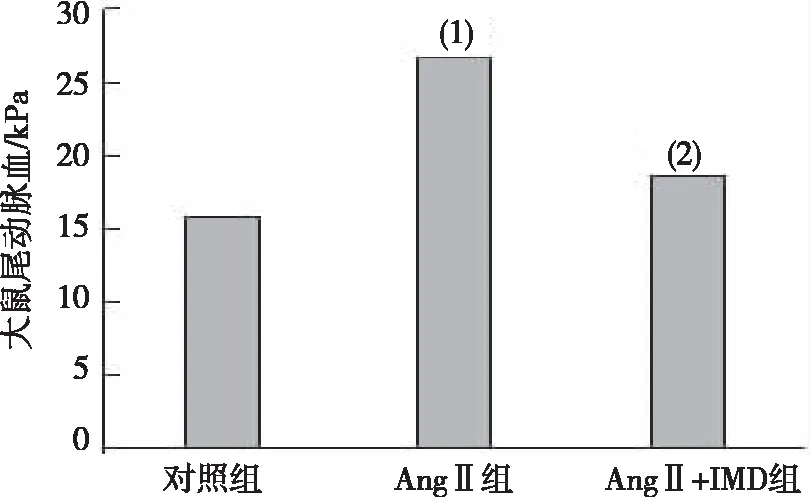
注:(1)与对照组比较,P<0.01;(2)与AngⅡ组比较,P<0.05。
2.2 血清中Ⅰ、Ⅲ型胶原含量和主动脉W/C及VFC
ELISA检测如表2所示,与对照组相比,AngⅡ组大鼠血清中Ⅰ、Ⅲ型胶原含量及主动脉W/C与VFC升高(P<0.05或P<0.01),AngⅡ+IMD组大鼠血清中Ⅰ型胶原含量与主动脉W/C提高(P<0.05或P<0.01);与AngⅡ组相比,AngⅡ+IMD组大鼠血清中Ⅰ、Ⅲ型胶原含量及主动脉W/C与VFC升高,差异有统计学意义(P<0.05或P<0.01)。HE染色结果如图2所示,AngⅡ组大鼠的动脉血管内径较对照组变小、且胶原重构现象较对照组明显(P<0.05),AngⅡ+IMD组大鼠血管胶原重构现象较AngⅡ组减轻(P<0.05)。
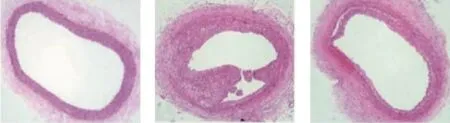
对照组 AngⅡ组 AngⅡ+IMD组
表2 各组大鼠血清中Ⅰ、Ⅲ型胶原含量和主动脉W/C及VFC
2.3 p-Akt和p-MAPK蛋白的表达
Western blot结果显示,与对照组相比,AngⅡ组大鼠血管中p-Akt及p-MAPK蛋白的表达明显升高,差异均有统计学意义(P<0.01);与AngⅡ组相比,AngⅡ+IMD组大鼠血管中p-Akt及p-MAPK蛋白的表达降低,差异均有统计学意义(P<0.05,图3)。
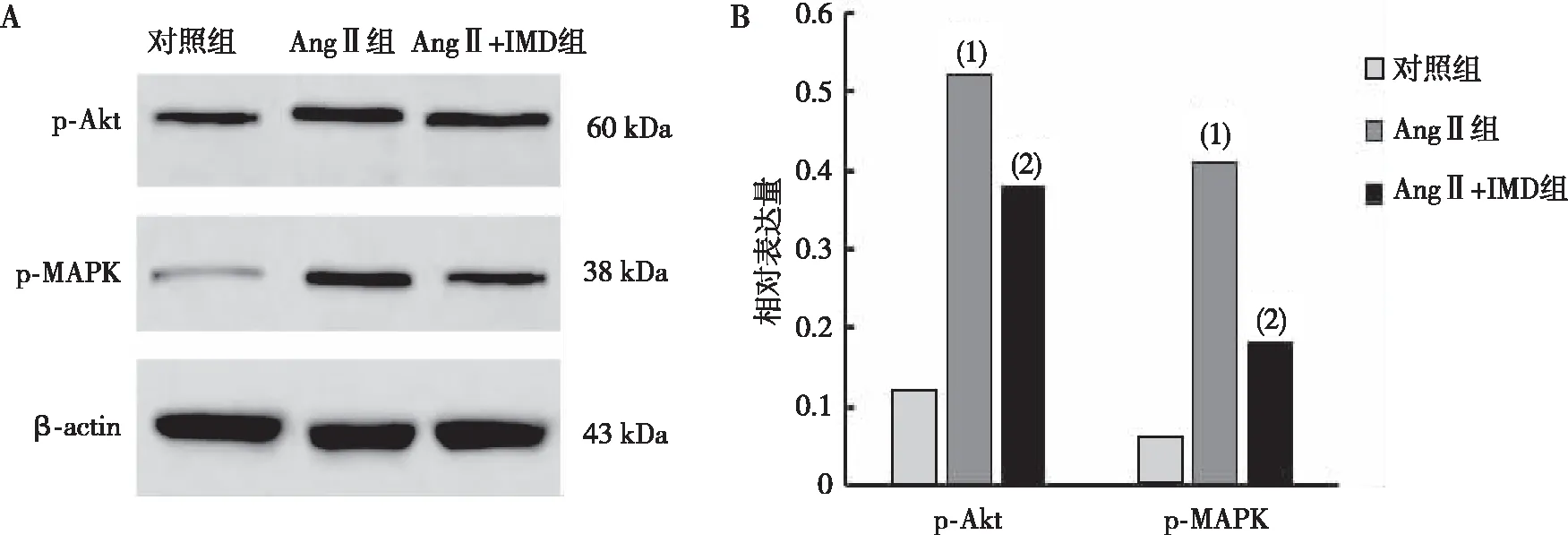
注:A为 Western blot检测结果,B为 p-Akt及p-MAPK蛋白的定量表达;与对照组比较,(1)P<0.01,(2)P<0.05。
2.4 p-Akt和p-MAPK mRNA的表达
RT-PCR结果显示,与对照组相比,AngⅡ组大鼠的血管细胞中p-AktmRNA表达显著升高(P<0.05),而p-MAPKmRNA表达水平无差异(P>0.05);AngⅡ+IMD组大鼠的血管细胞中p-Aktt及p-MAPKmRNA的表达水平与对照组比较,差异无统计学意义(P>0.05,图4)。
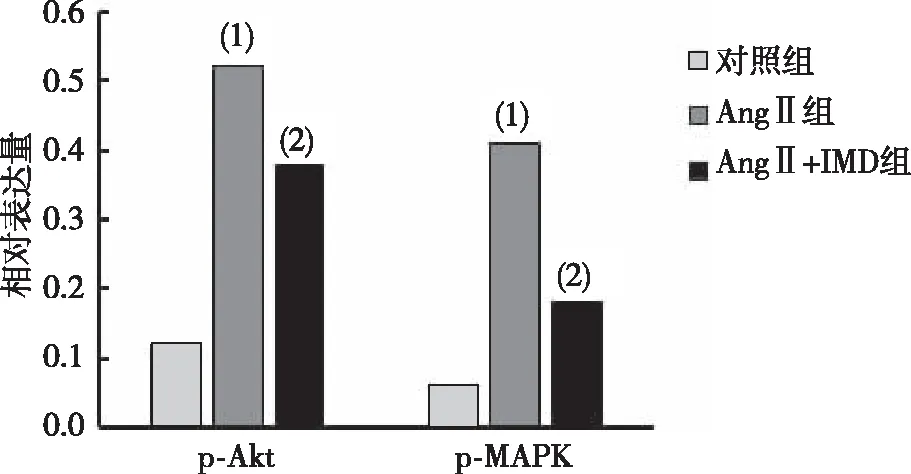
注:(1)与对照组比较,P<0.05;(2)与AngⅡ组比较,P<0.05。
3 讨论
为了研究IMD在AngⅡ诱导大鼠高血压中的影响及在血管胶原重构中的作用机制,本研究首先利用体外注射的方法分别研究AngⅡ单独作用及其与IMD共同作用对大鼠血压的影响,IMD可以有效拮抗AngⅡ升血压的作用,大鼠尾动脉血压维持在较低水平。该结果可能是由于IMD是一种血管活性多肽,同时IMD属于降钙素基因相关肽(calcitonin gene related peptide,CGRP)超家族成员能够通过降钙素受体样受体或者受体活性修饰蛋白发挥作用,降低血压[13];既往研究证实IMD在降低血压方面主要是通过结合受体活性修饰蛋白(receptor activity modifying protein,RAMPs)/降钙素受体样受体(calcitonin receptor like receptor,CRLR)受体复合物,并且调节cAMP水平和其他心血管活性因子实现的[14]。
由高血压引发的其他多种心血管疾病包括动脉粥样硬化等过程中,血管胶原的重构是一个重要的病理生理过程[15]。为了研究IMD在AngⅡ诱导大鼠高血压中血管胶原重构中的作用机制,本研究通过ELISA、免疫组织化学等方法观察大鼠血管微结构的变化,计算W/C和VFC,结果表明IMD能够抑制AngⅡ诱导大鼠高血压中血管胶原重构的过程;随后为了解IMD抑制AngⅡ诱导高血压中血管胶原重构过程中可能的作用机制,本研究先后利用Western blot和RT-PCR的方法分别检测Akt、MAPK mRNA和蛋白的表达水平,结果表明IMD可通过拮抗AngⅡ的作用调节Akt及MAPK的磷酸化水平,从而抑制血管胶原的重构。
AngⅡ诱导血管胶原重构的作用主要通过结合血管内皮细胞表面AngⅡ的血管紧张素Ⅱ-1型受体(angiotensin Ⅱ type 1 receptor,AT1R),随后激活下游的信号通路,最终引起胶原增生[16]。众多研究表明,AngⅡ能够作用于细胞表面的AT1R,已往研究使用Gi蛋白拮抗剂,证明AT1R能够与Gi蛋白偶联,当二者结合时Gi蛋白水解三磷酸鸟嘌呤核糖核苷,并且使G蛋白β受体酪氨酸激酶解离并活化酪氨酸激酶,从而激活表皮生长因子受体(epidermal growth factor receptor,EGFR),并在随后可以激活Ras/raf/MAPK/ERK信号通路以及磷脂酰肌醇3-激酶/Akt信号通路[17]。研究表明AngⅡ结合AT1R激活EGFR通路的过程中需要Ca2+/钙调素的作用,Ca2+/钙调素能够激活肌醇磷脂磷脂酶C,该酶能够水解细胞膜结合的4,5二磷酸磷脂酰肌醇为三磷酸肌醇[18]。而IMD作为一种降钙素相关肽家族的一员能够结合Ca2+/钙调素,并且降低其活性最终通过一系列信号通路的传导降低EGFR信号通路的激活状态,使其下游多个信号通路关键蛋白的活性受到限制[19],其中包括MAPK及Akt等调节细胞生长分裂的关键蛋白。
IMD是内环境中重要的活性多肽,目前大量研究已经证实IMD在调节血压及心肌、血管及肾脏等免受慢性氧化应激及急性氧化应激等过程中发挥重要作用,同时它对于抑制细胞凋亡,减轻不良组织的重构,保护心血管及肾脏功能方面也重要的作用[20]。因此,进一步研究IMD的生理功能及其机制对于心血管等方面疾病的研究和治疗有着重要的理论和实践意义。

