危重患者早期肠内营养喂养不耐受风险预测模型的构建
苏小平,徐静娟,赵亚东,张允,陈建芬
(常州市第一人民医院a.急诊ICU;b.门诊办公室;c.综合ICU,江苏 常州 213000)
早期肠内营养(Early enteral nutrition, EEN)因其有助于患者肠黏膜功能恢复, 促进肠道蠕动等优点,成为了临床中营养支持的首选方式[1]。 尽管如此, 仍有患者会在肠内营养期间发生不同程度的并发症,喂养不耐受就是其中较为常见的并发症之一。2012 年欧洲危重病学会指出,任何临床原因引起的在肠内营养过程中发生呕吐、腹泻、便秘、胃残余量过多或在尝试喂养的72 h 内无法通过肠途径达到至少20 kcal/kg·d 的, 均称为喂养不耐受(Feeding intolerance, FI)[2],国内文献报道其发生率为30.5%~65.7%[3-4]。 严重的喂养不耐受可导致营养供应中断,甚至增加患者死亡风险[2]。 目前对于喂养不耐受的评估主要通过胃肠道症状的观察进行判断。 Wang[5]的研究中指出, 喂养不耐受的胃肠道症状主要包括恶心、呕吐、腹胀、腹泻等,但是这些症状发生时,已表明有喂养不耐受的发生,故预测效果并不理想。目前已有针对脑卒中、 急性胰腺炎患者喂养不耐受风险的预测模型, 然而这些模型并不适用于普通的危重患者。 因此本研究拟分析喂养不耐受相关的影响因素, 建立危重患者早期肠内营养喂养不耐受发生风险的预测模型, 以便于医护人员早期识别喂养不耐受高风险患者,为肠内营养不耐受的预防、观察和处理提供一定的参考和依据。
1 对象与方法
1.1 研究对象 采用便利抽样法,选取2021 年4—10 月在我院重症监护室符合研究标准的患者作为研究对象。 纳入标准:(1)年龄≥18 周岁;(2)入ICU时急性生理与慢性健康状况评分 (Acute Physiology and Chronic Health Evaluation-Ⅱ,APACHE Ⅱ)评分≥15 分;(3)入ICU 后48 h 内启动肠内营养;(4)营养筛查评分2002 (Nutrition Risk Screening 2002,NRS2002)评分≥3 分;(5)患者或家属知情并同意参与本研究,同时签署知情同意书(患者意识清楚者亲自签署,昏迷等意识障碍者由决策家属签署)。 排除标准:(1)入ICU 前禁食时长≥48 h;(2)肠内营养前应用促胃动力药或服用益生菌;(3) 入ICU 前已进行肠内营养;(4)血流动力学不稳定;(5)胃肠道手术及肠道感染。 脱落标准:(1) 研究期间患者死亡;(2)研究期间患者或家属要求退出者。
根据多因素Logistic 回归样本量估算法[6],n=自变量×(5-10)/患病率进行计算, 考虑喂养不耐受最低发生率为30.5%以及10%样本脱落率, 故最少样本量为12×5/30.5%/(1-10%)=219 例,本研究实际纳入230 例。 本研究已通过常州市第一人民医院医学伦理委员会批准[(2021)教第004 号]。
1.2 研究工具
1.2.1 临床资料调查表 经文献查阅[7-9]和咨询本医院重症、 营养科专家后设计适用于本研究的资料调查表,共包含3 部分内容。 (1)一般资料:包括性别、年龄、疾病类型、体质量指数。 一般资料的收集于患者入ICU 后24 h 内完成。 (2) 疾病相关资料:APACHEⅡ评分、NRS2002 评分、喂养途径、空腹血糖(每日晨7 时测量血糖取7 d 平均值)、白蛋白水平(入ICU 首次测量值)、有无2 种或2 种以上抗菌药应用、有无血管活性药物(使用时长≥24 h)、镇静镇痛药物(使用时长≥24 h)以及机械通气应用(使用时长≥48 h)。 (3)喂养不耐受判断标准:患者喂养不耐受观察总时长为自肠内营养启动开始连续评估7 d。 文献表明,从启动肠内营养至喂养不耐受发生的平均时间为3 d[10],为防误差本研究将观察时间延长为7 d。 判断标准主要依据喂养不耐受表现进行评估,出现以下任何1 种情况,即认为发生了喂养不耐受[11-12]。 ①腹泻:患者每日排便次数≥3 次且排便量>200 g/d,同时伴有粪便性状改变,如稀便、水样便、粘液便等[13];②胃残余过量:指胃内容物积聚而未及时排空的现象。 本研究中每6 h 使用30 mL 注射器从喂养管进行抽吸,若胃内容物>200 mL/6 h[14]即认为有胃残余过量;③腹胀:由于危重患者大多意识障碍或有人工气道,无法反馈腹胀这一表现,故本研究采用间接测量法[15]利用膀胱压进行腹内压测量,用以反映患者腹胀情况,2 次腹内压测量值>12 mmHg(1 mmHg=0.133 kPa),即认为腹胀;④便秘:≥3 d 未排便即为便秘;⑤呕吐和(或)反流:指胃内容物经过食管逆流经口腔排出体外,本研究中患者在肠内营养过程中口中或气管插管、气管切开处出现营养液或胃管开放后有胃内容物溢出即认为有呕吐或返流;⑥肠鸣音减弱或消失:将听诊器置于患者脐周听诊1 分钟,若肠鸣音次数<3 次(不包括3 次),则为肠鸣音减弱或消失,每6 h 时评估1次;⑦胃肠道出血:在患者呕吐物、反流液或大便中肉眼可见血性液体,且潜血试验阳性和(或)经胃镜检查等医生确诊后,确定为胃肠道出血。
1.2.2 资料收集及质量控制方法 研究组由1 名重症监护室主任医师,1 名营养师、1 名护理研究生以及4 名护士组成。其中研究生和3 名护士经过培训、考核合格后负责临床资料的收集。 培训内容主要包括喂养不耐受的判断标准以及腹内压测量方法。 收集者分别于每日7 时、13 时、19 时、1 时采用纸质记录形式进行为期7d 的患者喂养不耐受的资料收集,每收集完1 名患者资料即在Excel 2016 进行双人核对数据录入。研究中对于发生喂养不耐受的患者,护士均在第一时间采取护理措施并通知医生, 遵医嘱调整营养方案。 由于腹内压测量为侵入性操作,存在感染风险,除严格无菌操作外,每周有2 次尿标本检测并更换集尿袋以防止导尿管相关性感染的发生。
1.2.3 统计方法 双人核对采用Excel 2016 录入数据,采用IBM SPSS 25.0 分析数据。 计量资料若符合正态分布,以均数±标准差进行描述,组间比较采用独立样本t 检验;若非正态分布,以中位数(四分位数)描述,组间比较采用Mann-Whitney U 检验;计数资料采用频数和构成比描述, 组间比较采用χ2检验。 喂养不耐受的影响因素采用二分类Logistic回归分析,根据各因素的系数、OR 值和95%置信区间得出风险模型的数学计算公式,建立预测模型。采用Hosmer-Lemeshow 检测评估模型校准度,若P>0.05,则模型校准度较好[16]。 采用ROC 曲线下面积(AUC)、灵敏度、特异度、最大约登指数来评价模型区分度,当0.5<AUC≤0.7,表示模型预测能力较低;0.7<AUC≤0.9,表示模型预测能力较好。 模型有效性采用决策曲线分析法进行评估。 以P<0.05 为具有统计学意义。
2 结果
2.1 一般资料 230 例行早期肠内营养的危重患者,年龄(66.47±15.52)岁,其中男性139 例(60.4%),女性91 例 (39.6%); 疾病类型: 神经系统71 例(30.9%),呼吸系统68 例(29.6%),循环系统54 例(23.5%),运动系统19 例(8.3%),内分泌系统10 名(4.3%),其他系统疾病8 名(3.4%);身体质量指数:<24 共184 例(80.0%),≥24 共46 例(20.0%)。
2.2 不同特征危重患者喂养不耐受发生情况的比较 230 例危重患者根据有无发生喂养不耐受分为耐受组(n=149)与不耐受组(n=81),喂养不耐受发生率为35.2%, 比较不同特征危重患者喂养不耐受发生情况。结果显示:不同性别、疾病类型、镇静镇痛药物应用、血管活性药物应用、2 种或2 种以上抗生素应用、喂养途径、年龄、身体质量指数的危重患者,其喂养不耐受发生情况比较, 差异均无统计学意义(P>0.05);不同APACHEⅡ评分、NRS 2002 评分、白蛋白、腹内压、空腹血糖、有无机械通气的危重患者,其喂养不耐受发生情况比较, 差异均有统计学意义(P<0.05)。 见表1。
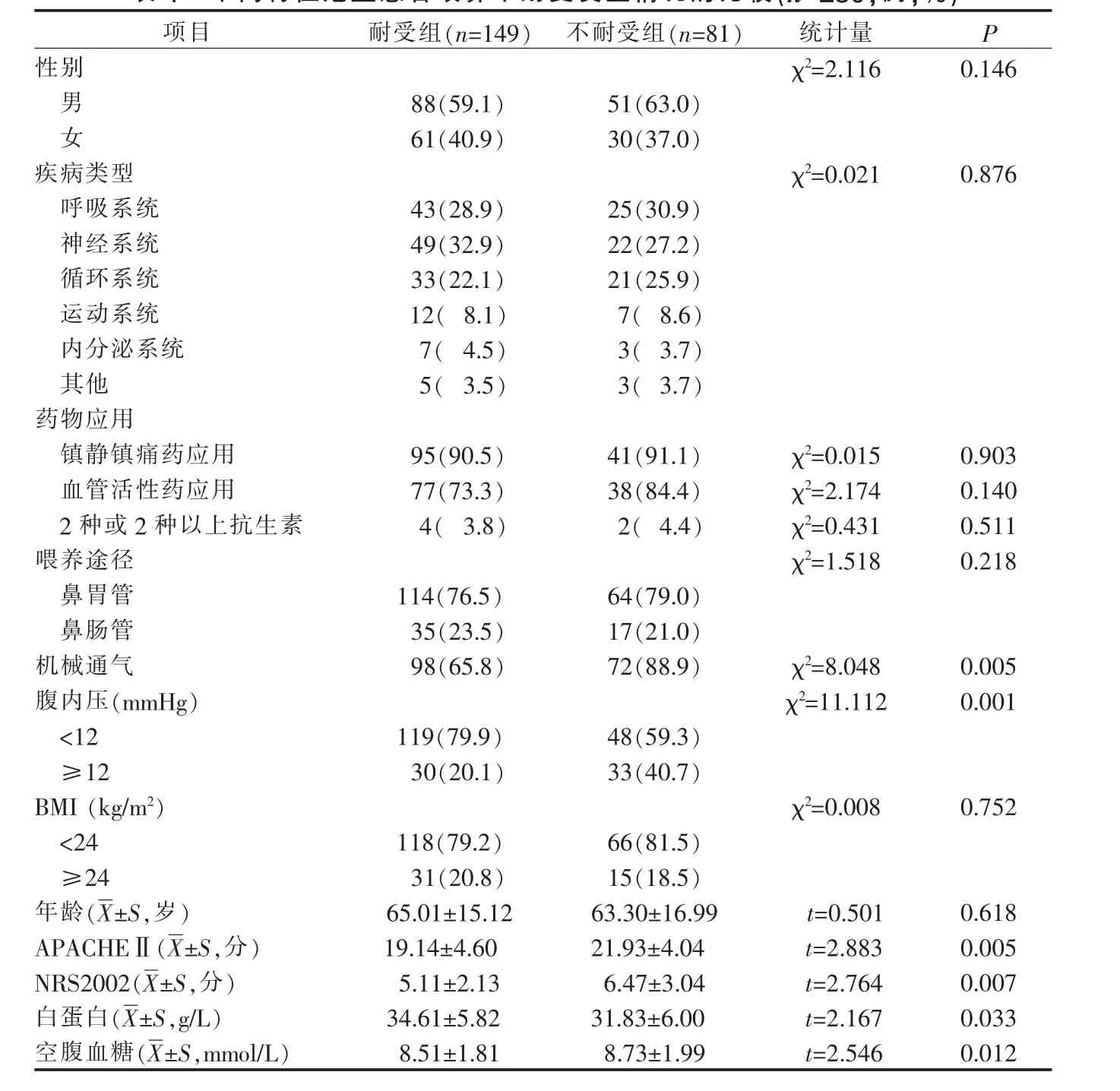
表1 不同特征危重患者喂养不耐受发生情况的比较(n=230,例,%)
2.3 危重患者发生喂养不耐受影响因素的二分类Logistic 回归分析 以是否发生喂养不耐受作为因变量(0=否,1=是),将单因素分析中具有统计学意义的6 个因素(APACHEⅡ评分、NRS 2002 评分、白蛋白、腹内压、空腹血糖、有无机械通气)作为自变量,进行二分类Logistic 回归分析(逐步回归法α入=0.05,α出=0.05)。结果显示APACHEⅡ评分 (OR=1.337)、NRS2002评分(OR=1.410)、腹内压(OR=1.415)是危重患者发生喂养不耐受的危险因素;白蛋白(OR=0.838)是危重患者发生喂养不耐受的保护因素。
最终得到公式为:Z=0.268×APACHEⅡ+0.344×NRS2002--0.177×白蛋白+0.347×腹内压-6.635,见表2。
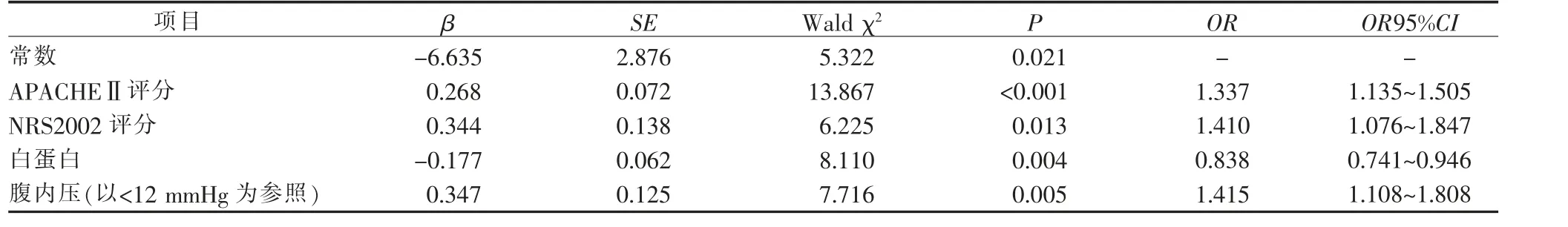
表2 危重患者喂养不耐受影响因素的二分类Logistic 回归分析(n=230)
2.4 危重患者喂养不耐受风险预测模型的效果评价 模型采Hosmer-Lemeshow 检测模型的拟合优度,χ2=5.683,P=0.683,差异无统计学意义。表明模型预测喂养不耐受的发生概率与实际发生概率比较,差异无统计学意义,拟合度较好。 绘制模型ROC 曲线,得出曲线下面积(AUC)为0.879,95%CI 为0.811-0.947, 以最大约登指数为0.676 为模型的最佳临界值,此时模型灵敏度为0.933,特异度为0.743,表明模型区分度较好。 见图1。
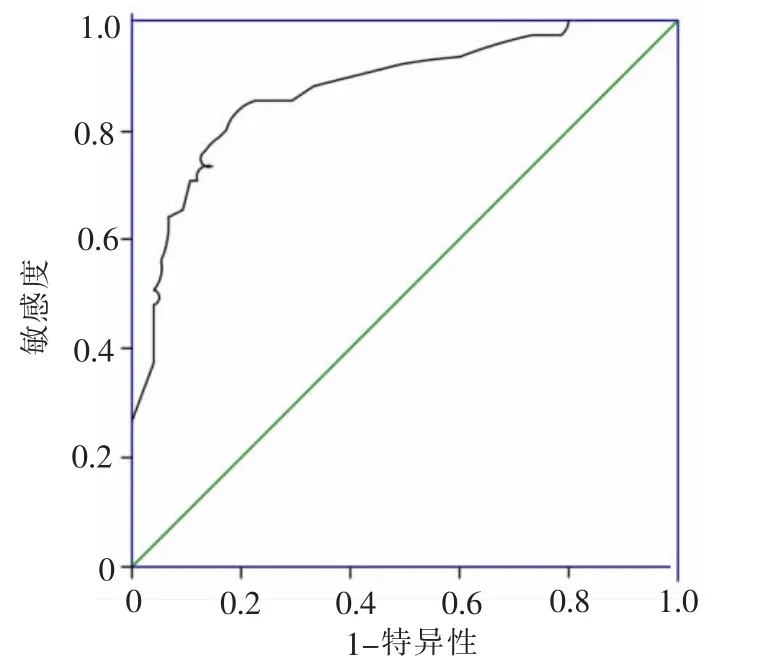
图1 危重患者肠内营养喂养不耐受风险预测模型ROC 曲线
3 讨论
3.1 危重患者早期肠内营养喂养不耐受影响因素分析
3.1.1 较高的白蛋白水平是危重患者早期肠内营养发生喂养不耐受的保护因素 本研究结果显示,较高的白蛋白水平是危重患者早期肠内营养发生喂养不耐受的保护因素(OR=0.838,P=0.004);与张国虹[17]的研究结果一致。 可能是较高水平的蛋白含量表明机体营养状况较好, 能够抵御重大创伤时炎症反应对胃肠道功能造成的损害。 由于机体在炎症反应的作用下蛋白分解代谢增加, 毛细血管通透性增强, 大量蛋白由血浆进入到组织液引起胃肠道黏膜水肿,使胃肠吸收能力下降[18],因此较高的蛋白水平可降低疾病急性期造成的肠道水肿、感染等,从而降低喂养不耐受的发生。
3.1.2 高APACHEⅡ评分是危重患者早期肠内营养发生喂养不耐受的危险因素 本研究结果显示,高APACHEⅡ评分是危重患者早期肠内营养发生喂养不耐受的危险因素 (OR=1.307,P<0.001),即APACHEⅡ评分越高, 患者发生喂养不耐受的风险就越大;与已报道的研究结果一致[19]。 患者在遭受重大创伤后机体优先保护重要脏器,如心、脑、肾等,使胃肠道血流减少,导致胃肠蠕动减缓;另一方面,机体应激作用使得激素水平异常,组织蛋白消耗过多,引起胃肠黏膜损伤,使耐受性下降[19],导致喂养不耐受的发生。
3.1.3 高NRS2002 评分是危重患者早期肠内营养发生喂养不耐受的危险因素 本研究结果显示,较高的NRS2002 评分是危重患者早期肠内营养发生喂养不耐受的危险因素 (OR=1.410,P=0.013),即NRS2002 得分越高,患者发生喂养不耐受的风险就越大。 机体在营养摄入不足的状况下往往伴随着各个器官功能的衰弱, 在疾病急性期发生胃肠功能障碍的风险显著提高, 从而加大了喂养不耐受的发生风险。 目前该评分作为喂养不耐受影响因素的研究鲜有报道, 本研究仅是将该评分作为反应患者营养状况的评估工具, 对该评分作为喂养不耐受发生的危险因素仍有待进一步验证。
3.1.4 高腹内压是危重患者早期肠内营养发生喂养不耐受的危险因素 本研究结果显示, 高腹内压是危重患者早期肠内营养发生喂养不耐受的危险因素(OR=1.415,P=0.005),即腹内压越高,喂养不耐受的发生风险就越大;与赵丽丽等[20]的研究结果一致。 高腹内压可使肠道静脉和淋巴液回流受阻, 同时腹内高压对肠道的压迫作用,使肠道淤血、肿胀,发生呕吐、胃残余过多等喂养不耐受的表现[21]。 本研究排除了胃肠道手术及肠道感染患者, 是考虑到该类患者的腹内压普遍偏高,将导致模型灵敏度下降,不适宜普遍应用。 今后的研究可根据腹部疾病患者腹内压变化情况,建立针对性的预测模型。
3.2 危重患者早期肠内营养喂养不耐受风险预测模型的预测效果 本研究针对所建立的喂养不耐受风险预测模型的预测效果进行了校准度及区分度的评估。 校准度是对模型预测概率和实际事件发生概率的比较,常用Hosmer-Lemeshow 拟合优度检验进行评价[22],当P>0.05,表明模型拟合优度较好。 本研究预测模型Hosmer-Lemeshow 检验结果中,χ2=5.683,P=0.683,表明模型预测喂养不耐受的发生概率与实际发生概率比较,差异无统计学意义,校准度较好。区分度用以评价模型预测事件发生风险的能力[23]。通常AUC 为0.7~0.9 时认为模型的预测效能较好,本研究模型AUC 为0.879,证明模型区分能力较好。当模型最大约登指数为0.676 时,其灵敏度为0.933,表明模型能够正确预测出喂养不耐受发生的概率较高,特异度为0.743,表明模型准确预测不会发生喂养不耐受的能力也较好。 本研究建立的危重患者早期肠内营养喂养不耐受风险预测模型其预测能力较好,能够较好的识别出喂养不耐受的高风险患者,为医护人员在评估喂养不耐受发生风险提供了一定的参考依据。
4 本研究的局限性
本研究的局限性在于没有对模型进行进一步的验证,同时样本缺乏多中心的证据支持,可能会影响模型在不同危重患者中的应用效果,因此,今后的研究中可对模型进行内外部的验证, 检验模型的预测效果,以便于该模型的进一步推广。

