晚期早产儿出生后不同时机添加维生素D对其6月龄生长及发育的影响*
贺秋红,陆怡帆,梁素丽,朱艳玲,马保芹,马得红,王 冬
(甘肃中医药大学第三附属医院白银市第一人民医院新生儿科,甘肃 白银 730900)
晚期早产儿指出生胎龄34~36+6周的早产儿。虽然大多数晚期早产儿从外观形态和体重评估接近足月儿,但晚期早产儿各脏器功能和代谢功能发育相对于足月儿来说尚处于不完全成熟阶段,故发病率和死亡率仍明显高于足月儿;在围生期中容易增加新生儿窒息和新生儿死亡的危险,在新生儿期容易发生新生儿败血症、呼吸窘迫综合征、新生儿喂养不耐受、化脓性脑膜炎等并发症,在儿童期与青春期中容易出现身长、体重等体格发育不良的情况,且在学龄期学习困难,语言发育、运动发育及智能发育等方面均较健康儿童偏低,在成年后患高血压、糖尿病、冠心病等疾病的风险也会增加。胎儿体内维生素D均以25羟维生素D[25(OH)D]的形式通过胎盘从孕母获得,且此转运主要发生在妊娠晚期,因此,与足月新生儿比较,早产儿维生素D缺乏情况更为常见[1]。根据最新数据,全球预估早产儿发生率为10.6%,我国早产儿发生率为6.9%,占全球早产儿总人数的7.8%,居世界第2位[2]。又因晚期早产儿发病率在早产儿中所占比例较高,故研究晚期早产儿这个群体维生素D不同时机的添加对其出生后追赶发育、提高生活质量意义重大。
1 资料与方法
1.1资料
1.1.1研究对象 选取2020年7月至2021年12月本院收住新生儿病房的胎龄34~<37周晚期早产儿120例作为研究对象。采用随机对照研究方法分为出生后3 d添加维生素D制剂组(3 d组)和出生后1周添加维生素D制剂组(1周组),每组60例。本研究经医院医学伦理委员会批准同意(YL-KY-2021-018),入选患儿家属均签署知情同意书,对符合标准的新生儿随访时持母子保健手册并记录随访结果。
1.1.2纳入标准 (1)胎龄34~<37周晚期早产儿;(2)住院过程中同一种类早产儿配方奶粉喂养。
1.1.3排除标准 (1)患有坏死性小肠结肠炎、先天性心脏病、先天性消化道发育畸形和遗传代谢性疾病(如先天性甲状腺功能减低症、苯丙酮尿症、糖原累积症等);(2)出生后住院时间未达到3 d,家长要求出院的新生儿;(3)未定期在本院新生儿门诊、儿童保健门诊进行随访者。
1.1.4评判标准 (1)以25(OH)D水平为评判标准,血清 25(OH)D<30 nmol/L为维生素D缺乏,30~50 nmol/L为维生素D不足,>50 nmol/L为适宜[3]。(2)以超声检查骨密度Z值为评判标准,Z>-1为健康,-1.5~-1为轻度骨密度不足,-2~<-1.5为中度骨密度不足,<-2为重度骨密度不足[4]。
1.2方法
1.2.1喂养方法 2组早产儿均达完全肠内喂养,纯母乳喂养或母乳和配方奶混合喂养的晚期早产儿口服维生素D3800 IU/d;完全配方奶粉喂养的晚期早产儿口服维生素D3400 IU/d。生命体征平稳出院。纯母乳喂养或母乳和配方奶混合喂养的晚期早产儿矫正月龄3个月时口服维生素D3制剂改为400 IU/d,完全配方奶粉喂养的晚期早产儿继续口服维生素D3制剂400 IU/d,同时给予喂养指导。
1.2.2纵向生长评估 矫正胎龄36~40周时采用Fenton 生长曲线图评估早产儿纵向生长;矫正月龄1~6个月使用世界卫生组织正常儿童生长曲线图评估儿童纵向生长。
1.2.325(OH)D检测 采集2组早产儿出生24 h末梢手指血分离血清,保存于4 ℃冰箱待测;采用荧光免疫法检测25(OH)D水平。
1.2.4超声骨密度检测 测量部位为儿童左侧胫骨远端1/3处,以同年龄、同性别亚洲儿童胫骨超声波传播速率的Z值作为判定标准。
1.2.5资料收集 (1)采用问卷形式调查2组早产儿出生时一般情况,包括胎龄、出生时情况(有无胎膜早破、出生时羊水情况、有无脐绕颈)等;(2)测量2组早产儿出生24 h身高、体重、头围情况等。
1.2.6随访 (1)出院矫正胎龄40周内每半个月复诊1次,测量2组早产儿身高、体重、头围、指导喂养等,采用 Fenton 生长曲线进行体格评估,同时给予喂养指导;(2)矫正胎龄40周时评估2组早产儿身高、体重、头围、检测25(OH)D水平等,此后每个月复诊1次,采用世界卫生组织生长曲线进行体格评估,至矫正月龄3、6个月时采集2组早产儿末梢血检测25(OH)D水平,超声监测骨密度水平。
2 结 果
2.1一般资料 120例早产儿中男53例,女67例;胎龄:34~34+6周32例,35~35+6周52例,36~36+6周36例;体重:<1.5 kg 6例,1.5~<2.0 kg 24例,2.0~<2.5 kg 56例,≥2.5 kg 34例。胎龄分布情况见图1。不同胎龄早产儿体重分布情况见图2。2组早产儿胎龄、体重分布情况表1。

表1 2组早产儿胎龄、体重分布情况(n)

图1 胎龄分布情况

图2 不同胎龄早产儿体重分布情况
2.2不同胎龄2组早产儿出生时、矫正胎龄40周时生长情况比较 不同胎龄2组早产儿出生时、矫正胎龄40周时身长、体重、头围、25(OH)D水平比较,差异均无统计学意义(P>0.05)。见表2。

表2 不同胎龄2组早产儿出生时、矫正胎龄40周时生长情况比较
2.3不同胎龄2组早产儿矫正月龄1~6个月时生长情况比较 不同胎龄2组早产儿矫正月龄1个月时身长、体重、头围比较,差异均无统计学意义(P>0.05);2组早产儿矫正月龄3~6个月时身长、体重、头围、25(OH)D水平比较,差异均有统计学意义(P<0.05);2组早产儿矫正月龄3个月时骨密度比较,差异无统计学意义(P>0.05);矫正月龄6个月时骨密度比较,差异有统计学意义(P<0.05)。见表3。

表3 不同胎龄2组早产儿矫正月龄1~6个月时生长情况比较

续表3 不同胎龄2组早产儿矫正月龄1~6个月时生长情况比较
2.42组早产儿矫正胎龄40周、1~6个月时生长情况柱状图和线性分布 2组早产儿矫正胎龄40周、1~6个月时身长、体重、头围、25(OH)D水平、骨密度柱状图和线性分布见图3~7。

图3 2组早产儿矫正胎龄40周、1~6个月时身长柱状图及线性分布
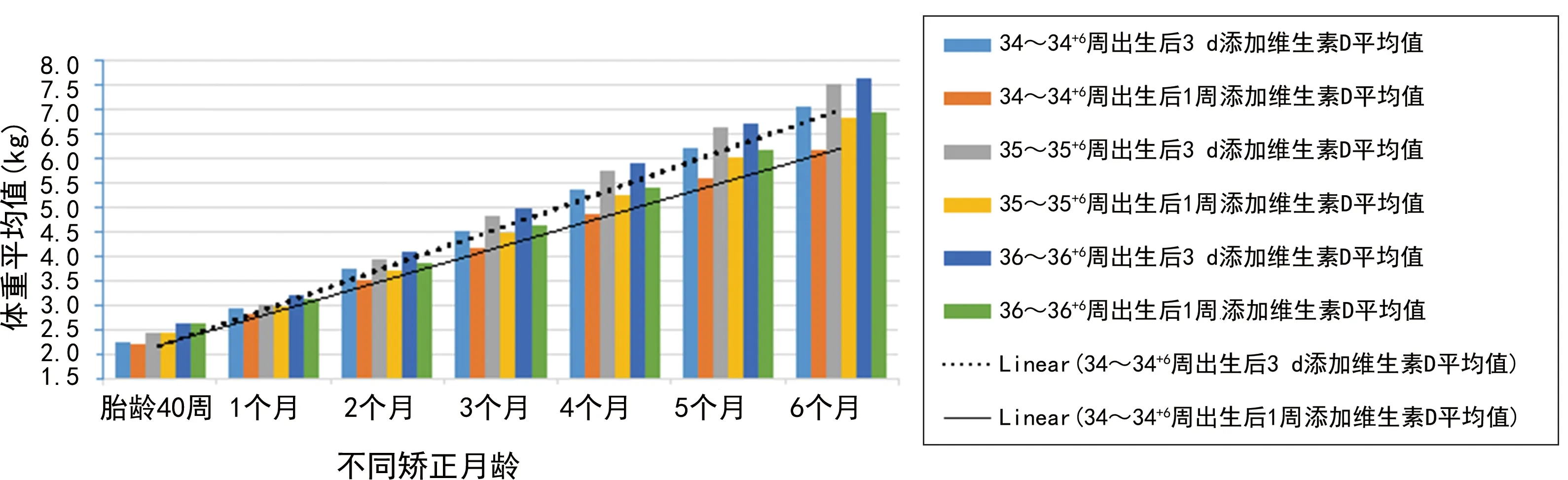
图4 2组早产儿矫正胎龄40周、1~6个月时体重柱状图及线性分布

图5 2组早产儿矫正胎龄40周、1~6个月时头围柱状图及线性分布

图6 2组早产儿矫正胎龄40周、1~6个月时25(OH)D水平柱状图及线性分布
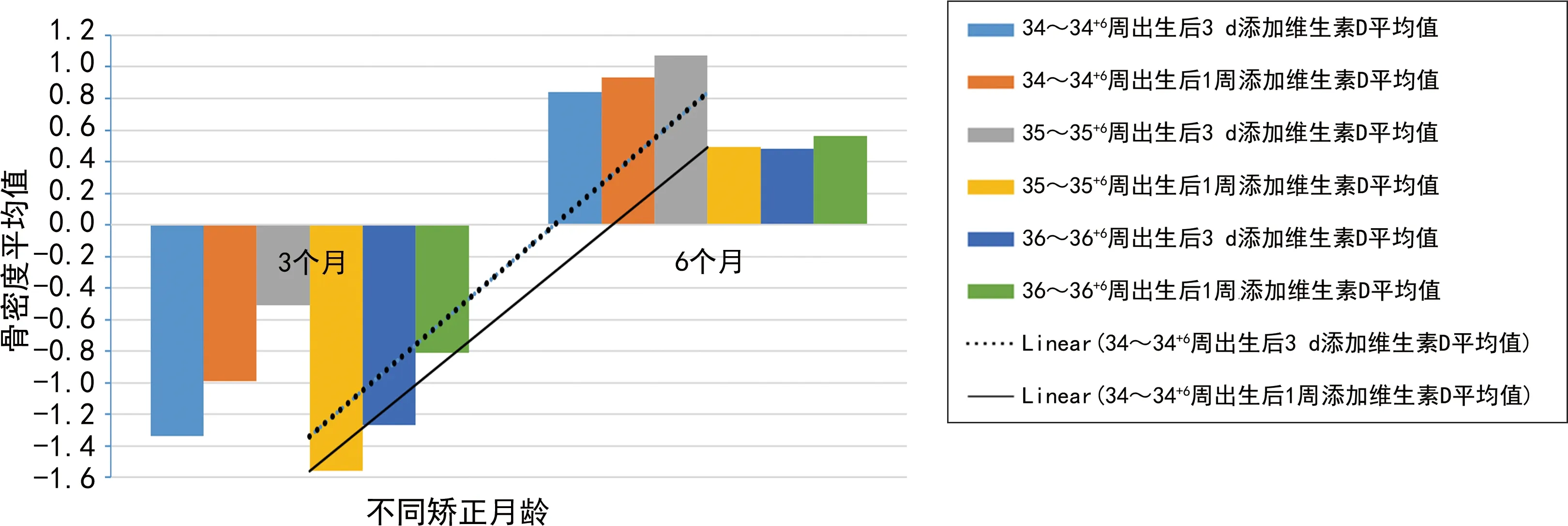
图7 2组早产儿矫正胎龄40周、1~6个月时骨密度柱状图及线性分布
3 讨 论
维生素D缺乏症是全球公共卫生营养管理问题之一,对新生儿期、婴幼儿期、学龄前期等不同年龄段均有影响,特别是对5岁以下儿童健康问题的影响尤为突出,究其原因大多考虑与早产维生素D先天储备减少、儿童饮食中摄入的维生素D量不足、户外活动参加相对少、儿童正规且规范添加维生素D制剂的比例偏低有关。据调查,我国0~<3、3~<5、5~<8、8~<12、12~<18、18~23月龄婴幼儿过去1周服用维生素D补充剂的比例分别为27.0%、30.1%、43.8%、38.5%、35.2%、33.4%,城市婴幼儿比例明显高于农村(分别为42.1%~62.5%、11.9%~22.8%)[5-6]。说明给新生儿及时且规范地补充维生素D制剂对改善5岁以下儿童营养状况、降低维生素D缺乏是非常必要的。因近年来晚期早产儿发生率逐年上升,且晚期早产儿各器官及系统发育均处于不完全成熟阶段,故出生后并发症偏多、生长及发育相对于足月儿落后,因此,研究晚期早产儿使其尽早追赶发育到同龄儿童水平不仅是医务人员关注的问题,也是早产儿的家长比较关心的问题。本院2020年7月至2021年12月早产儿发生率为5.98%(181/3 026),晚期早产儿在早产儿中的发生率为85.08%(154/181)。国内有研究表明,晚期早产儿占所有早产儿的82.34%(1 091/1 325),占所有新生儿的8.15%(1 091/13 381)[7]。本院早产儿发生率低于国家早产儿发病率,但晚期早产儿发病率还是比较高,可能与部分晚期早产儿因各种原因在宫内进行转运至省级妇幼专科医院有关,提示本院新生儿科需改善设备设施建设,提高早产儿救治能力。
作者临床工作中发现,晚期早产儿这个群体维生素D制剂不同添加时期,其矫正月龄6个月时生长及发育有差异,25(OH)D水平、超声骨密度值均有不同程度的改善,并申请该项目立项进行数据统计研究。由图1可见,35~35+6周晚期早产儿所占比例最高(43.3%)。由图2可见,35~35+6周晚期早产儿体重2.0~<2.5 kg者居多(23.3%),说明晚期早产儿以35~35+6周、体重2.0~<2.5 kg者发病率最高。由表2、3可见,2组早产儿出生时,矫正胎龄40周、1个月时身长、体重、头围比较,差异均无统计学意义(P>0.05);34~34+6周胎龄2组早产儿矫正月龄2个月时身长、体重、头围比较,差异也均无统计学意义(P>0.05);35~35+6周、36~36+6周胎龄2组早产儿矫正月龄2~6个月时身长、体重、头围比较,差异均有统计学意义(P<0.05)。2组早产儿出生时、矫正胎龄40周时25(OH)D水平比较,差异均无统计学意义(P>0.05);矫正月龄3、6个月时25(OH)D水平比较,差异均有统计学意义(P<0.05)。2组早产儿矫正月龄3个月时骨密度比较,差异无统计学意义(P>0.05);矫正月龄6个月时骨密度比较,差异有统计学意义(P<0.05)。由图3~7可见,身长、体重、头围、25(OH)D水平、超声骨密度方面,晚期早产儿在矫正月龄6个月时,出生后3 d添加维生素D制剂组均优于出生后1周添加维生素D制剂组,说明给晚期早产儿出生后3 d尽早地补充维生素D制剂有助于25(OH)D水平维持在正常水平、促进骨密度的增强、提高体格发育,使晚期早产儿生长及发育尽快追赶至同龄儿童水平,为晚期早产儿儿童期良好的生长及发育提供了帮助。
维生素D缺乏一般呈慢性过程,早期表现为维生素D不足,此时虽然对机体发育、免疫、代谢功能产生了一定的影响,但一般没有表现出明显症状,随着维生素D来源不足的持续加剧,进入维生素D缺乏阶段,此时最突出的病理改变是钙磷代谢的紊乱和骨健康的损害,导致佝偻病、手足搐搦症的发生,严重者出现喉痉挛,甚至发生窒息导致死亡[8]。近年来,有研究表明,儿童期维生素D不足不仅可增加成年时期骨质疏松的风险,也可增加呼吸道感染、肠道炎症、过敏症、哮喘症发生的风险[3]。新生儿体内25(OH)D源自母体供给,其含量与母亲体内25(OH)D水平密切相关[9-10];早产儿从母体获得的维生素D水平相对较低,因此,从新生儿出生开始补充维生素D制剂预防儿童时期疾病的发生是一项很重要的举措。本研究通过给晚期早产儿出生后尽早补充外源性维生素D制剂,促进钙、磷的吸收和重吸收,旧骨脱钙和新骨形成,以及自身免疫系统的调节功能,对晚期早产儿远期高质量的生长及发育显然具有很重要的意义。
出生后不同时机添加维生素D制剂国内也有相关研究,但众说纷纭,有提出出生后即刻开始添加者,有提出出生后1周添加者,有提出出生后2周开始添加或达到完全肠内营养开始添加者。《中国儿童维生素 A、维生素D临床应用专家共识》建议,自出生后1周开始早产儿、低出生体重儿、多胎儿口服维生素D3制剂 800 IU/d[3]。尽管共识中提出早产儿出生后1周开始添加维生素D3,但有研究表明,早产儿出生后第3天开始每天补充维生素D 800 IU较400 IU更能改善钙磷代谢状态,且可提高血清白细胞介素-2S水平[11]。有学者对关于早产儿维生素D3不同补充时期进行研究,结果显示,早产儿出生后3 d进行维生素D干预,纠正月龄1~3、6个月4个阶段的骨密度均较高、身长均较长,纠正月龄6个月时25(OH)D 水平较高[12]。本研究对晚期早产儿不同时机添加维生素D3制剂发现,在矫正月龄6个月时无论是给予纯母乳喂养、混合喂养和人工配方奶粉喂养中的任何一种喂养方式,出生后3 d添加维生素D制剂矫正月龄3、6个月时身长、体重、头围、体内25(OH)D水平均优于出生后1周添加维生素D制剂者,超声骨密度值明显增高。国内临床研究发现,早产儿血清25(OH)D水平与超声骨密度具有相关性,出生时血清25(OH)D水平高的早产儿胫骨超声骨密度优于血清25(OH)D水平低者[13]。因此,加强新生儿早期25(OH)D的监测和筛查,尽早添加维生素D制剂不仅有助于早产儿骨密度的增强和促进身长体格的发育,也是进一步控制维生素D缺乏症的重要手段之一。
因晚期早产儿从外观形态上近似于足月儿,部分地方和基层医院的产科医师认为此类早产儿无须转入新生儿病房进行观察和早期干预治疗,也有部分地方和基层医院从事儿科、新生儿科的医师对晚期早产儿重视度不够,未对其进行出院后系统、正规的随访和管理,错过了从出生后就进行追赶发育的好时期,使部分晚期早产儿最终的发育落后于同龄儿童。希望通过本研究结论,加强产科医师对晚期早产儿出生后尽早转诊至新生儿病房的认知度,加强产科、儿科之间的紧密协作与配合,同时提高儿科、新生儿科医师对晚期早产儿尽早干预治疗的理念,加强高危儿的随访,使产前、分娩、新生儿早期发展、高危儿管理、儿童保健的预防保健体系达到无缝衔接。

