拉曼光谱技术在非侵入性优选卵裂期胚胎中的应用*
曹 芳,王宇峰,于春梅,夏西洋,高亭亭,戴秀亮
(南京医科大学附属常州市妇幼保健院生殖中心,江苏 常州 213000)
胚胎发育潜能直接影响人类辅助生殖技术的临床结局。目前,主要以形态学评分评估胚胎质量,具有主观性,预测妊娠结局的价值有限,因此,探索能更客观地评价胚胎发育潜能,更准确地选择优质胚胎,从而提高临床妊娠率是胚胎学家需要攻克的难点。胚胎在其形态发生改变之前已发生了代谢产物的变化,而培养基是胚胎在体外的直接生存环境,培养基中代谢物质变化可能与胚胎质量有关。本研究探讨了利用拉曼光谱技术对培养基代谢物质分析是否与胚胎生殖潜力相关,从而寻找一种新的客观评价胚胎质量的方法。
1 资料与方法
1.1研究对象 收集2019年86例体外受精/卵细胞浆内单精子注射周期中第3天(D3)卵裂期胚胎培养液,其中D3优质卵裂胚形成优质囊胚27例,D3优质卵裂胚未形成囊胚29例,D3次级卵裂胚未形成囊胚30例。
1.2方法
1.2.1胚胎培养及分级 人绒毛膜促性腺激素日48 h后常规消毒取卵,在体外受精微滴中授精过夜,去除受精卵颗粒细胞后转移至G1培养液滴,记录第1天(D1)原核情况,D3将准备继续进行囊胚培养的卵裂胚转移至G2培养液滴。根据胚胎形态学评分标准对卵裂期胚胎进行分级,Ⅰ、Ⅱ级为优质卵裂胚;Ⅲ级为次级卵裂胚,Ⅳ级为废弃胚胎。用序贯培养法将卵裂期胚胎继续培养至第6天后根据卵裂胚继续培养是否形成囊胚,以及形成的囊胚根据评分标准分为优质囊胚(内细胞团及滋养细胞均为B级以上)和次级囊胚(内细胞团或滋养细胞为C级)。
1.2.2检测拉曼光谱数据 将保存在-80 ℃冰箱中的待测培养基样品在25 ℃下解冻,平衡30 min,去除表面的矿物油,利用320 mW功率的拉曼光谱系统(Basecare Raman200,中国)收集拉曼光谱,激光波长785 nm,光斑大小为100 μm。取7 μL胚胎培养基滴落在覆盖一层薄金膜(100 nm)的石英玻璃片上。在标准模式下单次检测曝光时间为20 s,累计3次,最终拉曼信号通过电荷耦合器件相机收集、处理。
1.2.3拉曼光谱数据的处理与分析 获取原始光谱后首先扣除暗电流贡献的环境噪声信号,再选取600~1 800 cm-1波段数据作为生物指纹区,然后进行基线校正去除部分由基底及背景荧光贡献的干扰信号,采用主成分分析(PCA),最后对所有样本数据进行归一化处理,统一数据规格。使用R软件进行数据分析,使用ggplot2和ggpubur绘制分析结果。
2 结 果
86例卵裂胚培养液样本中56例优质卵裂胚与30例次级卵裂胚之间的信号存在明显差异,具有明确的聚类现象。见图1。27例D3优质卵裂胚形成囊胚与30例 D3次级卵裂胚未形成囊胚之间的信号存在明显差异,具有明确的聚类现象。见图2。27例D3优质卵裂胚形成囊胚与29例D3优级卵裂胚未形成囊胚之间的信号存在明显差异,具有明确的聚类现象。见图3。分类准确性可达到85%以上。29例D3优质卵裂胚未形成囊胚与30例D3次质卵裂胚未形成囊胚之间的信号没有明显差异。见图4。分类准确性只有57%。

图1 优质卵裂胚与次级卵裂胚的信号PCA

图2 优质卵裂胚形成囊胚与次级卵裂胚未形成囊胚的信号PCA
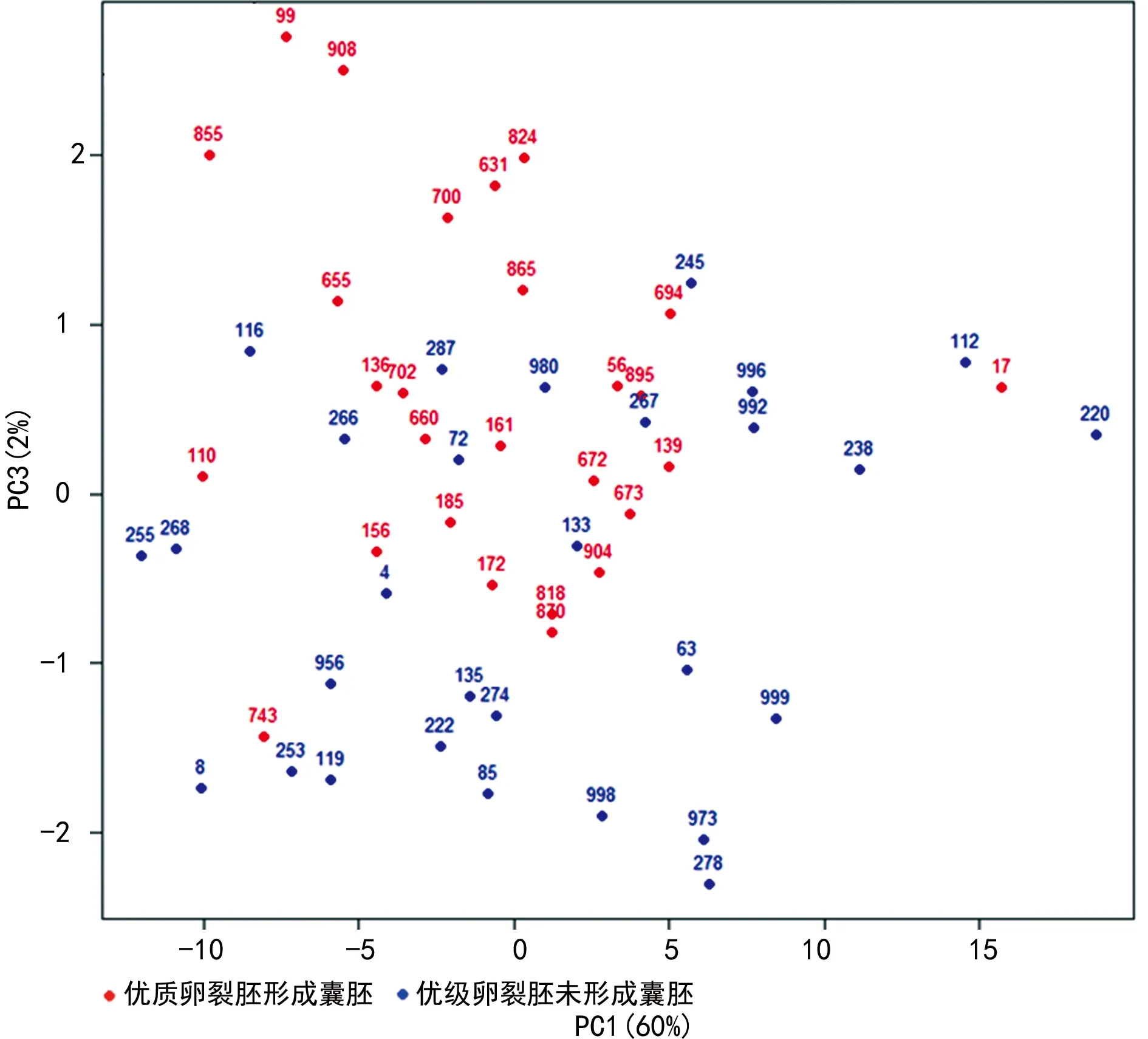
图3 优质卵裂胚形成囊胚与优级卵裂胚未形成囊胚的信号PCA
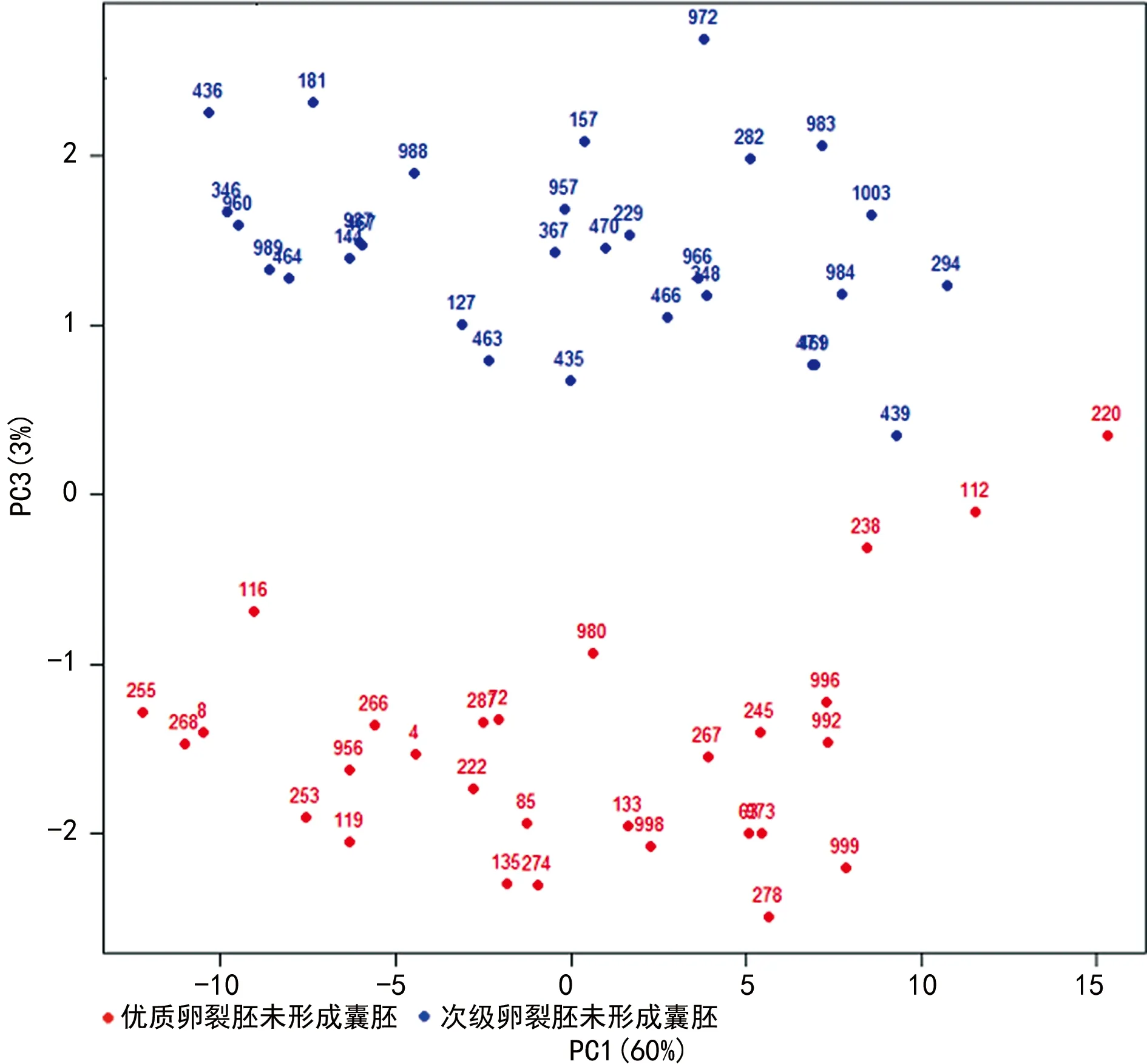
图4 优质卵裂胚未形成囊胚与次级卵裂胚未形成囊胚的信号PCA
3 讨 论
目前,主要根据形态学(卵裂球数量、碎片、多核、空泡和卵裂球均一性)结合卵裂率(受精卵的卵裂速度)选择卵裂期胚胎[1-2]。尽管这些评估系统对胚胎无损伤,操作简便,但易受胚胎观察人员主观因素的影响,一定程度上制约了胚胎质量评估的可重复性。为选择具有更高发育潜能的胚胎,胚胎学家建立了蛋白质组学、呼吸速率测量等[3-5]评估胚胎存活能力和发育潜力的非侵入性方法,但因检测费用、技术人员培训或不能快速提供结果等原因均未得到广泛应用。氨基酸在早期胚胎发育中具有多种作用,其消耗和生产氨基酸的方式取决于发育阶段。胚胎的细胞基因组在不同转录状态下表达不同的蛋白分子,调控影响胚胎发育潜能[6-7]。有研究表明,不同发育时期胚胎分泌蛋白谱有着显著的不同:在胚胎发育的最初24 h内培养液中分泌蛋白主要是母系来源蛋白;而D3胚胎由于合子基因组的激活,在培养液中产生大量的胚胎特异分泌蛋白。
拉曼光谱属于散射光谱范畴,是光与物质相互作用而产生的。单色光入射到某一介质大多数产生瑞利散射;另有极少数散射光传播方向及光波频率发生了改变,这样的散射被称为拉曼散射[8]。有研究发现,通过不同材料的介质,由于散射层面的结构不同、分子基团对散射光频率产生不同影响,从而可通过散射光特点对物质进行定性和定量分析[9-10]。由于拉曼光谱技术在物质检测方面具有高效、简便、样本量少、重复性高等特点已被广泛用于生物制药、医学检验等领域,成为疾病检测和诊断的重要手段[11-13]。
不同发育潜力胚胎的培养液接受激光照射后会产生不同的拉曼光谱位移和谱带强度。在辅助生殖技术领域中很少有学者使用拉曼光谱技术研究胚胎形态和胚胎质量之间的相关性。受精后胚胎应用单一培养法,每个微滴体积约25 μL,本研究利用拉曼光谱技术检测样本需求量极微,具有无创的特点,对传统体外受精中的废介质进行分析,通过胚胎培养液的变化快速优选胚胎。本研究对86例样本分别进行9次不同点测试,共获得774组样本信号。为消除随机误差信号和宇宙高能离子对拉曼光谱信号的干扰,对每例样本的9次重复信号进行合并、平均,共得到86例平均光谱组。其中56例优质胚胎与30例次级胚胎之间的信号存在明显差异,具有显著的分类聚合现象,且基于拉曼光谱技术的评估方法与体外受精过程中胚胎D3的形态学评分结果相一致。可能机制是发育至D3的优质胚胎和次级胚胎存在代谢差异,胚胎发育过程中不断发生新陈代谢,通过自分泌作用改变周围生存环境。29例优质卵裂胚未形成囊胚组及30例次级卵裂胚未形成囊胚组信号也存在明显差异,具有明确的聚类现象,说明这种拉曼光谱之间的差异与囊胚形成能力无明显相关。由于次级卵裂胚形成的囊胚数量较少,将在后续研究中比较优质卵裂胚形成囊胚及次级卵裂胚形成囊胚的差异,进一步证实卵裂期胚胎拉曼光谱是否与囊胚形成能力有关。
拉曼光谱学是基于分子振动信息,提供了丰富的分子结构和组成信息,而不造成任何损害[14-15]。另外,拉曼光谱学特别适用于水样,而且该技术取材微量,检测方便,本研究只用了几分钟和7 μL的样本量检测参数,为卵裂期胚胎提供了一种新的简单、客观、实时、无创的评估胚胎方法,结合形态学评估方法可更有效地选择胚胎,也可用于评估不同培养基的培养效果、不同患者周期胚胎质量的比较等。尤其是对卵巢功能低下等获卵少的患者,能更准确地在D3卵裂期利用拉曼光谱筛选出发育潜能优良的胚胎进行移植,缩短体外培养时间,提高卵子利用率,改善试管婴儿的临床妊娠结局并减少多胎妊娠。

