下肢动脉硬化闭塞症患者血清IL-17和TNF-α水平表达及其临床意义
姜永滨,任东铭,隋成君(鞍山市鞍钢总医院介入科,辽宁鞍山 114000)
下肢动脉硬化闭塞症(arteriosclerosis obliterans,ASO)是临床血管外科常见疾病,其发病率随年龄的增长而增加,常给患者生活质量造成严重影响[1]。Fontaine分期在指导下肢动脉硬化闭塞症临床治疗中有重要意义,但其无法准确用于分期诊断、病情风险及预后评估[2-3]。因此,寻找合适的生物标志物正确评估下肢动脉硬化闭塞症疾病进展,对于疾病的治疗十分必要。白细胞介素(interleukin,IL)-17是一种由T淋巴细胞亚群分泌的促炎因子,可间接参与动脉粥样硬化的形成[4]。肿瘤坏死因子(tumour necrosis factor,TNF)- α不仅是调节粒细胞激活的重要细胞因子,还是体内重要的炎症介质,参与动脉粥样硬化的发生、发展[5-6]。IL-17,TNF-α均与动脉粥样硬化有关,但二者与下肢动脉硬化闭塞症分期及预后的相关性有待进一步研究。本研究通过分析不同分期及预后下肢动脉硬化闭塞症患者血清IL-17,TNF-α表达水平,以期为疾病的早期预测及预后改善提供参考指标,现报道如下。
1 材料与方法
1.1 研究对象 选取2016年5月~2020年1月于鞍山市鞍钢集团总医院住院治疗的90例下肢动脉硬化闭塞症患者为研究对象(病例组),男性48例,女 性42例,年 龄42~78(61.37±10.03)岁;吸烟45例,饮酒36例;同期选取健康体检者92例作为对照组,男性46例,女性46例,年龄42~78(60.28±9.46)岁;吸烟42例,饮酒32例。对照组和病例组年龄、性别、吸烟、饮酒情况比较,差异均无统计学意义(均P>0.05)。
纳入标准:①符合下肢动脉硬化闭塞症诊治指南[7];②病例资料齐全,且经本院临床研究伦理委员会批准,所有研究对象均为自愿参加;③无影像学检查禁忌症者;④入组前1个月内均未服用过激素类、免疫抑制剂等。排除标准:①有多发性大动脉炎、血栓闭塞性脉管炎等其他原因引起的动脉闭塞疾病者;②并发有心脏病、严重肝肾功能损伤、全身感染或恶性肿瘤等疾病者;③处于月经期女性。
1.2 仪器与试剂 IL-17 ELISA试剂盒(滁州仕诺达生物科技有限公司,货号:SND-H1814),TNF-α ELISA试剂盒(上海瓦兰生物科技有限公司,货号:E01593),全波长酶标仪(北京赛百奥科技有限公司,型号:Multiskan GO)。
1.3 方法
1.3.1 样品采集及保存:采集健康体检者体检当天、下肢动脉硬化闭塞症患者入院第二天晨起空腹肘静脉血样,3 000 r/min离心15 min后收集血清,置于-80℃保存待测。
1.3.2 血清IL-17,TNF-α水平测定:采用酶联免疫吸附试验(enzyme linked immunosorbent assay,ELISA)法检测血清IL-17,TNF-α水平,操作步骤严格按照试剂盒说明书进行。
1.3.3 下肢动脉硬化闭塞症患者Fontaine分期及预后评定[7-8]:根据Fontaine分期标准,将患者分为I期组14例,II期组38例,III期组26例,IV期组12例。I期患者主要表现为无症状及体征或仅自述下肢轻微不适,动脉阻塞为单一部分,轻度受累;II期患者主要表现为间歇性或中重度跛行、红斑、趾温下降、动脉阻塞为单一部分,中重度受累或多部位轻度受累;III期患者主要表现为静息痛,肢体萎缩、紫绀,多部位、多水平受累;IV期患者主要表现为缺血性溃疡或坏疽,严重多部位、多水平受累。
患者行支架植入痊愈后再狭窄判定标准:支架内或支架两端5 mm内管腔直径狭窄≥50%。根据是否出现再狭窄,将患者分为正常组78例,狭窄组12例。
1.4 统计学分析 利用SPSS 23.0对数据进行统计学分析,计量资料符合正态分布,以均数±标准差(±s)表示,两组间比较行t检验,多组间比较采用单因素方差分析,进一步两两比较采用SNK-q检验;计数资料以n表示,组间比较采用卡方检验;采用Pearson法分析下肢动脉硬化闭塞症患者血清IL-17与TNF-α的相关性。P<0.05为差异有统计学意义。
2 结果
2.1 对照组与病例组血清IL-17,TNF-α水平表达比较 病例组血清IL-17(812.94±103.75pg/ml),TNF-α(74.28±4.96ng/L)水平高于对照组(421.58±97.46 pg/ml,30.44±2.79ng/L),差异均有统计学意义(t=26.235,73.696,均P<0.05)。
2.2 下肢动脉硬化闭塞症患者血清IL-17与TNF-α的相关性 见图1。Pearson法分析结果显示,下肢动脉硬化闭塞症患者血清IL-17与TNF-α呈正相关(r=0.527,P<0.05)。
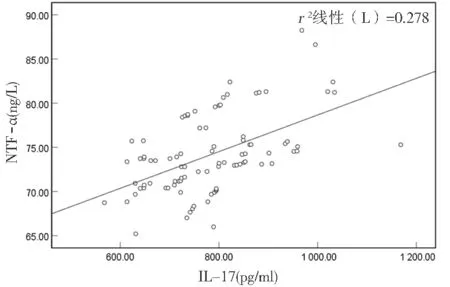
图1 下肢动脉硬化闭塞症患者血清IL-17与TNF-α的相关性
2.3 不同Fontaine分期下肢动脉硬化闭塞症患者血清IL-17,TNF-α水平表达比较 见表1。IV期组血清IL-17,TNF-α水平均高于I期组、II期组和III期组,差异有统计学意义(t=10.631,44.078;8.831,49.022;2.879,15.308,均P<0.001)。III期组血清IL-17,TNF-α水平均高于I期组和II期组,差异有统计学意义(t=9.586,36.192;3.754, 21.545,均P<0.001)。II期组血清IL-17,TNF-α水平均高于I期组,差异有统计学意义(t=6.188,15.555,均P<0.001)。
表1 不同Fontaine分期组下肢动脉硬化闭塞症患者血清IL-17,TNF-α水平表达比较(±s)
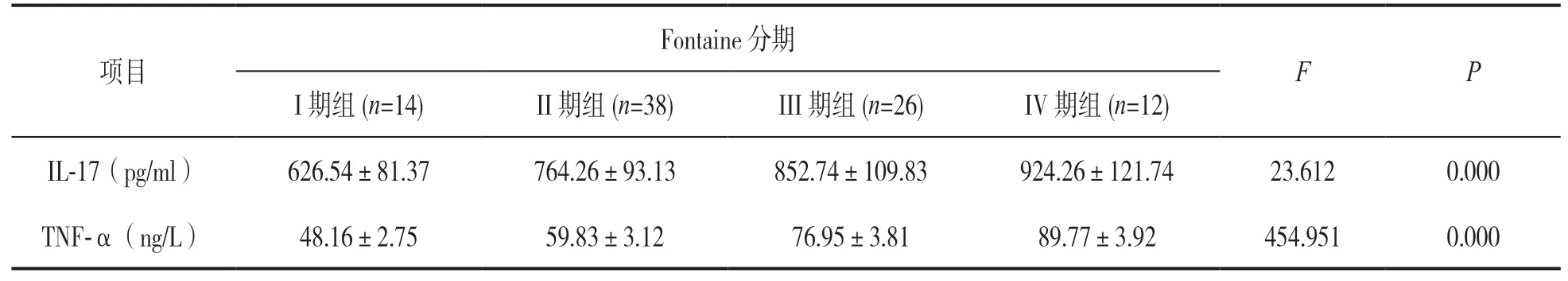
表1 不同Fontaine分期组下肢动脉硬化闭塞症患者血清IL-17,TNF-α水平表达比较(±s)
?
2.4 不同预后组血清IL-17,TNF-α水平表达比较狭窄组血清IL-17(894.27±110.34pg/ml),TNF-α(79.26±3.71ng/L)水平高于正常组(653.29±98.16 pg/ml,53.18±2.94ng/L),差异均有统计学意义(t=7.790,27.604,均P<0.05)。
3 讨论
动脉粥样硬化始动因素可能是炎症反应,血管内皮细胞损伤,而下肢动脉硬化闭塞症是动脉粥样硬化病变的重要肢体表现[9-10]。支架置入术是治疗下肢动脉硬化闭塞症的重要手段,但术后再狭窄仍是目前临床医师面临的重难点[11]。
IL-17可通过降解细胞外基质破坏动脉粥样硬化斑块稳定性,在炎症反应中发挥重要作用[12-13]。TNF-α可通过诱发循环中及自身的单核细胞产生多种促炎因子,促进炎症连锁反应[14-15]。既往研究显示[16-18],IL-17,TNF-α与动脉粥样硬化有密切联系,而本研究中下肢动脉硬化闭塞症患者血清IL-17,TNF-α水平高于健康人群,与既往文献IL-17,TNF-α的表达趋势一致。提示血清IL-17,TNF-α水平表达异常可能与下肢动脉硬化闭塞症的发生有关。推测其可能是由于疾病初期,患者体内炎症反应增加,而IL-17,TNF-α作为炎症反应中的关键起始因子,其水平表达均增加。本研究中血清IL-17,TNF-α表达水平随Fontaine分期增加而升高,与韩玉明等[19]结果具有一致性。提示IL-17,TNF-α在下肢动脉硬化闭塞症的发病过程中可能起到重要作用,临床可考虑将IL-17,TNF-α作为下肢动脉硬化闭塞症严重程度的评估指标,指导疾病治疗。IL-17与TNF-α的相关性结果进一步提示二者在下肢动脉硬化闭塞症疾病进展中可能发挥协同作用。此外,下肢动脉硬化闭塞症术后血清IL-17,TNF-α水平升高可能造成机体炎症反应剧烈,而术中机械性压力会导致内皮细胞和血管壁受损,影响患者手术疗效,增加再狭窄几率。
综上所述,IL-17,TNF-α在下肢动脉硬化闭塞症患者血清中均呈高表达,且随患者病情程度加深,二者表达水平呈升高趋势。此外,血清IL-17,TNF-α表达水平与下肢动脉硬化闭塞症患者术后再狭窄有一定的联系,有可能成为预后预测及疾病治疗的潜在靶点。临床上可通过密切监测血清IL-17,TNF-α水平变化,制定相应的干预措施,避免患者发生支架内再狭窄,降低支架置入术带来的高风险。本研究的不足之处为样本量较少,今后将增加样本量进一步验证IL-17,TNF-α的具体作用机制及实际临床应用价值。

