耐碳青霉烯类大肠埃希菌临床分布、耐药特征及携带mcr基因分析
刘 周,杭修兵,储雯雯,李 昕,姚 杰,周 强(安徽医科大学第二附属医院检验科,合肥 230601)
大肠埃希菌(Escherichia coli)是临床常见的条件致病菌,可导致各类医院及社区获得性感染,常见的感染类型包括泌尿系统感染、腹腔感染、血流感染等[1-2]。大肠埃希菌易通过携带质粒介导的超广谱β-内酰胺酶及头孢菌素酶编码基因对头孢类抗生素产生耐药表型,而碳青霉烯类抗生素是治疗上述细菌所致重症感染的主要抗生素[1]。近年来,虽然大肠埃希菌对碳青霉烯类抗生素仍然保存较低的耐药率,但由于其整体基数较大,因此耐碳青霉烯类大肠埃希菌(carbapenem-resistanceE. coli,CREC)在临床中仍然较为多见[3-4]。CREC常呈现多重耐药表型,仅对多黏菌素、替加环素等敏感。2015年,我国学者首次在大肠埃希菌中发现质粒介导的多黏菌素耐药(mobile colistin resistance,mcr)基因[5],其后mcr系列基因在临床菌株中不断被检出[6]。目前本地区CREC菌株的mcr基因携带情况报道较少,因此本研究拟对本地区一所省级综合性三甲医院临床分离的CREC临床分布、碳青霉烯耐药基因及mcr基因进行检测,为临床多重耐药菌防控提供参考。
1 材料与方法
1.1 研究对象 收集安徽医科大学第二附属医院2020年7月~2021年6月期间临床住院患者送检各类临床标本分离的非重复CREC菌株共计33株,同时收集相应患者性别、年龄及住院科室等基本临床资料。CREC的判定标准为菌种鉴定为大肠埃希菌且亚胺培南最低抑菌浓度(minimal inhibitory concentration, MIC)值≥4μg/ml和/或厄他培南的MIC≥2μg/ml[7]。药敏试验质控菌株及PCR阴性对照菌株均为大肠埃希菌ATCC25922。部分PCR阳性对照菌株为本实验前期测序确证并保存的临床菌株。
1.2 仪器与试剂 Microflex-LT型质谱分析仪(德国BRUKER公司),VITEK-2型细菌药敏检测仪(法国BioMérieux公司),CHEF Mapper XA型脉冲场凝胶电泳仪(美国Bio-Rad公司),Biometra型PCR仪(德国Analytikjena公司),Tanon1600型凝胶成像分析系统(上海天能科技有限公司)。Agarose D-5琼脂糖凝胶、Xba I内切酶(Takara公司),药敏纸片(英国Oxoid公司),多黏菌素B药物标准品(上海源叶公司),多黏菌素B药敏检测(MIC法)试剂(温州康泰公司),所有PCR引物由上海生工公司合成。
1.3 方法
1.3.1 细菌鉴定、药敏检测及碳青霉烯酶表型分析:应用基质辅助激光解析电离飞行时间质谱(ma
trix-assisted laser desorption ionization-time of flight mass spectrometry,MALDI-TOF MS)进 行 菌 种 鉴定;应用VITEK-2药敏分析仪及配套药敏卡进行药敏检测,折点参照CLSI 2020版标准[7];应用微量肉汤稀释法进行多黏菌素B的药敏检测,折点参照EUCAST 2020版标准[8];联合碳青霉烯灭活(modified carbapenem inactivation method, mCIM)及EDTA碳青霉烯灭活(EDTA- carbapenem inactivation method, eCIM)试验分析CREC菌株碳青霉烯酶表型[7]。
1.3.2 碳青霉烯耐药基因及mcr系列基因检测:提取待测菌株DNA模板,应用PCR筛检待测菌株常见碳青霉烯酶基因(blaKPC,blaNDM,blaIMP,blaVIM,blaOXA-48)及mcr系列基因(mcr-1~mcr-9),引物序列见表1及扩增方法参考文献[9-11]。PCR产物琼脂糖凝胶电泳后观察结果,阳性扩增产物送上海生工测序后应用GenBank NCBI数据库比对分析。

表1 耐药基因PCR检测引物
1.3.3 脉冲场凝胶电泳(pulsed-field gel electrophoresis, PFGE)分析:取沙门菌H9812及mcr-9阳性CREC菌株单个菌落接种于LB肉汤,37℃振荡增菌6h后富集菌体,用低熔点琼脂糖凝胶制作包埋胶块并置于蛋白酶K溶液中50℃水浴18h。胶块多次清洗后,置于Xba I内切酶体系37℃水浴4h。电泳条件参考文献[12]。电泳胶块染色成像后用Bio-Numerics软件分析,PFGE条带差异大于7条为不同pulsotype型[13]。
1.3.4 多黏菌素诱导分析:参考文献[14]报道进行,待测mcr-9阳性CREC菌株用M-H肉汤制备麦氏浓度为1.0的菌悬液,分别加入多黏菌素B使得体系中药物浓度为1/2倍MIC值。37℃振荡培养6h后富集菌体,用无菌生理盐水洗涤3次后用无菌生理盐水配置麦氏浓度为0.5的菌悬液,用于微量肉汤稀释法检测待测菌对多黏菌素的MIC值。上述试验重复三次。
1.4 统计学分析 应用Shapiro-Wilk法进行正态性检验,符合正态分布的计量资料(患者年龄)以均数±标准差(±s)表示。计数资料以率或构成比表示。基本临床资料及药敏检测结果录入WHONET5.6软件进行统计分析。
2 结果
2.1 菌株临床分布 33株CREC分离自尿液标本(10株,30.3%)、痰液标本(8株,24.2%)、脓液及分泌物标本(6株,18.2%)、血液标本(5株,15.2%)、腹腔积液标本(2株,6.1%)、胆汁标本(1株,3.0%)、导 管 尖 端(1株,3.0%)。CREC感染临床患者以男性为主(63.6%),患者年龄25~87(62.4±15.0)岁。患者所在临床科室主要为泌尿外科(5例,15.2%)、重症监护病房(4例,12.1%)、血液内科(4例,12.1%)、普外科(3例,9.1%)、急诊外科(3例,9.1%)等。
2.2 体外药敏结果 见表2。CREC菌株对头孢菌素类及β-内酰胺酶抑制剂类抗生素耐药率均为100.0%,对碳青霉烯类抗生素的耐药率为93.9%~100.0%,对左氧氟沙星的耐药率为84.8%,对阿米卡星、替加环素及多黏菌素B的耐药率分别为24.1%,3.4%及0.0%。
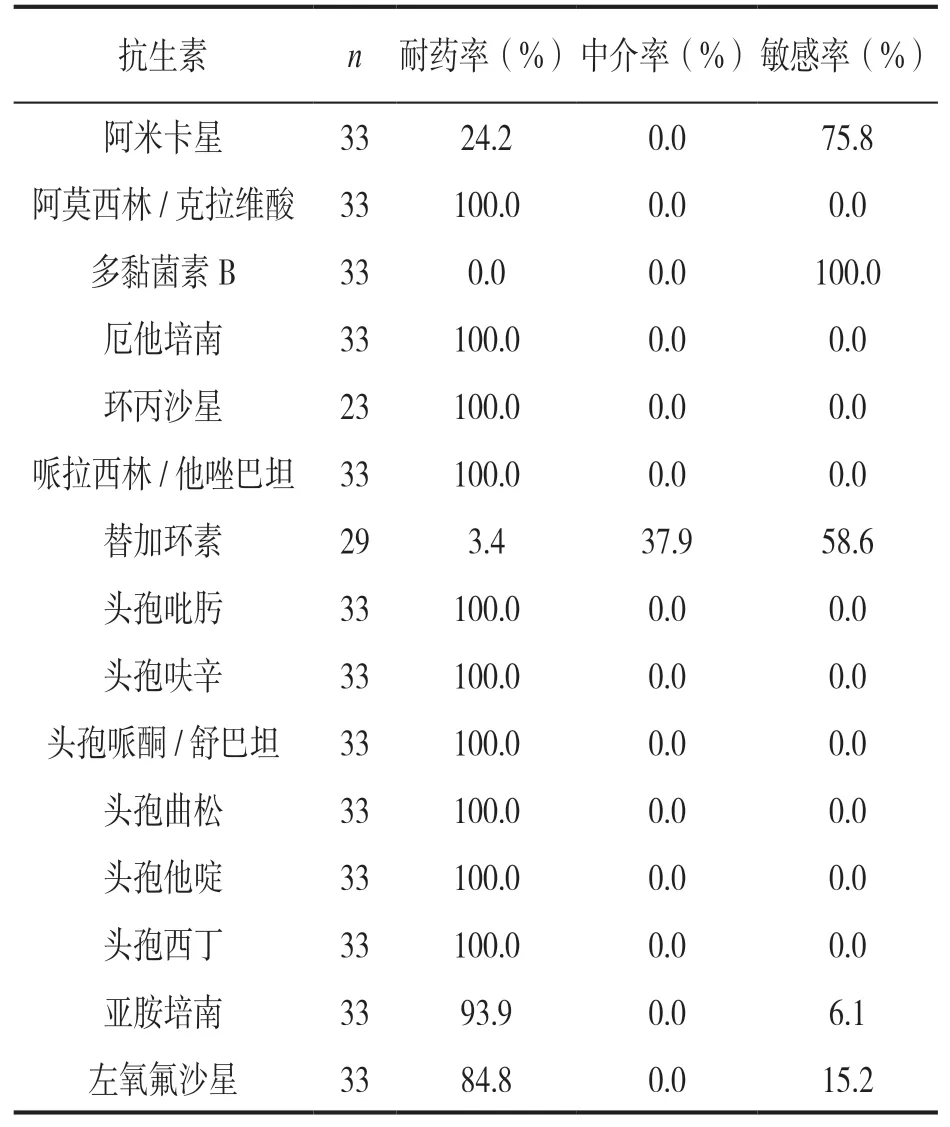
表2 CREC菌株对抗生素的体外药敏结果
2.3 碳青霉烯酶表型及基因型检测 联合mCIM和eCIM试验检测显示,31株CREC(93.9%)产碳青霉烯酶,改良碳青霉烯类失活法( mCIM)试验阳性菌株8株,EDTA-碳青霉烯类失活法(eCIM)试验阳性菌株23株。PCR及测序结果检测显示,mCIM阳 性CREC均 携 带blaKPC-2基 因(8株,24.2%);eCIM阳性CREC均携带blaNDM基因(23株,69.7%),其中blaNDM-5阳性12株、blaNDM-1阳性10株、blaNDM-3阳性1株。部分PCR产物电泳结果见图1A,B。

图1 PCR产物凝胶电泳图(A. blaKPC基因;B. blaNDM基因;C. mcr-9基因)
2.4 mcr基因检测及多黏菌素B诱导耐药特征 PCR检测显示,所有菌株的mcr-1~mcr-8基因均为阴性,有3株(9.1%)CREC菌株(试验编号:CR_EC12,CR_EC16,CR_EC26)携 带mcr-9基 因,见图1C;且3株CREC菌株均携带blaNDM基因,见表3。PFGE结果显示三者间条带差异大于7条,提示为不同pulsotype型,菌株间无同源性,见图2。

表3 多黏菌素B诱导耐药结果
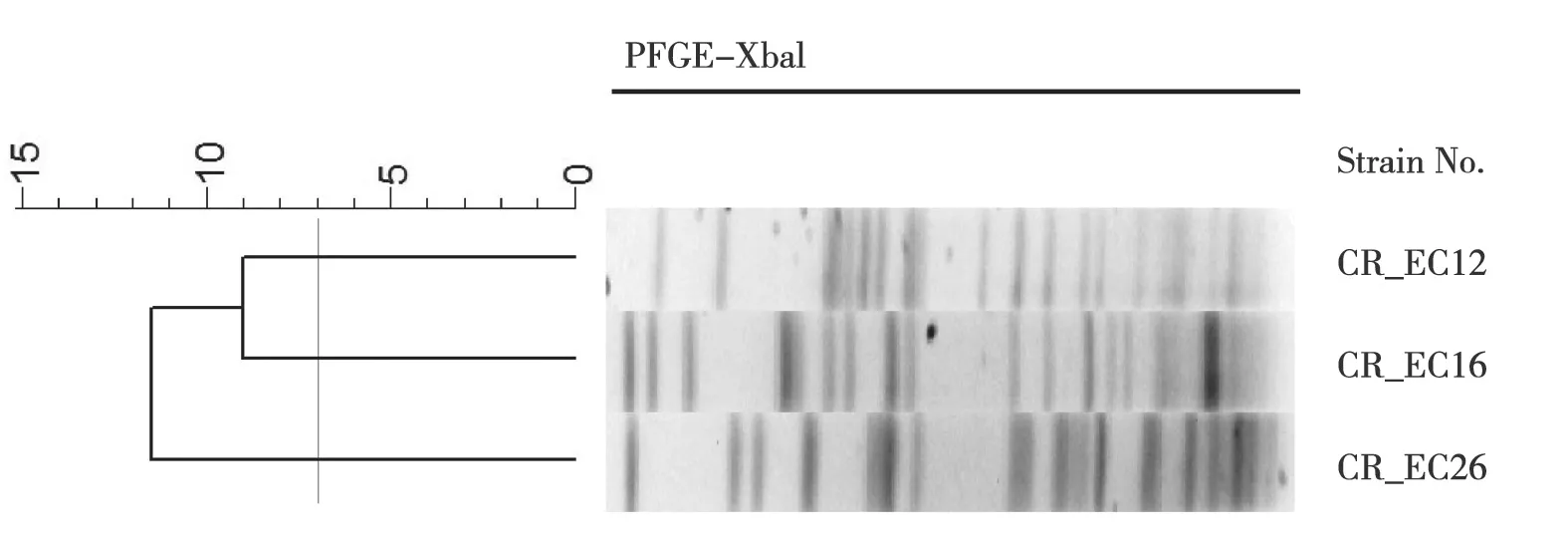
图2 三株mcr-9阳性CREC菌株的PFGE聚类分析图
经多黏菌素B(1/2倍MIC浓度)预处理6h后,3株mcr-9阳性CREC对多黏菌素B的MIC值出现不同程度的升高,CR_EC12号菌株原始MIC值为1μg/ml,诱导后MIC值为16~32μg/ml;CR_EC16号菌株原始MIC值为1μg/ml,诱导后MIC值为4~8μg/ml;CR_EC26号菌株原始MIC值为0.5μg/ml,诱导后MIC值为1~2μg/ml。
3 讨论
碳青霉烯酶是一类能够水解亚胺培南或美罗培南的β-内酰胺酶,根据Ambler分子分类可分为A,B,D三类。新德里金属酶(new delhi metallo β-lactamase,NDM)属于B类金属β-内酰胺酶,可介导菌株产生碳青霉烯耐药表型[4]。一项全国性的分子流行病学研究表明,我国临床分离的CREC菌株主要产NDM型碳青霉烯酶[15]。本研究中,69.7%的CREC菌株携blaNDM基因,与上述报道基本一致。进一步测序结果显示,blaNDM基因亚型以blaNDM-5为主,其次为blaNDM-1。研究表明,NDM-5与NDM-1相比存在两个氨基酸位点(Val88Leu及Met154Leu)的差异,使得其对碳青霉烯类抗生素具有更强的水解作用[16]。在我国blaNDM-5基因多由IncX3质粒携带,不仅在临床菌株中被检出,在社区环境及动物来源菌株中也陆续被报道,提示其存在广泛的播撒,同时该类型质粒常携带多种耐药基因,可介导菌株获得多重耐药表型[16]。本研究中,CREC菌株对临床常用的抗生素耐药率高,主要分离自尿液、痰液及血液标本,临床医师在抗感染治疗时应根据药敏结果并结合感染部位合理使用抗生素。
多黏菌素是由多黏类芽孢杆菌产生的一种多肽类抗生素,有A,B,C,D和E五种,目前有多黏菌素B和多黏菌素E在临床上使用。尽管存在肾毒性和神经毒性,但是在目前临床多重耐药菌检出率日益攀升的现状下,多黏菌素类药物已经成为抗感染治疗的最后一道防线[5]。因此,当质粒介导的多黏菌素B耐药基因mcr被发现后,立即引起了全球的广泛关注。近年来,mcr基因的变异体(mcr-1~mcr-9)在世界各地被不断报道,分布最广泛的是mcr-1和mcr-9基因[6]。与其它mcr基因不同,携带mcr-9基因的菌株多表现为多黏菌素B敏感的体外药敏表型,但当菌株预先暴露于多黏菌素B药物环境中,mcr-9基因的表达量就会升高,进而产生诱导耐药表型[14,17]。本研究中的3株mcr-9阳性CREC菌株经过1/2倍MIC浓度的药物预处理后,其对多黏菌素B的MIC值均出现了上升,进一步证实了mcr-9阳性菌株的多黏菌素诱导耐药特征。
另一方面,虽然本研究中的3株mcr-9阳性CREC均同时携带blaNDM,但PFGE分析显示菌株间无同源性,提示本研究中mcr-9基因不是由菌株克隆播撒导致的传播。相关研究表明,mcr-9基因主要由IncHI2型质粒携带,这种质粒往往携带大量促进其自身水平转移的基因元件,进一步加速了mcr-9基因在临床菌株中的隐匿性播撒[18-19]。因此,本研究中的3例mcr-9阳性菌株也可能与这种质粒的水平传播相关。目前,头孢他啶/阿维巴坦、替加环素和多黏菌素是临床治疗碳青霉烯类抗生素耐药肠杆菌感染的选择,由于阿维巴坦不能抑制NDM型碳青霉烯酶,因此在治疗blaNDM阳性细菌所致重症感染时,多黏菌素B往往成为临床首选的抗生素[20]。如果mcr-9基因在临床菌株中广泛播撒,而常规的体外药敏试验又不能及时发现其耐药表型,则会给临床抗感染治疗带来较大风险。
综上所述,本研究分析了本地区临床分离CREC菌株的耐药性及碳青霉烯酶携带特征,并初步检测了mcr系列基因的携带情况。值得注意的是,虽然所有菌株对多黏菌素B的MIC值均≤2μg/ml,但仍然有9.1%的CREC菌株携带mcr-9基因,并且mcr-9阳性菌株均表现为多黏菌素的诱导耐药特征,这一特殊的耐药表型需要临床和微生物实验室高度重视。由于本研究纳入的菌株数量较少,且为单中心来源,因此研究结果存在一定局限性,后续将继续增加研究菌株的数量及来源,同时对mcr-9阳性菌株进行全基因组测序,深入菌株的分子型别及携带mcr-9质粒的分子特征,为临床多重耐药菌的防控提供参考数据。

