hsa_circ_0006950调控miR-124-3p/EZH2轴促进胰腺癌细胞增殖与迁移的机制研究
王军堂,齐普良,张金刚,阿吉德,何 婧
( 1.青海省人民医院a.急诊外科;b.普外科,西宁 810007;2.武警青海省总队医院内二科,西宁 810014)
关键字:胰腺癌;hsa_circ_0 006950;微小核糖核酸-124-3p;EZH2;增殖;克隆形成;迁移
胰腺癌(pancreatic cancer,PC)是临床常见的消化道恶性肿瘤,恶性程度高、预后差,患者5年生存率不到5%[1]。由于胰腺位置隐蔽,早期胰腺癌很难被发现,多数患者确诊时已是晚期,加之病死率极高,因此被称为“癌中之王”[1-2]。目前越来越多的研究发现,非编码RNA在对疾病的调控中发挥重要作用,其中包括环状核糖核酸(circular RNA,circRNA)和微小核糖核酸(microRNA,miRNA)[3]。circRNA是通过部分基因外显子环化而成,由于没有3'-尾巴和5'-帽子结构,进而避免了RNA酶消化,可稳定存在于细胞内,因此circRNA可被用作肿瘤的诊断探针[3-4]。相关研究发现,circRNA可通过靶向吸附 miRNA来调控基因表达,被称为“miRNA海绵分子”,在癌症相关的各种生物学过程中充当重要调节剂,如细胞的增殖、侵袭和转移等,进而影响疾病进程[5-6]。近年在对PC的研究中发现,circ_03955通过靶向miR-3662/HIF-1α轴促进PC的发生和Warburg效应[7];circ-ciRS-7可通过吸附miR-7调控 EGFR/STAT3 信号轴,促进胰腺癌增殖[8]。越来越多的circRNA在胰腺癌中被探究证实异常表达,参与了胰腺癌的恶性发展进程。因此对circRNA的研究或许能揭示胰腺癌的发生机制,为胰腺癌的防治提供新的理论基础和治疗靶点。本次研究的circRNA为hsa_circ_0006950,源自基因TRPS1,也被命名为circ-TRPS1。hsa_circ_0006950是课题组前期通过高通量筛选出来的一个表达异常的circRNA,发现其在胰腺癌中表达上调,然其在肿瘤中的具体作用机制尚不清楚,且有关研究报道鲜少。所以本研究通过体外细胞实验拟探究了hsa_circ_0006950的分子属性及其在胰腺癌中的作用机制,希望为胰腺癌的研究提供新的生物靶标。
1 材料与方法
1.1 研究对象 胰腺癌细胞系PANC-1,AsPC-1,Capan-2,SW1990,BXPC-3和人正常胰腺导管上皮细胞系HPDE6-C7均由中国科学院上海细胞提供,培养在DMEM培养液中,其中含有10g/dl胎牛血清,37℃培养在含5ml/dl CO2细胞培养箱中。选取2021年5月~8月青海省人民医院病理科留存的20例胰腺癌患者癌组织及对应癌旁正常组织样本,组织标本经病理确诊后保存于低温液氮中;术前未接受任何相关放化疗及新辅助治疗,未并发其他恶性肿瘤。
1.2 试剂及仪器 DMEM培养液,胎牛血清,0.25g/dl胰酶(美国Gibco公司);Lip2000转染试剂盒(美国Thermo Fisher公司);miR-124-3p inhibitor抑制剂,miR-124-3p mimic模 拟 物,hsa_circ_0006950干扰siRNA载体,EZH2过表达载体(上海吉玛基因生物);CCK-8试剂盒(上海碧云天);TRIzol试 剂 (Invitrogen, Carlsbad, CA, USA);RNA逆 转录试剂盒(Aidlab,Beijing,China);酶标仪(美国BioTek公司);7500 Fast Real-Time PCR仪(瑞士Roche公司);凝胶成像分析系统(美国Azure公 司);Transwell小 室,Matrigel基 质 胶(美 国Corning公司);EZH2-3'UTR-wt野生型和3'UTRmut突变型,hsa_circ_0006950-3'UTR-wt野生型和3'UTR-mut突变型荧光质粒(南京科佰生物科技有限公司设计合成)。
1.3 方法
1.3.1 细胞转染及分组:按照Lip2000转染试剂盒说明书进行转染,将转染片段与Lip2000混和后加入无血清OptiMEM (美国Gibco公司)培养液培养细胞6 h,换成正常的DMEM培养液继续培养转染48 h后进行后续实验。分组:转染miR-124-3p inhibitor为miR-124-3p抑制组(inhibitor组),转染miR-124-3p mimic为miR-124-3p过表达组(mimic组),转染hsa_circ_0006950干扰siRNA载体为hsa_circ_0006950低表达组(si-circRNA组),转染EZH2过表达载体为EZH2过表达组(EZH2组)。
1.3.2 实时荧光定量PCR(qRT-PCR)实验:利用TRIzol试剂提取细胞及组织中总RNA,通过逆转录试剂盒逆转录合成cDNA,并以此为模板配置PCR反应体系,利用PCR 仪进行qRT-PCR。反应条件:95℃ 30s;95℃ 15s,72℃ 10s,循环40次。引物序列如下,采用2-ΔΔCt法计算目的基因相对表达。

表1 qRT-PCR反应引物序列
1.3.3 CCK-8实验:取对数生长期待测细胞重悬,接种于96孔板,37℃,5ml/dl CO2孵育待细胞贴壁后,每孔加入10 µl CCK-8液孵育继续孵育0,24,48和72h,吸除培养基,酶标仪上在450nm处检测吸光度值(A值),绘制细胞增殖曲线图,每孔设3个复孔,实验重复3次取平均值。
1.3.4 克隆斑点形成实验:取对数生长期各组细胞,胰酶消化,以每孔200个细胞铺于6孔板,每孔设3个复孔,37℃,5ml/dl CO2培养至出现肉眼可见的克隆时收集细胞,4g/dl多聚甲醛固定20 min,0.1g/dl结晶紫染色30 min,观察拍照分析。
1.3.5 Transwell细胞迁移实验:根据Transwell细胞迁移检测试剂盒说明书进行,无血清DMEM培养液重悬细胞至浓度1×105/ml,在Transwell小室上室加入细胞悬液,下室加入含15ml/dl胎牛血清的DMEM培养液500 μl,培养24 h,取出小室,吸干上室培养液,4g/dl多聚甲醛固定30 min,0.05g/dl结晶紫染色30 min,擦除上室多余细胞,晾干,倒置光学显微镜下观察细胞并计数。
1.3.6 双荧光素酶报告基因实验:取对数生长期各组细胞接种到6孔板,将含有miR-124-3p结合位点的hsa_circ_0006950-3'UTR-wt野生型和3'UTRmut突变型荧光质粒及EZH2-3'UTR-wt野生型和3'UTR-mut突变型荧光质粒分别转染至待测细胞中,采用荧光素酶测定系统测量各组细胞荧光素酶活性,实验重复3次取平均值。
1.3.7 蛋白免疫印迹(Western blot)实验:取转染后各组待测细胞加入细胞裂解液置于冰上裂解,提取总蛋白,BCA法检测其浓度;取蛋白样品约20mg,通过SDS-PAGE凝胶试剂盒进行电泳分离,转膜,5g/dl脱脂牛奶封闭2 h,洗膜3次,加入相应一抗,4 ℃孵育过夜;次日加入二抗,孵育2 h,洗膜3次,ECL化学显色,凝胶成像系统观察拍照。
1.3.8 生物信息学分析:circRNA和miRNA之间的靶向作用关系通过Circular RNA Interactome网站进行预测。miRNAs和mRNAs之间的靶向作用关系利用TargetScan (http://www.targetscan.org/) 网站进行预测。
1.4 统计学分析 采用SPSS 20.0统计软件进行统计分析,实验数据用均数±标准差(±s)表示,两组间差异比较采用独立样本t检验,癌组织及癌旁正常组织中差异比较采用配对t检验;多组间差异比较采用单因素方差分析,组间两两比较采用LSD检验。P<0.05为差异具有统计学意义。
2 结果
2.1 胰腺癌组织及细胞中hsa_circ_0006950表达检测 qRT-PCR检测发现,20例临床胰腺癌组织及癌旁对应正常组织中hsa_circ_0006950相对表达分别为3.57±0.52和1.01±0.03,差异有统计学意义(t=21.980,P<0.001)。同时检测发现,相对人正常胰腺导管上皮细胞系HPDE6-C7(1.00±0.01),PC细胞PANC-1(7.51±0.62),AsPC-1(5.26±0.45),Capan-2(3.69±0.38),SW1990(3.25±0.32)和BXPC-3(3.86±0.35)中hsa_circ_0006950相对表达均显著上调,差异有统计学意义(F=88.585,P<0.001),提示胰腺癌组织及细胞中hsa_circ_0006950表达显著上调。PANC-1细胞表达上调最为显著,故选择其进行后续研究。
2.2 干扰hsa_circ_0006950抑制PC细胞的增殖、克隆形成及迁移 qRT-PCR检测发现,相比NC
对照组(1.01±0.03),si-circRNA组细胞中hsa_circ_0006950相对表达(0.24±0.02)明显降低,差异有统计学意义(t=36.990,P<0.001),提示干扰hsa_circ_0006950表达的细胞系构建成功,可用于后续实验。CCK-8法、克隆斑点形成实验和Transwell实验检测(见表2)显示:转染sicircRNA组细胞增殖A值、克隆形成率及细胞迁移数目均较对照组明显降低,差异有统计学意义(均P<0.05)。提示干扰hsa_circ_0006950表达能够显著抑制胰腺癌细胞的增殖、克隆形成及迁移。
表2 干扰hsa_circ_0006950对PC细胞增殖、克隆形成及迁移的影响(±s,n=3)
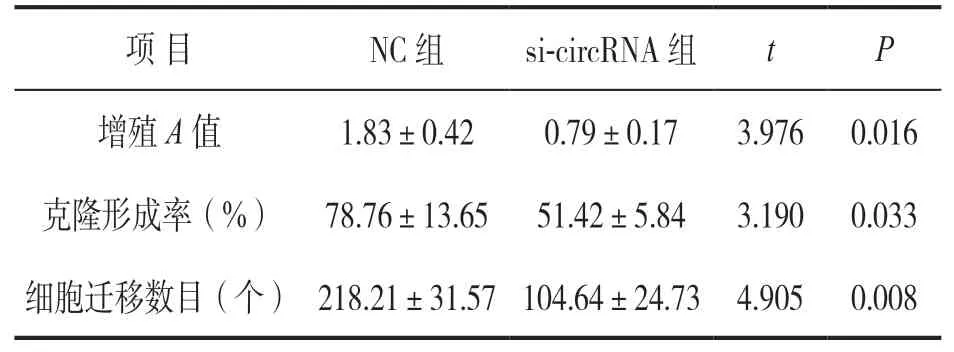
表2 干扰hsa_circ_0006950对PC细胞增殖、克隆形成及迁移的影响(±s,n=3)
?
2.3 hsa_circ_0006950和miR-124-3p靶 向 调 控 关系验证 检索生物信息学数据库发现,miR-124-3p与has_circ_000695'的3'UTR区 存 在 结 合 位点,见图1。推测其可能是hsa_circ_0006950的下游靶点。研究将包含miR-124-3p结合位点在内的hsa_circ_0006950 3'UTR-wt野生型和3'UTRmut突变型荧光素酶报告载体与过表达miR-124-3p mimic片段共转染到 PANC-1细胞中,经双荧光素酶报告基因实验检测显示,转染miR-124-3p mimic组hsa_circ_0006950野生型荧光素酶活性为42.56±3.66,较转染miR-NC组(100.01±6.12)明 显 降 低(t=13.954,P<0.001);而hsa_circ_0006950突变型荧光素酶活性为98.79±4.97,较转染miR-NC组(100.02±5.35)无明显变化(t=0.292,P=0.785),证实miR-124-3p是hashsa_circ_0006950的下游靶基因。

图1 生物信息学数据库检索hsa_circ_0006950和miR-124-3p存在结合位点
进一步通过qRT-PCR检测显示,与NC组相比,转染miR-124-3p mimic组miR-124-3p表达明显升高(t=4.937,P<0.001);转染miR-124-3p inhibitor组miR-124-3p表达明显降低(t=2.338,P<0.001);转 染 干 扰si-circRNA组miR-124-3p表达明显升高(t=7.217,P<0.001);共转染inhibitor后si-circRNA对miR-124-3p表 达 的 促 进作用被逆转(t=2.281,P<0.05),见表3。表明hsa_circ_0006950靶向负调控miR-124-3p。
表3 hsa_circ_0006950和miR-124-3p靶向调控关系验证(±s, n=3)

表3 hsa_circ_0006950和miR-124-3p靶向调控关系验证(±s, n=3)
?
2.4 miR-124-3p对PC细胞增殖、克隆形成及迁移的影响 见表4。细胞实验检测显示,与NC组相比miR-124-3p过表达明显抑制了PC细胞的增殖、克隆形成和迁移(t=5.378,14.317,3.390,均P<0.05);下调miR-124-3p表达则明显促进了细胞的增殖、克隆形成和迁移(t=5.867,6.663,2.523,均P<0.05)。
表4 miR-124-3p对PC细胞增殖、克隆形成及迁移的影响(±s, n=3)

表4 miR-124-3p对PC细胞增殖、克隆形成及迁移的影响(±s, n=3)
?
2.5 miR-124-3p和EZH2靶向调控关系验证 经检索数据库发现,EZH2与miR-124-3p的3'UTR区存在结合位点,见图2A,推测其可能是miR-124-3p的下游靶标。研究将包含miR-124-3p结合位点在内的EZH2 3'UTR-wt野生型和3'UTR-mut突变型荧光素酶报告载体与过表达miR-124-3p mimic片段共转染到PANC-1细胞中,通过双萤光素酶报告基因实验检测显示,转染miR-124-3p mimic组EZH2野生型荧光素酶活性为49.57±5.62,较转染miR-NC组(100.02±8.24)明显降低(t=8.761,P<0.001);EZH2突变型荧光素酶活性为99.02±6.74,较转染miR-NC组(100.01±6.89)无明显变化(t=0.178,P=0.867),证实EZH2是miR-124-3p的下游靶基因。
进 一 步 通 过qRT-PCR和Western blot检 测 显示,与NC组相比,EZH2过表达组EZH2表达明显升高(t=5.391,P<0.001);miR-124-3p过表达组EZH2表达明显降低(t=3.076,P<0.001);在miR-124-3p过表达组共转染过表达EZH2后,EZH2表达被逆转恢复(t=6.890,P<0.001),见图2B和表5。表明miR-124-3p靶向负调控EZH2表达。
表5 miR-124-3p和EZH2靶向调控关系验证(±s, n=3)

表5 miR-124-3p和EZH2靶向调控关系验证(±s, n=3)
注:与NC组相比,***补充值P<0.001;与mimic组相比,补充值# P<0.001。
?

图2 miR-124-3p靶基因的预测及调控关系验证
2.6 miR-124-3p调控EZH2对PC细胞增殖、克隆形成及迁移的影响 见表6。细胞实验检测显示,EZH2过表达明显促进了PC细胞的增殖、克隆形成及迁移能力(P<0.001);在miR-124-3p过表达组共转染过表达EZH2后,miR-124-3p对PC细胞增殖、克隆形成及迁移的抑制作用被逆转(P<0.001),说明过表达EZH2可逆转过表达miR-124-3p对胰腺癌细胞生物学行为的影响。
表6 miR-124-3p调控EZH2对PC细胞增殖、克隆形成及迁移的影响(±s, n=3)

表6 miR-124-3p调控EZH2对PC细胞增殖、克隆形成及迁移的影响(±s, n=3)
?
2.6 hsa_circ_0006950调控miR-124-3p/EZH2参与PC细胞克隆形成及迁移 见表7。克隆形成实验及Transwel实验检测显示,在si-circRNA组细胞中同时下调miR-124-3p或过表达EZH2后,干扰hsa_circ_0006950对细胞克隆形成及迁移的抑制作用被逆转恢复,表明hsa_circ_0006950可能通过靶向下调miR-124-3p表达,从而上调EZH2表达,促进胰腺癌细胞的增殖、克隆形成及迁移,参与胰腺癌的发生发展。
表7 hsa_circ_0006950调控miR-124-3p/EZH2对克隆形成率及迁移的影响(±s, n=3)

表7 hsa_circ_0006950调控miR-124-3p/EZH2对克隆形成率及迁移的影响(±s, n=3)
注:① vs②:t克隆率=4.251, t迁移数目=4.309, 均P<0.01;② vs③:克隆率=4.550, t迁移数目=4.238, 均P<0.01;② vs ④:t克隆率=4.116, t迁移数目=4.403,均P<0.01。
?
3 讨论
近年对分子生物学的研究为肿瘤的诊治探寻了新的方向,发现肿瘤的发生发展过程中非编码RNA发挥重要作用,circRNA能够通过miRNA海绵,RNA结合蛋白等形式作为竞争性内源RNA(ceRNA)参与肿瘤多种生物学行为,使得circRNA和miRNA的研究成为肿瘤相关机制的研究重点和热点[9-10]。越来越多的研究也表明,circRNA/miRNA/mRNA调控系统在包括胰腺癌在内的多种人类恶行肿瘤进展中起着重要的调控作用[11-12],例如肿瘤细胞的增殖、转移及化疗耐药等多个过程。如既往研究发现,circRNA_0005529通过调控miR-527/Sp1轴促进了胃癌的生长和转移[13]。circCDYL调控miRNA-105-5p参与了结肠癌细胞的发生发展[14]。circRNA-UCK2增加TET1通过海绵miRNA-767-5p抑制前列腺癌细胞的增殖 和 侵 袭[15]。circRNA_101237作 为miRNA-490-3p海绵街道MAPK1表达促进了非小细胞肺癌(NSCLC)进展[16]。胰腺癌研究中,circ-PDE8A通过miR-338/MACC1/MET信号轴促进PC侵袭[17];抑制hsa_circ_0000977促进了miR-874-3p表达,进而抑制了PLK1介导的胰腺癌发展[18]。hsa_circRNA_0007334通过作为miRNA海绵促进胰腺癌中MMP7和COL1A1的表达,参与调控癌细胞的增殖、迁移及凋亡[19]。证实circRNA作为miRNA海绵,通过调控miRNA表达并影响miRNA与其靶基因的结合,可引起基因表达失调,诱发肿瘤,是重要的肿瘤研究分子标志物[9,11]。因此积极探究circRNA发挥作用的机制及其途径,对癌症的防治意义显著。
hsa_circ_0006950是研究通过高通量筛选出来的胰腺癌异常表达circRNA,本研究发现,胰腺癌组织及细胞系中hsa_circ_0006950显著上调,下调其表达明显抑制了胰腺癌细胞的增殖、克隆形成及迁移能力。竞争内源性RNA (ceRNA)假说认为,环状RNA,lncRNA可通过与miRNA元件结合来调控基因表达,提供了一种新的转录后调控网络机制[20-21]。研究利用生物信息学分析发现,hsa_circ_0006950下游结合靶点有很多,包括miR-1180,miR-1184,miR-1205,miR-1229,miR-1238,miR-127-5p,146b-3p,miR-192和miR-124-3p等,其中miR-124-3p与hsa_circ_0006950之间的结合位点具有高度保守性。研究表明,miR-124-3p也是重要的肿瘤基因,其表达失调与肿瘤的发生发展有关,证实在众多恶性肿瘤中miR-124-3p是重要的肿瘤抑制基因,对多种肿瘤增殖、迁移具有抑制作用[22-23]。有证据显示,肝癌中miR-124-3p特异性沉默会阻滞细胞周期在G1期,引起肝癌细胞凋亡[24]。XU等[25]报道,鼻咽癌中miR-124-3p靶向STAT3可抑制癌细胞生长和转移。miR-124-3p通过靶向MGAT5调控FGF2/EGFR通路抑制肺腺癌细胞培美曲塞耐药[26]。本研究经荧光素酶报告实验证实miR-124-3p是hsa_circ_0006950的结合靶点,hsa_circ_0006950靶向负调控miR-124-3p表达;同时发现miR-124-3p过表达抑制了胰腺癌细胞的克隆形成及迁移,miR-124-3p下调能够恢复干扰hsa_circ_0006950对胰腺癌细胞增殖、迁移的抑制作用。表明胰腺癌发生发展过程中miR-124-3p作为抑癌基因存在,hsa_circ_0006950可通过靶向调控miR-124-3p表达发挥作用,促进胰腺癌恶行进展。
研究证实,circRNA通过充当ceRNA可调控miRNA表达,miRNA则可通过调控不同靶基因影响疾病进展[11]。miRNA通过与靶mRNA的3’端非翻译区直接作用,在转录后水平调控肿瘤细胞生物学过程,参与肿瘤的发生[10]。基于circRNA/miRNA/mRNA调控网络,本研究利用TargetScan网站预测并经荧光素酶报告实验证实EZH2是miR-124-3p的作用靶点之一。据报道,EZH2作为一种致癌基因,可调节肿瘤细胞增殖、迁移、侵袭等生物学行为,且可调控Wnt,NF-κB/ JAK2/STAT3等多个重要信号通路,被证实在多种癌组织中异常高表达,与肿瘤恶性程度及预后关系密切,是重要的肿瘤预后标志物及治疗靶点[27-28]。而本研究证实,miR-124-3p靶向负调控EZH2,以miR-124-3p为中心三者间存在两两结合位点,即组成了hsa_circ_0006950/miR-124-3p/EZH2靶向调控网络;且证实在干扰hsa_circ_0006950或过表达miR-124-3p条件下,过表达EZH2可以逆转恢复hsa_circ_0006950和miR-124-3p对PC细胞增殖、迁移的抑制作用,提示hsa_circ_0006950在胰腺癌中发挥作用的分子机制可能是通过下调miR-124-3p表达进而上调 EZH2表达来完成,miR-124-3p/EZH2轴在hsa_circ_0006950调控PC发生发展的过程中发挥重要作用。然而肿瘤发生发展机制复杂,其中涉及信号通路的激活或失活,故更具体的作用机制还需进一步研究阐明。
综上,胰腺癌中hsa_circ_0006950表达上调,抑制其表达能够抑制胰腺癌细胞的增殖和迁移,其可能通过靶向下调miR-124-3p表达,进而上调EZH2表达来发挥作用参与PC的发生发展。下调hsa_circ_0006950是一个潜在的胰腺癌防治靶点,对hsa_circ_0006950/miR-124-3p/EZH2轴进一步的研究可能为开发新的PC治疗策略提供基础。

