CircRNA-100395基因通过启动子区甲基化调控miRNA-136-5p/Smad3轴促进前列腺癌细胞增殖及侵袭的机制研究
张士保,朱斐煜,谢瑞玉,尚宪平
(1.来安家宁医院检验科,安徽滁州 239200;2.滁州市第一人民医院检验科,安徽滁州 239200)
近年,我国前列腺癌(prostate cancer)发病率呈逐年上升趋势,目前已成为泌尿科最常见的恶性肿瘤之一[1-2]。尽管通过手术及术后辅助放化疗等使得前列腺癌的临床治疗效果取得了较大的突破,但大多患者术后五年生存率仍较低,总体预后较差[3]。故深入研究前列腺癌发生机制,找寻新的有效的分子标志物,对前列腺癌的临床诊治具有指导意义。环状核糖核酸(circular RNAs, CircRNAs) 是一类具有高癌症特异性表达的非编码RNA,目前已成为肿瘤研究领域的热点[4]。CircRNA-100395是位于chr1:173726114~17374498的一种CircRNA,由宿主基因KLHL20 mRNA中的四个外显子拼接而成[5]。既往大量研究发现,CircRNA-100395在乳腺癌、甲状腺乳头状癌、卵巢癌等多种肿瘤中呈低表达,上调其表达后可以抑制肿瘤细胞的增殖、侵袭及迁移能力,有望成为癌症的新治疗靶点[6-8]。但目前缺乏CircRNA-100395调控前列腺癌发生发展的分子作用机制相关研究,尤其是在前列腺癌细胞中CircRNA-100395基因启动子区是否呈异常甲基化及其甲基化状态是否对前列腺癌细胞生物学行为具有调控作用还有待深入探讨。因此,本研究旨在探索前列腺癌细胞中CircRNA-100395基因启动子区甲基化状态对自身表达水平的影响,并阐明CircRNA-100395基因去甲基化对前列腺癌细胞增殖、侵袭的影响及相关分子生物学作用机制。
1 材料与方法
1.1 研究对象 从中国科学院细胞库购买1株人正常前列腺上皮细胞(RWPE)和3株前列腺癌细胞系(LNCap,PC3和DU145)作为研究对象。
1.2 仪器与试剂 胎牛血清,DMEM培养液,胰蛋白酶(美国Gibico公司);RNA提取盒,RNA逆转录试剂盒(北京全式金生物技术有限公司);CCK-8试剂盒(上海碧云天生物技术有限公司);Smad3,p- Smad3多 克 隆 抗 体(美 国Abcam公司);CO2细胞培养箱(德国Hera cell 150公司);Transwell 小室(美国Corning公司);CircRNA-100395-3'UTR-wt野生型和3'UTR-MUT突变型荧光质粒,miRNA-136-5p mimic模拟物(广州锐博生物科技有限公司)。
1.3 方法
1.3.1 细胞培养:RWPE,LNCap,PC3和DU145细胞用含100 ml/L胎牛血清标准型培养液在37 ℃,标准 CO2孵育箱中培养,待细胞长至融合度为80%~90%时,加入含2.5 mg/ml胰酶的胰蛋白酶溶液1 ml进行消化传代。CircRNA-100395-AZA(CircRNA-100395去甲基化,去甲基化药物AZA处理细胞),CircRNA-100395-NC(CircRNA-100395去甲基化对照,不做甲基化处理),miRNA-136-5p-mimic(miRNA-136-5p过表达,转染mimic模拟物),miRNA-136-5p-NC(miRNA-136-5p过表达对照,不做转染处理)。
1.3.2 甲基化特异性聚合酶链反应(methylatioin specific polymerase chain reaction, MSP)检测CircRNA-100395基因启动子区甲基化状态:根据DNA试剂盒提取细胞系总DNA,紫外分光光度计检测其纯度待满足实验要求后,采用重亚硫酸盐进行DNA转化处理。后将转化后产物进行PCR扩增,反 应 条 件:94℃ 5 min;94℃ 30 s,58℃ 30 s,72℃ 30 s,40个循环。PCR产物经琼脂糖凝胶电泳溴化乙锭染色后于紫外线照射下直接观察并拍照。CircRNA-100395基因甲基化PCR引物序列为F: 5'-GGTTTTAAAAGTCGGTGTTTATTC-3',R: 5'-AACTACAACCACTCCGACGTA-3',长度125bp;非甲基化引物序列F: 5'-GGGTTTTAAAAGT TGGTGTTTATTT-3',R: 5'-AACAACTACAACCAC TCCAACATA-3',长度132bp。
1.3.3 PCR检 测CircRNA-100395 mRNA 表 达 水平:采用Trizol法提取细胞总RNA,用紫外吸光光度计测定其纯度,根据反转录试剂盒逆转录合成cDNA,并以此为产物进行RT-PCR扩增,扩增体系为25 µl,PCR条件:94 ℃ 5 min;94℃ 40 s,40℃40 s,72℃ 1 min,循环35次,行荧光定量PCR,以U6为内参,采用2-ΔΔCt相对定量法计算目的基因相对表达,PCR引物序列,CircRNA-100395:F: 5'-GC TGTGCAGTATATCAGGACA-3',R: 5'-CATT GGTCTGTGGATCATATC-3',长度190 bp;U6:F: 5'-GTCCGCGTGCTCGCTTCGGCAGC-3',R:5'-GTGCGTGTCGTGGAGTC-3',长度160bp。
1.3.4 CircRNA-100395基因去甲基化方法:采用浓度为3 μmol /L的去甲基化药物5-氮杂-2'脱氧胞苷(AZA)处理LNCap细胞72 h,检测AZA处理前后前列腺癌细胞系中CircRNA-100395表达水平。
1.3.5 CCK-8法检测LNCap细胞增殖能力:将AZA处理后的LNCap细胞及对照组细胞消化后种于96孔培养板中,每孔加入100 μl培养液,在37℃,标准CO2条件下常规培养至细胞贴壁生长,弃掉培养液,每孔加入5 μl的CCK-8溶液继续孵育4 h,用酶标仪在450 nm处测定各孔的吸光度值(A),每组5个复孔,取平均值。
1.3.6 Transwell实 验 检 测LNCap细 胞 侵 袭 能力:在Transwell上室加入无血清培养液稀释后的Matrigel基质胶溶液80 μl,室温放置1 h使其形成一层基质膜,分别将400 μl无胎牛血清培养液重悬的AZA处理的LNCap细胞及对照组细胞接种于小室上层,将Transwell培养小室置入24孔培养板中,小室的下层加入含胎牛血清的培养液600 μl,培养24 h后将小室取出,弃去培养液,将上层未侵袭的细胞小心擦去,下层细胞用PBS洗涤2次,经多聚甲醛固定,加入0.02 g/ml的结晶紫染液0.5ml进行染色,倒置晾干,光学显微镜下随机观察5个视野(×200) ,计数染色的细胞数,即为侵袭细胞数。
1.3.7 CircRNA-100395靶 向miRNA预 测:通 过检索生物信息学数据库(Starbease 3.0)预测与CircRNA-100395存在结合位点的下游靶miRNA基因,探究两者的靶向结合关系。
1.3.8 荧光素酶基因报告实验:应用Lipo3000进行CircRNA-100395野生型(WT)/突变型(MUT)质粒与miRNA-136-5p双转染,转染48 h后弃去培养液,加裂解液进行充分裂解,然后在荧光光度计中检测荧光酶活性强弱,证实 CircRNA-100395与miRNA-136-5p 之间的靶向关系。
1.3.9 Western blot检测LNCap细胞中Smad3和p-Smad3蛋白表达:收集AZA处理前后LNCap细胞加入RIPA裂解液提取总蛋白,采用BCA试剂盒检测蛋白浓度;取20 mg蛋白样品加入上样缓冲液,沸水浴加热10 min,冷却至室温后进行蛋白电泳,电泳条件为:浓缩胶80 V恒压,分离胶120 V,待条带跑至距分离胶底部3 cm处时停止电泳,转移到聚偏二氟乙烯膜,室温封闭 60 min,PBS洗膜后加入Smad3和p-Smad3一抗4℃孵育过夜,次日加入二抗,室温孵育2 h,PBS漂洗三次后即可在凝胶成像仪观察拍照,并采用Image-J 软件分析蛋白相对表达。
1.4 统计学分析 采用SPSS 20.0软件进行实验结果分析,所有计量数据均采用均数±标准差(±s)表示,两组间比较采用独立样本t检验,多组间比较采用one-way ANOVA分析,组间两两比较采用LSD-t检验。P<0.05为差异有统计学意义。
2 结果
2.1 前列腺癌细胞系中CircRNA-100395基因启动子区甲基化状态 见图1。MSP实验结果显示,CircRNA-100395基因在RWPE细胞中呈非甲基化状态,而在LNCap,PC3及DU145细胞中呈高甲基化状态。

图1 CircRNA-100395在前列腺癌细胞系中甲基化状态
2.2 CircRNA-100395在前列腺癌细胞系中表达及AZA去甲基化处理LNCap细胞后CircRNA-100395表达水平 RT-qPCR结果表明,CircRNA-100395在LNCap,PC3及DU145细胞中的表达水平分别为0.39±0.08,0.65±0.14,0.62±0.10,明 显 低于RWPE细胞中表达水平(1.12±0.15),差异有统计学意义(F=42.076,P<0.001),其中以LNCap细胞中表达最低,故选择该细胞进行后续实验。进一步发现经AZA去甲基化处理后,LNCap细胞中CircRNA-100395表达水平为1.02±0.17,较未处理的LNCap细胞(0.42±0.05)明显升高,差异有统计学意义(t=5.808,P<0.01),提示CircRNA-100395在前列腺癌细胞中的表达水平可 能与基因启动子区异常甲基化有关。
2.3 CircRNA-100395基因去甲基化对LNCap细胞增殖的影响 见表1。CCK-8法检测结果表明,AZA处理后LNCap细胞各个时间点A值均较处理前明显下降,差异有统计学意义(t=8.764~12.970,均P<0.001),说明CircRNA-100395基因去甲基化可抑制LNCap细胞增殖。
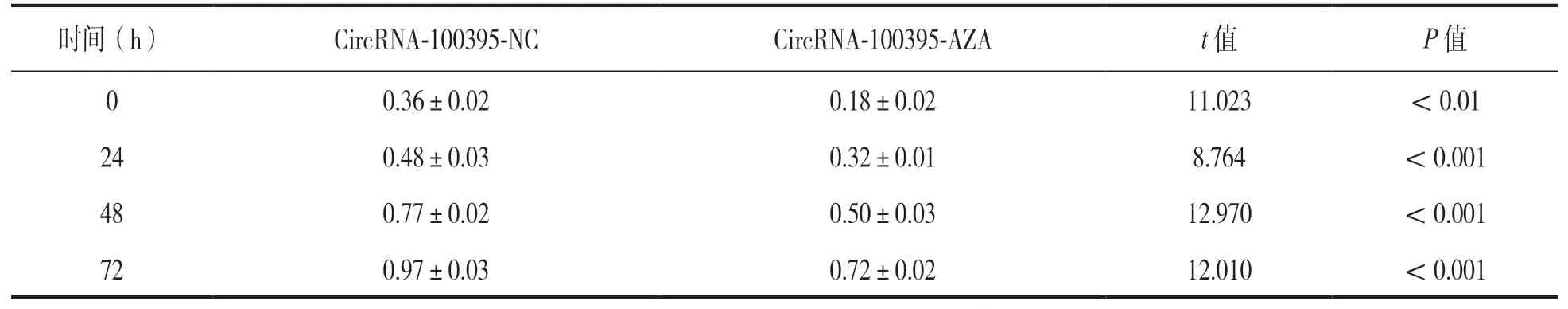
表1 不同时间点细胞吸光度(A)值比较(x ± s)
2.4 CircRNA-100395基因去甲基化对LNCap细胞侵袭的影响 Transwell侵袭实验表明,未经AZA处理前LNCap细胞穿膜数为95.34±11.26个,AZA处理后细胞穿膜数为48.95±6.87个,差异有统计学意义(t=6.092,P<0.01),说明CircRNA-100395基因去甲基化可抑制LNCap细胞的侵袭。
2.5 CircRNA-100395与miRNA-136-5p的 靶 向 调控关系 见图2,表2。检索生物信息学数据库发现,miRNA-136-5P与CircRNA-100395存在结合位点。双荧光素酶基因报告显示,miRNA-136-5P过表达明显降低了CircRNA-100395野生型质粒的荧光素酶活性,差异有统计学意义(P<0.01);而对CircRNA-100395突变型质粒的荧光素酶活性无明显影响,差异无统计学意义(P>0.05),说明miRNA-136-5p可以与CircRNA-100395相结合,其可能为CircRNA-100395的下游作用靶点。
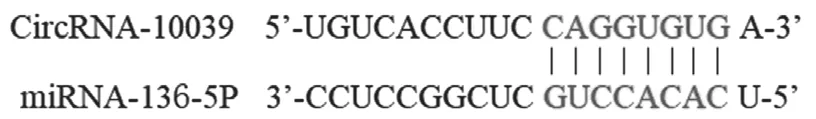
图2 生物信息学预测CircRNA-100395与miRNA-136-5p结合位点

表2 miRNA-136-5p过表达对CircRNA-100395野生型质粒荧光素酶活性的影响
2.6 CircRNA-100395与 miRNA-136-5p表达关系qRT-PCR检测发现,去甲基化处理前LNCap细胞 中CircRNA-100395和miRNA-136-5p表 达 水平 为0.39±0.08,0.87±0.15;经AZA处 理 后CircRNA-100395与 miRNA-136-5p表达水平分别为1.02±0.17,0.35±0.08,处理前后对比差异均有统计学意义(t=5.808,5.298,均P<0.01)。进一步证实miRNA-136-5p与CircRNA-100395表达呈负向调控,且与基因启动子甲基化状态有关。
2.7 CircRNA-100395,miRNA-136-5p对Smad3蛋白表达的影响 Western blot检测结果表明,AZA去甲基化处理后Smad3(1.27±0.05 vs 1.00±0.02)和p-Smad3(1.36±0.05 vs 1.01±0.01)蛋 白 表 达明显升高,差异有统计学意义(t=7.394,11.889,均P<0.01);而miRNA-136-5p过 表 达 抑 制了Smad3(0.82±0.07 vs 1.02±0.02)和p-Smad3(0.66±0.11 vs 1.01±0.02)蛋白表达,差异有统计学意义(t=4.996,5.422,均P<0.01),提示CircRNA-100395与miRNA-136-5p均可调控前列腺癌细胞中Smad3蛋白的表达。
3 讨论
前列腺癌的病因及发病机制目前还未完全阐明,但随着分子生物学的深入研究,越来越多的学者发现,前列腺癌的发生发展可能与多种基因的异常表达密切相关,其中CicrRNA被认为是具有调控基因表达的内源性RNA分子[9-10]。CircRNA-100395作为一种新型的CicrRNA,多项研究表明其异常表达在肿瘤的恶性演变中发挥着重要调控作用。如CHEN等[11]研究发现,肺癌组织中CircRNA-100395表达降低,与肺癌TNM分期和淋巴转移呈负相关,CircRNA-100395表达较高的患者往往具有更好的术后无病生存时间;同时细胞实验也证实 CircRNA-100395过表达可显著抑制肺癌细胞增殖,阻止细胞周期进程并减少了体外细胞迁移和侵袭。CHENG等[12]探索发现,CircRNA-100395过表达通过调节miR-142-3p信号通路可抑制胃癌细胞的增殖、侵袭和迁移,促进细胞凋亡,可能是胃癌的潜在治疗靶点。CHEN等[13]研究发现,肝癌细胞中 CircRNA-100395表达上调可以抑制细胞增殖,诱导细胞凋亡,通过沉默EMT通路并降低迁移和侵袭能力。以上结果均表明,CircRNA-100395通过扮演抑癌基因角色参与调控多种人类肿瘤的发生发展,可作为新的肿瘤研究重要靶点。因此研究CircRNA-100395在前列腺癌细胞中的表达状态及其对癌细胞生物学行为的影响意义显著。
近年越来越多研究表明,CircRNA-100395异常表达与恶性肿瘤的发生发展关系密切,但导致其异常表达发挥作用的原因尚不明确,部分学者认为可能与基因表观遗传修饰有关[14]。DNA甲基化是肿瘤细胞表观遗传学改变的重要形式,最常发生的区域为启动子区域,该区域甲基化异常修饰可导致基因转录受到抑制,引起RNA和蛋白表达水平下降,且发现基因启动子区DNA甲基化是基因失活的重要原因之一,也可使抑癌基因功能丧失[15]。张雪梅等[16]研究也表明,多种恶性肿瘤中均伴随有基因启动子区处于异常高甲基化的现象,该现象可明显抑制某些抑癌基因的转录过程,诱导基因转录沉默,促进肿瘤的发生发展。通过DNA甲基化抑制剂促使基因去甲基化,可降低基因甲基化水平,逆转肿瘤细胞的异常甲基化,能够诱导因甲基化引起的抑癌基因重新表达而发挥作用,从而抑制肿瘤的生长[17]。而本研究检测发现,前列腺癌细胞系中CircRNA-100395明显低表达,其启动子区呈高甲基化状态;经采用AZA去甲基化处理后CircRNA-100395表达水平明显恢复,推测CircRNA-100395低表达应是由其基因启动子区异常高甲基化所导致。此外还发现经AZA去甲基化处理后,前列腺癌细胞的增殖和侵袭能力明显受到抑制,这与JEZIORSKA等[18]报道的基因启动子区发生甲基化后,mRNA表达水平降低,恢复其表达后则可抑制肿瘤发生增殖和迁移的结果相吻合。
为明确CircRNA-100395调控前列腺癌的可能分子机制,研究通过双荧光素酶基因报告实验分析 发 现,miRNA-136-5p与CircRNA-100395存 在结合位点,且miRNA-136-5p过表达能够明显降低CircRNA-100395野生型质粒荧光素酶活性,推测其可能为CircRNA-100395的下游作用靶点。此外,有研究发现在多种癌症发生进程中miRNA-136可直接靶向作用于Smad3蛋白,miRNA-136/Smad3轴被认为是癌症的潜在治疗靶向信号通路[19-20]。为了更深入地阐明CircRNA-100395是否可通过miRNA-136/Smad3轴来调控前列腺癌的发生发展,本研究通过Western blot实验验证发现,CircRNA-100395过表达可以显著增加p-Smad3和Smad3蛋白表达,而miRNA-136-5p过表达则可显著降低p-Smad3和Smad3蛋白表达,结合双荧光素酶基因报告结果推测CircRNA-100395可能通过海绵吸附miRNA-136来调控Smad3的表达,进而在前列腺癌中发挥肿瘤调控作用,这一发现为前列腺癌的临床筛查及靶向治疗药物的开发提供理论基础。
综上所述,CircRNA-100395基因启动子区的异常高甲基化抑制了其在前列腺癌细胞中的表达水平,经AZA去甲基化处理后CircRNA-100395表达恢复,并抑制前列腺癌细胞的增殖和侵袭能力,其可能与CircRNA-100395靶向调控miRNA-136-5p/Smad3轴有关。然而研究存在不足之处,本研究为基础细胞体外实验,缺乏临床数据的验证,因此后期还需进一步验证CircRNA-100395在动物模型中的表达水平及分子机制。

