钠平衡紊乱及其治疗进展
钱晓倩 蒋更如
血清钠是维持细胞外液晶体渗透压的主要因素,对细胞内外水平衡发挥重要作用。体液中水、钠总是同时存在,故水、钠代谢紊乱常常合并存在,在临床中十分常见,尤其对于危重症患者,纠正电解质紊乱是危重症救治的基本前提。钠平衡紊乱的发生机制因原发病不同而存在差异,因此需要全面了解机体渗透调节系统。本文简要回顾钠平衡调节的病理生理机制,并主要讨论针对钠平衡紊乱的治疗。
1 钠的平衡
钠平衡取决钠的摄入(饮食或补充液体)和排出(肾脏、胃肠道、出汗和呼吸)。钠离子(Na+)主要分布于细胞内液,在调节有效血管内容量方面发挥主要作用;从生理学角度而言,Na+是影响动脉压的有效动脉血容量(EABV)[1]。EABV调节分为传入感知和传出效应两个阶段。传入感知阶段,体内感受器包括心脏充盈感受系统(心房感受器、心室感受器和肺感受器)、心排血量感受系统(颈动脉和主动脉压力感受器)和器官灌注感受系统(肾感受器、中枢感受器和胃肠道感受器)。这些感受系统通过检测EABV,触发尿钠排泄,调节循环完整性。传出效应阶段,钠平衡维持主要通过调节钠的排泄实现,而肾脏中肾小管重吸收是调节钠排泄的主要机制。钠的重吸收受到一系列EABV改变而激发的肾脏效应调控,如管球反馈、球管平衡,以及前列腺素、利钠肽、RAAS、交感神经等均参与肾脏尿钠排泄的调节。因此,机体在多重机制的共同参与下,调节钠的平衡,维持EABV[2]。
2 钠平衡紊乱的疾病
体液中的水和钠同时存在,两者失衡经常同时发生,并相互作用。钠平衡被破坏常常反映血容量发生改变,水平衡被破坏表现为渗透压的改变,包括低血容量、高血容量、低钠血症和高钠血症[3]。
2.1 低血容量 低血容量指细胞外液容量减少,分为绝对低血容量或相对低血容量。在绝对低血容量状态下,血钠水平降低。持续腹泻、呕吐和急性大出血是最常见导致血管内细胞外液绝对容量不足的原因。相对血容量减少指细胞外液绝对容量正常,但细胞外液总容积或血管内容积增大,导致相对低血容量。相对低血容量的主要原因为水肿、血管扩张和第三间隙液体丢失。只有当血管内容量减少5%~15%时才会出现低血容量的临床表现,表现为全身乏力、肌肉痉挛和体位性眩晕;当血管内容量降低>10%~20%,可发生循环衰竭,如低血压、四肢冰冷、意识障碍,甚至昏迷。
低血容量治疗的关键是恢复正常的血流动力学和组织灌注,包括治疗原发病和补充容量。分为3个阶段:第一,初步补充目前容量不足;第二,在持续丢失的状态下维持细胞外液容量;第三,对可能的病因及原发病进行治疗[4]。
初始治疗阶段的补液量和补液速度应根据循环状态威胁生命的紧迫性、临床反应充分性和潜在的心功能而定。如患者出现明确危及生命的低血容量休克或循环衰竭,应以最大口径的套管进行快速静脉补液,并持续至血压及组织灌流恢复。然而在临床多数情况下,尤其对于高龄、合并心功能不全或病史不清的患者补液速度不宜过快,需注意过度矫治会导致急性左心力衰竭或肺水肿发生。一般第1小时补液1~2 L,后续根据病情变化及实验室指标调整补液速度。在补液的第2阶段,应减慢补液速度,维持血压和组织灌流。
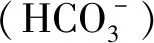
相对低血容量的治疗较绝对低血容量更复杂。因外周血管扩张导致的低血容量,如败血症等,治疗主要针对原发病,谨慎补充晶体溶液,维持细胞外液容积,直至全身血管阻力和静脉容量恢复正常。若存在更严重的血管扩张时,根据患者情况考虑使用缩血管药物。相对低血容量能否纠正主要取决于潜在病因是否逆转[5]。
2.2 高血容量 高血容量指细胞外液容量扩张,细胞外液容量可随钠的摄入量而发生变化。原发或继发肾钠潴留均可导致高血容量。常见的原发性肾钠潴留包括少尿性急性肾损伤、慢性肾脏病、肾小球疾病等。继发性肾钠潴留常见于心力衰竭、肝硬化及特发性水肿[4]。
病因诊断和治疗是改善钠潴留的关键,此外还包括钠盐限制、利尿剂、RAAS抑制剂、NO供体和活性氧/过氧亚硝酸盐清除剂、血管加压素(AVP)受体拮抗剂及钠-葡萄糖协同转运蛋白-2(SGLT-2)抑制剂等治疗[4]。
2.2.1 钠盐限制 钠盐的摄入限制在50~80 mmol(3~5 g/d),尤其对于慢性高血容量患者,如不限制钠盐摄入,一旦停用利尿剂,肾脏对钠的重吸收增加,容量负荷加重。
2.2.2 利尿剂 利尿剂通过抑制肾小管钠的重吸收增加尿钠排泄。常见利尿剂的作用靶点包括近端小管(乙酰唑胺)、髓袢(呋塞米、布美他尼、托拉塞米和依他尼酸)、远端小管(氢氯噻嗪、氯噻酮)、集合管(螺内酯、依普利酮)。长期使用利尿剂可导致电解质紊乱,同时增加利尿剂抵抗。若患者对各种常规剂量利尿剂产生抵抗时,可联合应用作用于不同靶点的利尿剂。对长期使用利尿剂的患者必须监测其电解质水平,注意机体渗透压和肾小球滤过率(GFR)的变化。
2.2.3 RAAS抑制剂 目前研究已经证实,ACEI和ARB可改善心力衰竭患者的肾功能、心功能,延长其预期寿命。RAAS抑制剂可增强利钠尿肽改善GFR,促进尿钠排泄。另一方面,血管紧张素Ⅱ诱导的单个肾单位滤过分数提高有助于维持正常GFR。对于肾脏血流不稳定的患者,RAAS抑制剂可导致其肾功能恶化,故需要密切监测患者的肾功能及高钾血症情况。
2.2.4 NO供体和活性氧/过氧亚硝酸盐清除剂 NO供体(硝酸异山梨酯)和活性氧/过氧亚硝酸盐清除剂(肼屈嗪)通过扩大血管容积,改善高血容量状态。
2.2.5 AVP受体拮抗剂 AVP受体拮抗剂是一种小分子活性非肽类分子。美国FDA批准的托伐普坦和考尼伐坦可改善血流动力学,暂时降低中心静脉压,增加心排血量,减轻体重,缓解水肿,纠正低钠血症。尤其对于晚期心力衰竭患者,AVP受体拮抗剂具有改善高血容量的短期效应。
2.2.6 SGLT-2抑制剂 SGLT-2抑制剂使近端小管重吸收Na+和Cl-减少,在不激活交感神经的前提下减少血浆容量,改善肾小球高滤过状态,从而保护肾功能,同时增强机体对利尿剂和AVP受体拮抗剂的反应性。目前认为,SGLT-2抑制剂更适用于治疗糖尿病合并心力衰竭或糖尿病合并高血容量状态患者[3]。
2.3 低钠血症 低钠血症指血浆Na+浓度<136 mmol/L。根据血渗透压与血钠浓度将低钠血症分为低渗性、高渗性和等渗性。严重低钠血症可导致脑水肿,表现为头痛、嗜睡,甚至死亡。
低钠血症的治疗原则首先是纠正病因,再根据患者的年龄、临床表现、近期血生物化学指标决定低钠血症纠正的速度。低钠血症纠正过慢可导致脑水肿发生,快速纠正低钠血症可能诱发渗透性脱髓鞘病变。急性低钠血症伴有神经系统症状的患者应立即给予高渗溶液治疗,常用溶液为3%氯化钠溶液,首先补充净失钠量[净失钠量(mmol)=血钠浓度的变化(mmol/L)×总体水量(kg),女性总体水量为0.5×体重,男性总体水量为0.6×体重]的1/3,间隔2~4 h监测血钠水平。快速增加血钠2~4 mmol/L即可有效减轻脑水肿,降低颅内压[6]。
对于慢性低钠血症患者,不易较快纠正其血钠水平,避免脱髓鞘病变的发生。慢性低钠血症患者每小时血钠水平升高不应>0.5 mmol/L,前24 h血钠水平升高不应>8 mmol/L。无症状或轻度低钠血症以处理原发病为主[7]。此外,近年来新型选择性AVP受体拮抗剂托伐普坦为治疗低钠血症开辟了新路径。托伐普坦能选择性促进游离水排泄而无明显的电解质丢失,提高血钠水平,目前用于治疗容量正常性低钠血症,以及心力衰竭、肝硬化等导致的高容量性低钠血症。值得注意的是,托伐普坦不能用于治疗低容量性低钠血症患者[7]。
2.4 高钠血症 高钠血症指血钠水平>144 mmol/L,可分为高容量性、正常容量性和低容量性高钠血症,其中低容量性高钠血症最常见。患者常表现为细胞外液容量改变或体液张力增高导致的临床症状,如口渴,肌无力,神志开始较兴奋后逐渐转为忧郁、淡漠、错乱、昏迷,甚至死亡。严重高钠血症可导致颅内出血、硬膜下血肿等发生[8]。
高钠血症治疗的首要原则为积极治疗原发病,如控制高血糖,管理胃肠道症状,纠正高钙血症或低钾血症;其次为控制钠摄入,纠正细胞外液容量异常。如高钠血症发展迅速(<48 h),则要求24 h内纠正血钠水平;慢性高钠血症则要求48 h内维持血钠于正常水平。严重的低容量性高钠血症治疗分为2个阶段:首先快速纠正细胞外液容量缺乏导致的组织低灌注或休克,再逐渐纠正缺水量,总补液量还应包括不显性失水、胃肠道和尿液中的失水量[9]。缺水量=0.4×病前体重(kg)×[(实测钠水平/140)-1]。
3 肾脏替代治疗(RRT)在维持钠平衡中的作用
严重高钠血症(血钠水平>160 mmol/L)伴中枢神经系统症状的患者病死率明显增高。对于因容量负荷过重导致的急性心力衰竭或因肝硬化失代偿期导致的钠潴留患者,RRT为有效的治疗手段。RRT可缓慢清除溶质,有利于维持电解质和渗透压等内环境平衡,缓慢脱水有利于血流动力学稳定。RRT的应用为解决临床危重症、难以纠正的水和电解质紊乱提供了有效的技术手段[10]。
4 结 论
血钠紊乱在危重症患者中常见,是预后不良的重要危险因素。血钠紊乱导致机体细胞直接暴露于低渗或高渗环境中,导致严重、永久,甚至致命性神经系统损伤。然而,血钠紊乱的病因复杂,病理生理机制多样,临床医师须仔细评估,明确病因,适时、适度治疗,动态监测电解质和渗透压水平是治疗成功的关键。

