姜黄素通过调控miR-29-3p和TLR4/NF-κB信号通路改善肾间质纤维化
陈 飞,罗惠民,谢 瑜,吕 琴,沈 颖
(云南省第一人民医院,昆明理工大学附属医院肾内科,云南 昆明 650032)
肾间质纤维化(RIF,renal interstitial fibrosis)不仅是慢性肾脏疾病发展进程中的重要因素之一,也是其终末期的最终结果。临床研究调查表明,目前全球有10%~15%的人口患有慢性肾脏疾病[1]。肾间质纤维化的主要病理学特征为细胞外基质成分沉积、肾小管细胞丢失以及成纤维细胞积累和肾小管周围微血管减少[2]。虽然目前治疗肾间质纤维化的手段较多(如免疫抑制剂等),但由于肾间质纤维化的发病机制较为复杂,目前仍然没有特异性治疗方法,因此寻找一种有效且副作用较小的治疗手段具有重要意义[3]。姜黄素是一种二酮类化合物,其由姜科植物中分离得到且具有抗纤维化、抗增殖等活性,研究表明姜黄素可通过抑制上皮-间质转化抗炎作用治疗肾间质纤维化[4-5]。microRNA(miRNA)是由20~24个核苷酸组成的小RNA,主要调控细胞的增殖、分化、凋亡等[6]。近年来研究表明miRNA也参与肾间质纤维化的病程,例如miRNA-29-3p(miR-29-3p)在肾间质纤维化的过程中发挥重要作用[7]。研究旨在探讨姜黄素对肾间质纤维化以及miR-29-3p的影响,并进一步探究姜黄素在抗肾纤维化作用中的分子机制。
1 实验方法
1.1 药物制备
姜黄素(上海阿拉丁生化科技股份有限公司)溶解于二甲基亚砜(DMSO,dimethyl sulfoxide)(终浓度为50 mmol/L)储存备用,并设置DMSO对照组,且实验过程中DMSO的体积分数不超过0.1%。
1.2 MTT法
将人肾皮质近曲小管上皮细胞(HK-2细胞)接种于96孔板培养24 h(1×105个/孔,37 ℃,体积分数为5%的CO2),结束培养后在细胞培养孔中分别加入浓度为0 μmol/L、5 μmol/L、10 μmol/L、15 μmol/L、20 μmol/L、25 μmol/L的姜黄素以及DMSO,并在加入姜黄素或DMSO的同时加入转化生长因子β1(TGF-β1)(质量浓度为10 ng/mL),孵育48 h后每孔加入MTT溶液(100 μL),培养4 h后加入DMSO溶液(150 μL),在570 nm波长下检测其吸光度值。
1.3 Elisa法
HK-2细胞的分组情况同1.2,选择最佳姜黄素浓度作为姜黄素组细胞的给药浓度,在加入TGF-β1的同时加入姜黄素,并培养48 h。收集细胞培养液并根据试剂商(上海酶联生物科技公司)说明书检测细胞上清液中肿瘤坏死因子-α(TNF-α)、白细胞介素-6(IL-6)和白细胞介素-1β(IL-1β)的浓度。
1.4 细胞转染
将HK-2细胞接种于6孔板中培养24 h后,分别将miR-29-3p mimic (50 nmol/L)和miR-NC mimic(50 nmol/L)(广州市锐博生物科技有限公司)加入转染组和阴性对照组中,在培养箱(37 ℃,体积分数为5%的CO2)中孵育8 h后,加入TGF-β1(质量浓度为10 ng/mL)培养24 h(除空白对照组外)。
1.5 Western blot法检测
收集各组细胞,用放射线免疫沉淀裂解缓冲液(RIPA,radio immunoprecipitation lysis buffer)从HK-2细胞中提取蛋白。蛋白质(20 μg)经过10% SDS-PAGE分离后转PVDF膜,在脱脂牛奶(质量分数为5%)中封闭2 h后,与α-平滑肌肌动蛋白(α-SMA)(V抗体∶V脱脂牛奶=1∶500)、Ⅰ型胶原(COL Ⅰ)(V抗体∶V脱脂牛奶=1∶500)、IκBα(V抗体∶V脱脂牛奶=1∶500)、p-IκBα(V抗体∶V脱脂牛奶=1∶500)、Ⅲ型胶原(COL Ⅲ)(V抗体∶V脱脂牛奶=1∶500)、p-P65(V抗体∶V脱脂牛奶=1∶1 000)、Toll样受体(TLR4)(V抗体∶V脱脂牛奶=1∶500)、NF-κB P65(V抗体∶V脱脂牛奶=1∶1 000)一抗孵育过夜,然后PBS清洗3次后与HRP标记的羊抗兔二抗(V抗体∶V脱脂牛奶=1∶5 000)在4 ℃下孵育2 h,加入化学发光液显影,其灰度值用Image J软件进行量化处理。
1.6 RT-PCR法
HK-2细胞中的总RNA分离使用TRIzol法,光密度值(D260/D280)使用Nanodrop紫外分管光度计进行测定,然后根据试剂盒说明书进行cDNA的合成和PCR的扩增。反应条件为95 ℃,10 min;95 ℃,15 s;60 ℃,60 s,45个循环后结束。GAPDH作为miR-29-3p的内参基因,利用2-ΔΔCt法估算样品miR-29-3p、Ⅰ型胶原蛋白α1链(COL1A1)、Ⅲ型胶原蛋白α1链(COL3A1)的相对表达量。引物序列见表1。

表1 引物序列
1.7 统计学处理
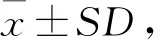
2 结果
2.1 姜黄素抑制肾间质纤维化细胞模型的过度增殖
为探究姜黄素对TGF-β1诱导的肾间质纤维化细胞模型活力的影响,对其增值能力和凋亡率进行检测,结果如图1所示。由图1(a)可知,模型组细胞经TGF-β1处理后活力约为150.2%,空白对照组细胞活力约为98.9%,模型组细胞活力显著增加(P<0.05);当姜黄素浓度达到10~25 μmol/L时,细胞增殖活力分别降低至132.1%、120.3%、109.9%、104.8%,与模型组相比显著下降(姜黄素浓度10 μmol/L:P<0.05,姜黄素浓度15~25 μmol/L:P<0.01);由图1(b)和(c)可知,空白对照组细胞凋亡率约为19.9%,而模型组细胞仅为5.7%左右;与模型组相比,当姜黄素浓度达到10~25 μmol/L时,细胞凋亡率显著降低至19.3%、30.3%、43.2%、51.1%,因此选择姜黄素浓度为10 μmol/L用于后续实验。以上结果表明姜黄素对TGF-β1引起的细胞过度增殖有显著的抑制作用。

注:##表示与空白对照组相比,P<0.01;*表示与模型组相比,P<0.05;**表示与模型组相比,P<0.01。
2.2 姜黄素抑制纤维化因子的表达
姜黄素对α-SMA、COL Ⅰ、COL Ⅲ表达的影响如图2所示。由图2可知,与空白对照组相比,模型组的HK-2细胞中α-SMA、COL Ⅰ、COL Ⅲ的相对表达量均显著增加(α-SMA与COL Ⅰ:P<0.01,COL Ⅲ:P<0.05);经姜黄素处理后,HK-2细胞的上述蛋白相对表达量显著低于模型组(α-SMA与COL Ⅲ:P<0.05,COL Ⅰ:P<0.01)。结果表明姜黄素可显著降低HK-2细胞中的纤维化因子α-SMA、COL Ⅰ、COL Ⅲ的表达量。

注:#表示与空白对照组相比,P<0.05;##表示与空白对照组相比,P<0.01;*表示与模型组相比,P<0.05;**表示与模型组相比,P<0.01。
2.3 姜黄素抑制炎症因子IL-1β、IL-6和TNF-α的产生
姜黄素对炎症因子IL-1β、IL-6和TNF-α质量浓度的影响如图3所示。由图3可知,模型组细胞经TGF-β1处理后,细胞上清液中IL-1β、IL-6和TNF-α的质量浓度相比空白对照组显著增加(P<0.01),但是姜黄素处理后细胞上清液中IL-1β、IL-6和TNF-α的含量急剧增加(P<0.01)。结果提示姜黄素对TGF-β1诱导的肾纤维化细胞模型具有抗炎作用。
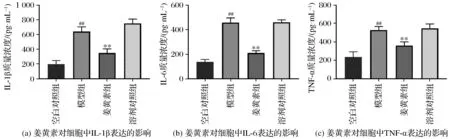
注:##表示与空白对照组相比,P<0.01;**表示与模型组相比,P<0.01。
2.4 姜黄素对TLR4/NF-κB信号通路的调控作用
为探究姜黄素是否通过调控TLR4/NF-κB信号通路发挥抗炎作用,对TLR4、p-P65/p65、p-IκBα/IκBα进行检测,结果如图4所示。由图4可知,与空白模型组相比,TGF-β1诱导显著增加了模型组的HK-2细胞中TLR4、p-P65/p65、p-IκBα/IκBα蛋白的相对表达量(P<0.01);姜黄素显著下调了由于TGF-β1刺激而表达增加的上述蛋白的相对表达量(TLR4、p-P65/p65:P<0.05;p-IκBα/IκBα:P<0.01)。上述结果表明姜黄素可能通过调控TLR4/NF-κB信号通路发挥抗炎作用。

注:#表示与空白对照组相比,P<0.05;##表示与空白对照组相比,P<0.01;*表示与模型组相比,P<0.05;**表示与模型组相比,P<0.01。
2.5 姜黄素促进miR-29-3p的表达
姜黄素对miR-29-3p表达的影响如图5所示。由图5可知,与空白对照组相比,模型组细胞在TGF-β1的诱导下miR-29-3p表达显著降低(P<0.01);与模型组相比,姜黄素显著上调miR-29-3p的表达(P<0.01)。结果表明姜黄素可显著促进由于TGF-β1诱导而表达显著降低的miR-29-3p。

注:##表示与空白对照组相比,P<0.01;**表示与模型组相比,P<0.01。
2.6 miR-29-3p对相关胶原蛋白基因及纤维化因子表达的影响
为明确miR-29-3p对肾间质纤维化的影响,细胞转染miR-29-3p mimic后检测COL3A1、COL1A1的mRNA和α-SMA、COL Ⅲ、COL Ⅰ蛋白的表达情况,结果如图6所示。由图6可知,与空白对照组相比,模型组的COL1A1和COL3A1的mRNA以及α-SMA、COL Ⅲ、COL Ⅰ的表达显著增高(P<0.01);与模型组相比,细胞转染miR-29-3p mimic后COL1A1和COL3A1的mRNA以及α-SMA、COL Ⅰ、COL Ⅲ的表达显著降低(P<0.01)。上述结果说明miR-29-3p可显著抑制其下游靶点COL1A1、COL3A1以及纤维化因子α-SMA、COL Ⅰ、COL Ⅲ的表达。

注:#表示与空白对照组相比,P<0.05;##表示与空白对照组相比,P<0.01;*表示与模型组相比,P<0.05;**表示与模型组相比,P<0.01。
2.7 miR-29-3p抑制炎症因子IL-1β、IL-6和TNF-α的产生
细胞转染miR-29-3p mimic后,检测HK-2细胞上清液中的炎症因子,结果如图7所示。由图7可知,模型组HK-2细胞上清液中IL-1β、IL-6和TNF-α的质量浓度由于TGF-β1的刺激,比空白对照组显著增加(P<0.01),但是miR-29-3p mimic转染后,显著降低由于TGF-β1引起的IL-1β、IL-6和TNF-α的急剧增加(P<0.01)。结果提示miR-29-3p mimic对TGF-β1诱导的肾纤维化细胞模型具有抗炎作用。

注:##表示与空白对照组相比,P<0.01;**表示与模型组相比,P<0.01。
2.8 miR-29-3p对TLR4/NF-κB信号通路的调控作用
通过检测TLR4、p-IκBα/IκBα、p-P65/p65蛋白的表达情况,进一步探究miR-29-3p对TLR4/NF-κB信号通路的调控作用,结果如图8所示。由图8可知,在TGF-β1诱导的作用下模型组的HK-2细胞中p-IκBα/IκBα、TLR4、p-P65/p65蛋白的相对表达量相比空白对照组显著增加(P<0.01);与模型组相比,转染miR-29-3p mimic后显著下调了上述蛋白的相对表达量(P<0.01)。结果表明miR-29-3p可能通过调控TLR4/NF-κB信号通路发挥抗炎作用。

注: ##表示与空白对照组相比,P<0.01;**表示与模型组相比,P<0.01。
3 讨论
近年来,研究发现姜黄素在肝纤维化、肾纤维化等器官纤维化疾病中具有较大的治疗潜能[8-9]。本次实验中亦表明姜黄素可显著抑制TGF-β1诱导的肾间质纤维细胞活力和COL Ⅰ、COL Ⅲ及α-SMA的生成。(肌)成纤维细胞的增殖和活化以及细胞外基质的过量产生是许多器官中纤维化的常见机制,成纤维细胞也是主要产生COL Ⅰ和COL Ⅲ等间质基质成分的细胞之一[10-11]。另外,在肾间质纤维化的过程中TGF-β1可诱导肾脏固有细胞发生表型转化,使得肌成纤维细胞受损激活并且α-SMA阳性表达升高,这标志着肾间质纤维化的进一步发展[12-13]。Li等[1]的实验结果也证明通过降低细胞外基质的产生(COL Ⅰ)和α-SMA的产生可抑制肾纤维化的发生。因此依据实验推测,姜黄素可通过抑制COL Ⅰ和COL Ⅲ等胶原蛋白和α-SMA的生成,在TGF-β1诱导的肾间质纤维的过程中发挥抗纤维化作用。
肾脏的纤维化病灶通常在肾血管周围的组织中被激发和定位,而炎症微环境中促细胞纤维化因子的增加会导致产生基质的细胞生成,因此炎症与肾纤维化的程度有密切的关系[10]。研究发现炎症因子TNF-α、IL-6和IL-1β和TLR4、NF-κB蛋白在TGF-β1诱导的肾间质纤维细胞中显著升高,而姜黄素处理后可抑制其生成。已有文献报道了TNF-α、IL-6和IL-1β等炎症因子的浓度增加会产生炎症细胞的浸润从而促进肾纤维化的进一步发展,因此抑制炎症的发展是解决纤维化疾病的关键因素之一[14]。TLR4是肾脏炎症的重要介质之一,并且作为炎症相关通路的启动子可激活NF-κB,进而促成纤维细胞激活和肾纤维化[15]。许多体内外实验也证明了通过抑制NF-κB的活化可显著改善肾脏炎症以及肾纤维化[16-17],如Han等[18]证明了通过调控TLR4和NF-κB可改善肾间质纤维化程度。因此结合本次实验结果,推测认为姜黄素发挥了抗炎及抗纤维化作用,可能与调控TLR4/NF-κB信号通路有关。
miR-29-3p是肾特异性表达的miRNAs之一,近年来在肾纤维化形成中的作用受到了广泛的关注[19-20]。实验中观察到:miR-29-3p mimic转染后COL Ⅰ、COL Ⅲ、α-SMA的生成被明显抑制,炎症因子TNF-α、IL-6和IL-1β显著降低,并且TLR4、p-IκBα/IκBα、p-P65/p65蛋白也明显下调。miR-29-3p在肾脏器官中一般处于高表达状态,但是在肾纤维化的动物模型或者人类样本中表达均减少,表明其具有良好的抗纤维化作用[21]。COL1A1、COL3A1是细胞外间质中重要的胶原蛋白的链蛋白编码基因,可与miR-29-3p结合从而抑制胶原蛋白的表达以达到抗纤维化的作用[22-23]。还有研究表明上调miR-29-3p的表达可进一步抑制COL Ⅰ等细胞外间质以及α-SMA的产生,从而逆转肾纤维化病情的发展[24]。此外,更值得注意的是,本次实验也发现姜黄素可显著促进miR-29-3p的表达,由此证实了姜黄素可通过上调miR-29-3p的表达以及调控TLR4/NF-κB信号通路抑制胶原蛋白、纤维化因子以及炎症因子的生成,延缓抗肾间质纤维化的病程发展。
综上所述,研究采用TGF-β1诱导的体外肾间质纤维化细胞模型,证明了姜黄素可通过抑制纤维化因子COL Ⅰ、COL Ⅲ、α-SMA的表达和炎症因子IL-1β、IL-6和TNF-α的产生,发挥了抗炎及抗纤维化作用,其分子机制可能与促进miR-29-3p的表达及调控TLR4/NF-κB信号通路有关。研究挖掘了姜黄素在肾间质纤维化的治疗中具有的应用潜能,并进一步发现了姜黄素对miR-29-3p以及TLR4/NF-κB信号通路的调控作用,这对姜黄素在临床上治疗肾间质纤维化提供了一定的理论基础。但本次研究只在体外实验证明了姜黄素的抗纤维化作用,后续研究应建立体内抗纤维化动物模型,以便更好地阐明姜黄素对肾间质纤维化的治疗作用以及相关分子作用机制。

