补骨脂素对炎性环境下人牙周膜干细胞成骨分化的影响及机制
崔蕾,司玲,武光杰,张栋,边百川,胡静,韩雪
(河北省直属机关第二门诊部口腔科,河北 石家庄 050051)
牙周病是一种慢性炎症性疾病,其特征为不可逆的附着丧失和骨吸收,如果不及时治疗,可最终导致牙齿松动甚至脱落,骨再生和修复是牙周治疗的最终目标[1]。人牙周膜干细胞(human periodontal ligament stem cells,hPDLSCs)是一种新发现的间充质干细胞(mesenchymal stem cells,MSCs)亚群,具有多向分化潜能和自我更新能力,在修复牙周组织方面发挥关键作用,是牙周再生所需的重要种子细胞之一[2]。然而,炎症会降低hPDLSC的骨再生能力,导致不可逆的损伤[3],因此积极探究炎性环境下参与hPDLSCs成骨分化的机制并开发新的治疗策略,对实现牙周组织再生具有重要意义。经典的Wnt/β-catenin轴已被确定为人MSCs分化为成骨细胞的关键。研究发现,激活该信号轴可增强hPDLSCs的增殖和成骨,但其在炎性环境下的潜在机制应用仍有待探索[4]。补骨脂素已广泛应用于临床治疗骨折、骨缺损和骨质疏松症[5]。研究发现,其可促进骨髓MSCs分化为成骨细胞[6],但关于其对hPDLSCs在炎性环境下的成骨分化影响报道较少,故本研究拟通过体外分离培养hPDLSCs,利用肿瘤坏死因子-α(TNF-α)诱导炎性环境,探讨炎性环境下补骨脂素对hPDLSCs成骨分化及Wnt/β-catenin轴的影响,以期为牙周病治疗策略制定提供一定的参考。
1 材料与方法
1.1 主要材料与仪器
hPDLSCs来源于前磨牙。前磨牙取自本院20例因正畸需要拔牙的健康个体,其中男、女各10例,年龄12~16岁,平均年龄(14.05±1.43)岁。本研究经医学伦理委员会批准,捐赠者知情并书面同意(批准号:202101);补骨脂素(质量分数≥98%,SP8670)购自北京索莱宝生物科技有限公司;α-MEM培养液(C12641800BT)、胎牛血清(10099)购自美国Gibco公司;人TNF-α(HETNP-01022)购自赛业生物科技有限公司;Stro1-PE(ab190282)、兔抗Wnt3a多克隆抗体(ab28472)、兔抗β-catenin单克隆抗体(ab223075)购自美国Abcam公司;CD146-PE(9811)、CD34-PE(9597)、CD45-PE(MBS670497)购自武汉艾美捷生物科技有限公司;碱性磷酸酶(alkaline phosphatase,ALP)(P0321S)检测试剂盒购自上海碧云天生物技术有限公司;茜素红染色试剂盒(ZY121105)购自上海泽叶科技有限公司;兔抗糖原合成酶激酶3β(glycogen synthase kinase3β,GSK-3β)(YT782)单克隆抗体购自北京百奥莱德科技有限公司;兔抗p-GSK-3β多克隆抗体(PL0303230)购自PL Laboratories公司;IX73荧光倒置显微镜购自Olympus公司;Infinite M1000 Pro多功能酶标仪购自瑞士帝肯公司;GelDoc XR Biorad凝胶成像系统购自美国BIO-RAD公司。
1.2 hPDLSCs体外分离及培养
PBS(含100 u/mL青霉素和100µg/mL链霉素)清洗前磨牙,无菌刮取牙周韧带组织,切碎后移入含I型胶原酶(3 mg/mL)和分散酶Ⅱ(4 mg/mL)消化40 min。为进一步分离和纯化干细胞,使用极限稀释法克隆原代细胞的单细胞悬浮液[7],后将细胞在含有10%(φ)胎牛血清、100 u/mL青霉素和100µg/mL链霉素的α-MEM完全培养液中,于37℃、5%(φ)CO2培养箱中培养。每3天更换1次培养基。当细胞达到80%融合时,进行传代培养及鉴定。第3~第5代hPDLSCs用于后续实验。
1.3 流式细胞术进行hPDLSCs表型鉴定
酶消化法收集第2代hPDLSCs,PBS洗涤2遍后重悬,分别与Stro1-PE、CD146-PE及CD34-PE、CD45-PE混合,4℃避光孵育1 h,未用荧光抗体处理的细胞用作对照。PBS洗涤3次后,通过流式细胞仪采集并分析标记的细胞。
1.4 茜素红染色检测hPDLSCs成骨分化能力
成骨诱导培养液组成:α-MEM+10 mmol/Lβ-甘油磷酸盐+0.1 µmol/L地塞米松+50 μg/mL抗坏血酸。取第2代hPDLSCs以每孔1×105个细胞密度接种至6孔板,待细胞达到90%融合后,更换α-MEM完全培养液为成骨诱导培养液并培养21 d,每3天换液1次。后PBS轻轻洗涤细胞,4%多聚甲醛溶液固定15 min,0.02%茜素红染色试剂室温下染色20 min检测钙沉积;以α-MEM完全培养液培养组为对照。
1.5 油红O染色检测hPDLSCs成脂分化能力
成脂诱导培养液组成:α-MEM+0.5 µmol/L IBMX+200 µmol/L吲哚美辛+1 µmol/L地塞米松+10 μg/mL胰岛素+10%胎牛血清。取第2代hPDLSCs以每孔1×105个细胞密度接种至6孔板内,成脂诱导培养液培养21 d,每3天换液1次。后PBS洗涤细胞,4%多聚甲醛溶液固定15 min,油红O染色30 min检测脂滴形成;以α-MEM完全培养液培养组为对照。
1.6 hPDLSCs分组、培养
取第3代hPDLSCs以每孔1×105个细胞密度接种至6孔板内,待细胞达到90%融合后,将其分为对照组、TNF-α诱导组及补骨脂素低、中、高剂量组,每组各5个复孔。其中对照组细胞培养液仅为成骨诱导培养液,TNF-α诱导组细胞培养液为成骨诱导培养液+10 ng/mL TNF-α,补骨脂素低剂量组细胞培养液为成骨诱导培养液+10 ng/mL TNF-α+2µmol/L补骨脂素,同理,补骨脂素中、高剂量组分别于培养液中添加6、18µmol/L补骨脂素。各组细胞培养7 d及21 d后进行后续相关实验。
1.7 hPDLSCs ALP染色及活性检测
各组细胞培养7 d后,进行ALP染色及活性检测。PBS洗涤细胞2~3次,4%多聚甲醛溶液固定30 min,PBS洗涤后加入ALP染色液染色25 min,PBS清洗以清除非特异性染色,镜下观察并采集图片;刮取细胞于150 µL 0.05% Triton X-100中室温处理10 min,对细胞进行超声处理后,12 000 r/min离心10 min后取上清,根据ALP试剂盒说明书步骤操作,终止反应后标准孔及ALP孔显示不同深浅的黄色,利用酶标仪于405 nm处测定吸光度值(A),根据试剂盒ALP活性单位定义定量ALP活性。
1.8 茜素红染色检测hPDLSCs钙沉积
各组细胞培养21 d后,进行茜素红染色及钙沉积相对量检测。茜素红染色步骤同“1.4”项下;为量化钙沉积情况,染色观察后,PBS轻轻洗涤细胞1~2遍,于6孔板内加入10%氯化十六烷基吡啶以溶解矿化结节,测定562 nm波长处的比色吸光度。
1.9 RT-qPCR检测成骨分化相关因子mRNA表达
各组细胞培养7 d后,进行RT-qPCR检测。Trizol法提取各组细胞总RNA,检测其完整性及纯度合格后,将其反转录为cDNA,制备RT-qPCR反应体系并上机检测,反应条件为95°C预变性10 min,95 °C变性10 s,60 °C退火20 s,70 °C延伸15 s,共40个循环。以GAPDH为内参,2-ΔΔCt法计算目的基因的相对表达量。引物序列:Runt相关转录因子2(Runt related transcription factor 2,Runx2):F:5′-CAC TGGCGCTGCAACAAGA-3′,R:5′-CATTCCGGAG CTCAGCAGAATA-3′;锌指结构转录因子(Osterix,Osx):F:5′-AGAGATCTGAGCTGGGTAGAGG-3′,R:5′-AAGAGAGCCTGG CAAGAGG-3′;骨桥蛋白(osteopontin,OPN):F:5′-AGGCTGATTCTGGAA GTT CTG-3′;R:5′-CTTACTTGGAAGGGGTCTG TGG-3′;骨钙素(osteocalcin,OCN):F:5′-CTCCTT ACCCGGATCCCCTG-3′,R:5′-GTAGAAGCGCT GGTAGGCGT-3′;GAPDH,F:5′-ATTTGGTCGTAT TGGGCG-3′,R:5′-TGGAAGATGGGTGATGGG ATT-3′。
1.10 Western blot检测Wnt/β-catenin通路相关蛋白表达
各组细胞培养7 d后,RIPA裂解液裂解细胞并收集总蛋白,BCA法测定蛋白浓度。等量加样蛋白于10%SDS-PAGE孔并转移至PVDF膜上,5%脱脂牛奶室温封闭膜抗体2 h,后直接与对应一抗4 °C孵育过夜(均1∶1 000稀释),TBST洗涤3次,每次10 min,后于二抗(1∶10 000)室温孵育2 h,TBST洗涤3次,每次10 min,膜与ECL显影试剂反应,化学发光凝胶成像系统曝光条带,Image J软件量化条带灰度值,以目的蛋白与内参GAPDH灰度值比值表示蛋白的相对表达量。
1.11 统计学方法
利用SPSS 22.0软件对数据进行多组间单因素方差分析和两组间LSD-t检验,计量结果均以表示。P<0.05为差异有统计学意义。
2 结果
2.1 hPDLSCs表型鉴定
流式细胞术数据显示hPDLSCs高表达MSCs标志物CD146和Stro-1,几乎不表达造血干细胞标志物CD34和白细胞标志物CD45。见图1。
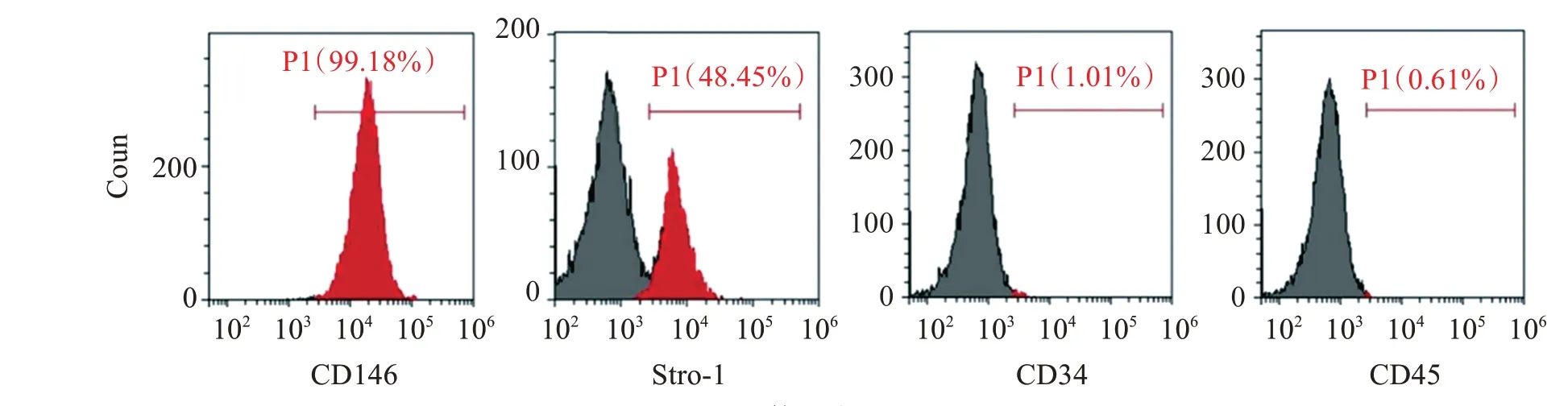
图1 hPDLSCs表面抗体鉴定Figure 1 Identification of surface markers of hPDLSCs
2.2 hPDLSCs成骨分化潜能
茜素红染色结果显示,体外分离培养的hPDLSCs具有成骨分化潜能,成骨诱导21 d后可见矿化钙沉积物形成,见图2。
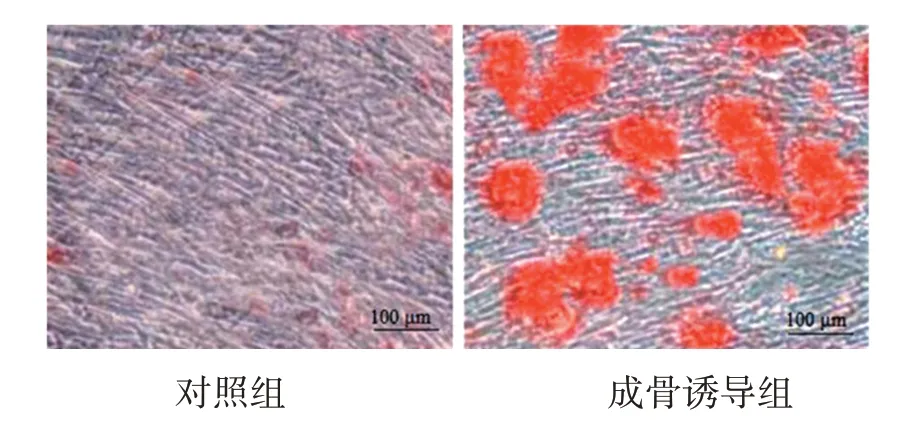
图2 hPDLSCs茜素红染色图(200×)Figure 2 Alizarin red staining diagram of hPDLSCs(200×)
2.3 hPDLSCs成脂分化潜能
油红O染色结果显示,体外分离培养的hPDLSCs具有成脂分化潜能,成脂诱导21 d后可见脂滴形成,见图3。
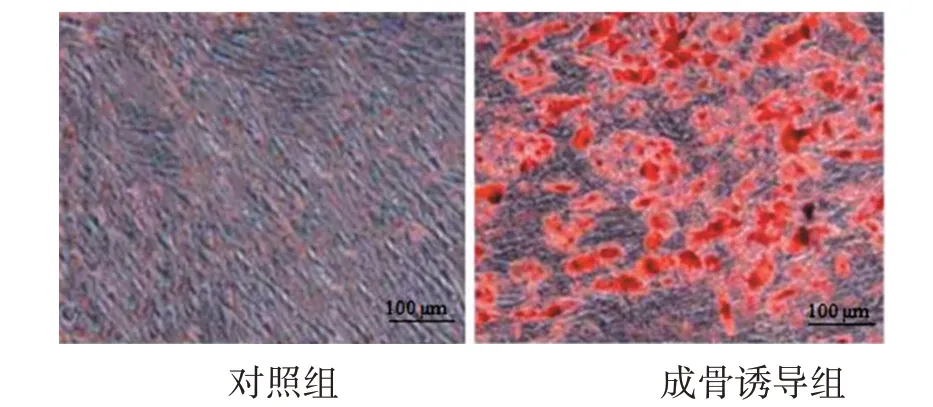
图3 hPDLSCs油红O染色图(200×)Figure 3 Oil red O staining diagram of hPDLSCs(200×)
2.4 补骨脂素对炎性环境下hPDLSCs ALP活性的影响
与对照组比较,其他4组hPDLSCs ALP活性降低(P<0.05);与TNF-α诱导组比较,补骨脂素低、中、高剂量组ALP活性逐渐升高(P<0.05)。见图4,表1。
表1 炎性环境下hPDLSCs ALP活性比较Table 1 Comparison of ALP activity of hPDLSCs in inflammatory environment(±s,n=5)ρ/(u·g prot-1)

表1 炎性环境下hPDLSCs ALP活性比较Table 1 Comparison of ALP activity of hPDLSCs in inflammatory environment(±s,n=5)ρ/(u·g prot-1)
与对照组比较:*P<0.05;与TNF-α诱导组比较:#P<0.05;与补骨脂素低剂量组比较:@P<0.05;与补骨脂素中剂量组比较:&P<0.05。
组别对照组TNF-α诱导组补骨脂素低剂量组中剂量组高剂量组ALP活性274.85±19.09 76.80±6.81*107.93±9.23*#153.06±12.70*#@214.66±15.26*#@&
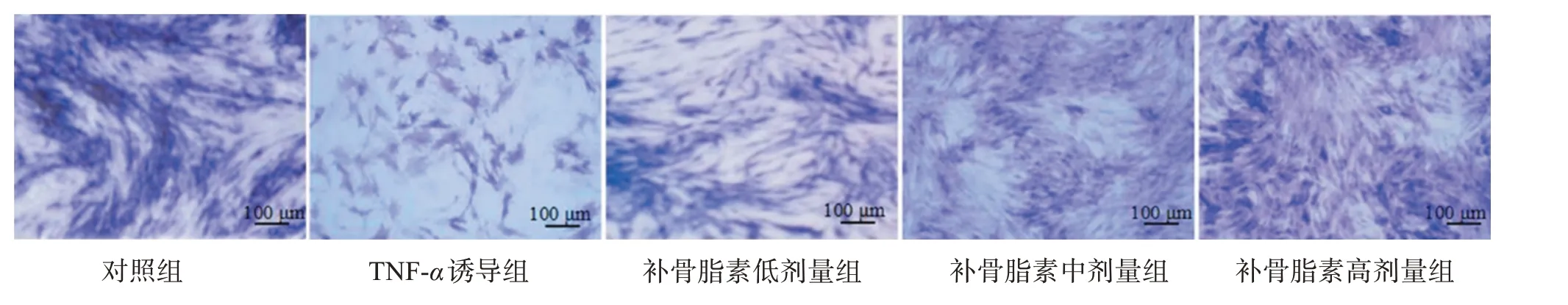
图4 hPDLSCs ALP染色图(100×)Figure 4 ALP staining diagram of hPDLSCs(100×)
2.5 补骨脂素对炎性环境下hPDLSCs矿化钙沉积的影响
成骨诱导培养21 d后,检测结果显示,与对照组比较,其他4组hPDLSCs矿化钙沉积吸光度值降低(P<0.05);与TNF-α诱导组比较,补骨脂素低、中、高剂量组hPDLSCs矿化钙沉积吸光度值逐渐升高(P<0.05)。见图5,表2。
表2 炎性环境下hPDLSCs矿化钙沉积比较Table 2 Comparison of mineralized calcium deposition of hPDLSCs in inflammatory environment(±s,n=5)
表2 炎性环境下hPDLSCs矿化钙沉积比较Table 2 Comparison of mineralized calcium deposition of hPDLSCs in inflammatory environment(±s,n=5)
与对照组比较:*P<0.05;与TNF-α诱导组比较:#P<0.05;与补骨脂素低剂量组比较:@P<0.05;与补骨脂素中剂量组比较:&P<0.05。
组别对照组TNF-α诱导组补骨脂素低剂量组中剂量组高剂量组A 3.28±0.11 1.12±0.07*1.57±0.07*#2.18±0.05*#@3.04±0.08*#@&
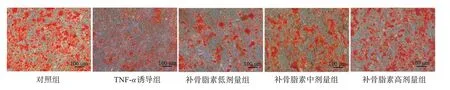
图5 各组hPDLSCs茜素红染色图(100×)Figure 5 Alizarin red staining of hPDLSCs in each group(100×)
2.6 补骨脂素对炎性环境下成骨分化相关因子mRNA表达的影响
与对照组比较,其他4组hPDLSCs中Runx2、Osx、OPN及OCN mRNA相对表达水平降低(P<0.05);与TNF-α诱导组比较,补骨脂素3个治疗组hPDLSCs中Runx2、Osx、OPN及OCN mRNA相对表达水平均升高(P<0.05)。见表3。
表3 炎性环境下hPDLSCs成骨分化因子mRNA表达水平比较Table 3 Comparison of osteogenic differentiation factor mRNA expression levels of hPDLSCs in inflammatory environment(±s,n=5)

表3 炎性环境下hPDLSCs成骨分化因子mRNA表达水平比较Table 3 Comparison of osteogenic differentiation factor mRNA expression levels of hPDLSCs in inflammatory environment(±s,n=5)
与对照组比较:*P<0.05;与TNF-α诱导组比较:#P<0.05;与补骨脂素低剂量组比较:@P<0.05;与补骨脂素中剂量组比较:&P<0.05。
组别对照组TNF-α诱导组补骨脂素低剂量组中剂量组高剂量组Runx2 1.02±0.01 0.24±0.03*0.36±0.03*#0.53±0.05*#@0.82±0.04*#@&Osx 1.00±0.01 0.31±0.02*0.38±0.02*#0.60±0.03*#@0.79±0.03*#@&OPN 1.01±0.02 0.23±0.04*0.29±0.02*#0.45±0.05*#@0.69±0.06*#@&OCN 1.01±0.02 0.27±0.03*0.38±0.02*#0.57±0.03*#@0.81±0.05*#@&
2.7 补骨脂素对炎性环境下Wnt/β-catenin通路相关蛋白表达的影响
各组hPDLSCs中GSK-3β蛋白相对表达水平差异无统计学意义(P>0.05);与对照组比较,其他4组hPDLSCs中Wnt3a、β-catenin及p-GSK-3β蛋白相对表达水平降低,CTSK蛋白相对表达水平升高(P<0.05);与TNF-α诱导组比较,补骨脂素3个治疗组hPDLSCs中Wnt3a、β-catenin及p-GSK-3β蛋白相对表达水平均升高,CTSK蛋白相对表达水平降低(P<0.05)。见图6,表4。

图6 Wnt/β-catenin通路相关蛋白表达情况Figure 6 Expression of Wnt/β-catenin pathway related proteins
表4 炎性环境下hPDLSCs信号通路相关蛋白表达水平比较Table 4 Comparison of signal pathway related protein expression levels of hPDLSCs in inflammatory environment(±s,n=5)
表4 炎性环境下hPDLSCs信号通路相关蛋白表达水平比较Table 4 Comparison of signal pathway related protein expression levels of hPDLSCs in inflammatory environment(±s,n=5)
与对照组比较:*P<0.05;与TNF-α诱导组比较:#P<0.05;与补骨脂素低剂量组比较:@P<0.05;与补骨脂素中剂量组比较:&P<0.05。
组别对照组TNF-α诱导组补骨脂素低剂量组中剂量组高剂量组0.67±0.07 0.24±0.04*0.29±0.02*#0.38±0.03*#@0.55±0.04*#@&0.83±0.05 0.19±0.03*0.28±0.02*#0.42±0.03*#@0.62±0.03*#@&0.56±0.03 0.57±0.03 0.56±0.02 0.58±0.03 0.57±0.02 0.52±0.03 0.17±0.02*0.22±0.02*#0.34±0.03*#@0.46±0.04*#@&0.19±0.03 0.57±0.03*0.51±0.02*#0.34±0.02*#@0.25±0.02*#@&Wnt3a β-catenin GSK-3β p-GSK-3β CTSK
3 讨论
研究表明,长期存在的慢性炎症环境可改变细胞表观遗传特征并降低牙周组织的再生能力,是牙周组织丧失的主要因素[8]。TNF-α是由单核细胞和巨噬细胞产生的一种重要促炎因子,其过度释放可导致牙槽骨、牙槽窝及牙齿支撑组织缺损等,且对hPDLSCs的成骨分化具有破坏性作用[9]。因此,于体外靶向TNF-α诱导的炎性环境并提高该环境下hPDLSCs的成骨分化能力可能是牙周炎临床治疗的重要策略之一。据报道,TNF-α浓度高于1 ng/mL(10、100 ng/mL)时,可呈剂量依赖性抑制成骨分化[10],使用10 ng/mL TNF-α处理健康的PDLSCs可模拟牙周炎患者中PDLSCs成骨和再生能力受损[11];ALP是一种位于细胞膜中的钙结合转运蛋白,可促进细胞成熟和钙化,ALP活性和细胞钙化水平分别为早期、晚期的成骨分化指标[12]。本研究利用牙周韧带组织体外分离并培养细胞,经分子表型及功能鉴定后,确定所培养的细胞为具有多向分化潜能的hPDLSCs;另于成骨诱导培养液中添加10 ng/mL TNF-α后发现,细胞ALP活性及矿化钙沉积程度显著降低,提示TNF-α添加可成功诱导炎性环境且对体外分离培养的hPDLSCs具有成骨分化抑制作用,可用于本研究的后续相关试验。
补骨脂素具有抗炎、抗菌、抗骨质疏松等多种药理活性[13],研究表明,其可抑制TNF-α诱导的滑膜细胞炎症[14],增加骨质疏松模型中的骨强度和骨小梁微结构,提高ALP的活性及矿结节数量,促进成骨细胞分化[15]。另有研究结果显示,补骨脂素可下调炎症状态下的hPDLCs炎性细胞因子水平[16],呈剂量依赖性地抑制牙周炎细菌数量,减轻牙周炎小鼠的牙槽骨丢失和炎症反应,增强hPDLCs ALP活性[17]。本研究结果显示,补骨脂素可增强TNF-α诱导炎性环境下的hPDLSCs的ALP活性并提高矿化钙沉积水平,且作用效果呈剂量性依赖,提示补骨脂素可能通过抑制TNF-α作用,降低培养环境内的炎性水平,从而改善hPDLSCs表型状态,减轻细胞分化能力损伤,进而促进成骨分化。骨形成的分子机制涉及增殖、细胞外基质成熟和矿化,它们由各种关键分子协调,Runx2为成骨过程所必需的最重要的转录因子,负责成骨细胞分化标记基因的激活;OPN和OCN是成骨细胞的两个典型生物标志物,在骨形成和修复过程中参与成骨分化和细胞外基质的矿化;Osx是一种新型含锌指的成骨细胞特异性转录因子,对成骨细胞分化、增殖和骨形成至关重要,可调节许多成骨因子的表达,包括Runx2、骨连接蛋白、骨桥蛋白、OCN和ALP[4],研究发现,骨形成时,Runx2、OPN、OCN和Osx表达上调[18]。本研究结果显示,补骨脂素组炎性环境下hPDLSCs中Runx2、OPN、OCN和Osx mRNA相对表达水平显著提高,表明补骨脂素可通过上调成骨相关基因表达促进成骨分化。
多项研究表明,Wnt/β-catenin信号通路激活可促进多种干细胞和成骨细胞的成骨分化[19-20]。Wnts与细胞表面受体复合物结合后,GSK-3β磷酸化可抑制其自身激活以及随后的β-catenin磷酸化,从而减少细胞质中β-catenin降解,启动β-catenin细胞内积累,上调的β-catenin转移到细胞核刺激下游相关基因表达[21]。Wnt3a是一种已知的经典Wnt蛋白,研究发现,下调其表达及β-catenin、p-GSK-3β水平可抑制血管平滑肌细胞钙化及成骨细胞分化[22];另有研究结果显示,地塞米松可增强炎性条件下人成牙骨质细胞中的Wnt3a、β-catenin和p-GSK-3β表达,通过Wnt信号通路刺激成牙骨质细胞生长及分化[23]。CTSK是一种溶酶体半胱氨酸蛋白酶,由破骨细胞强烈表达,被高度认为是破骨细胞的良好标记基因,沉默CTSK可抑制牙周病灶区炎症进而治疗牙周病[24];另有报道称,通过激活Wnt/βcatenin信号传导下调CTSK表达可抑制去卵巢大鼠的颌骨骨质疏松症[25]。本研究结果显示,炎性条件下Wnt3a、β-catenin、p-GSK-3β表达水平降低,提示Wnt/β-catenin轴被抑制;补骨脂素作用后,Wnt3a、β-catenin及p-GSK-3β蛋白相对表达水平均上调,CTSK蛋白表达下调,提示补骨脂素可能通过激活Wnt/β-catenin轴抑制CTSK蛋白表达,进而减轻培养环境中的TNF-α促炎作用并利于hPDLSCs中成骨相关基因转录表达,促进hPDLSCs成骨分化发生。
综上所述,补骨脂素可促进炎性环境下hPDLSCs成骨分化,其作用机制可能与激活Wnt/βcatenin轴下调CTSK表达有关,为牙周炎发病机制及临床治疗提供了一定的基础依据。

