热熔挤出法制备黄连提取物固体分散体的研究
何文涛,张跃跃,王文雅,黄辉球,黄泰润,宋吉明,3,黄德浩,
(1.安徽大学化学化工学院,安徽 合肥 230601;2.惠州市九惠制药股份有限公司,广东 惠州 516000;3.安徽大学材料科学与工程学院,安徽 合肥 230601)
黄连提取物主要成分为盐酸小檗碱,也被称为“黄连素”,现代药理学证实黄连提取物可发挥明显的抗炎、抗菌、抗氧化、抗腹泻和降血糖作用等[1-4]。黄连提取物是连番止泻胶囊的主要成分,口服药物时,黄连素在口腔中产生苦味,这是儿童抵触服药或不按时按量服药的主要原因之一,因此,将其制成口服药物,掩味显得非常重要[5-6]。
传统的掩味技术有添加矫味剂、粉末包衣、制备微囊、形成离子交换树脂复合物、形成环糊精包合物及添加增稠剂等[7-10]。李潘等[11]以mPEG-PLLA与黄连中5种苦味生物碱巴马汀、药根碱、小檗碱、表小檗碱及黄连碱的相互作用为研究对象,结果表明均具有显著的掩味效果;熊魏等[12]以丙烯酸树脂Ⅱ号等为包衣材料,对黄连提取物进行掩味技术初步研究,苦味大大减少,口感良好;张天翼等[13]以盐酸小檗碱为模型药物,Amberlite IRP69为载药树脂,制得的复合物在唾液环境中60 min后仅释放约10%,尤其是在前5 min内几乎不释放,具有很好的掩味效果。但以上几种技术存在着药物包封率较低、使用有机溶剂时造成环境污染、工艺条件要求高等缺点。
热熔挤出技术(hot-melt extrusion,HME)最初应用于塑料和高分子加工行业,从20世纪90年代开始,该技术开始被引入制药行业,并得到迅速发展和应用。HME是将原料药、高分子载体及其他辅料同时加至挤出机中,实现在单一挤出机中将药物与辅料混合、熔融、成型,由多相状态转为单相状态的技术,由于其强烈的混合与剪切作用,能使药物更均匀地分散在载体中[14-15],可以用于提高难溶性药物的水中溶解度,以及缓释、掩味等[16]。本研究通过处方前研究确定高分子载体,利用HME以尤特奇E100为载体制备了黄连提取物固体分散体(CE-SD),以体外溶出为考察指标,探究载药量的变化对溶出度的影响,为进一步利用热熔挤出法进行连番止泻胶囊掩味研究提供参考依据。
1 仪器与试药
SJ16桌面式单螺杆热熔挤出机(张家港市互亿得机械有限公司);N-1300旋转蒸发仪(东京理化器械株式会社);FE20 pH计(梅特勒-托利多仪器有限公司);UV-6000PC紫外可见分光光度计(元析仪器有限公司);Vertex80傅立叶红外光谱仪(德国布鲁克公司);SmartLab 9 KW X-射线多晶衍射仪(日本理学株式会社);TG209F3热重红外联用检测仪(赛默飞世尔);S-4800扫描电子显微镜(日本日立公司)。
黄连提取物(盐酸小檗碱质量分数为60%,惠州市九惠制药股份有限公司);尤特奇E100和共聚维酮VA64(上海德祥医药技术有限公司);乙基纤维素(上海阿拉丁生化科技股份有限公司);无水乙醇、聚乙二醇6000、聚乙烯吡咯烷酮、泊洛沙姆188(上海麦克林生化科技有限公司);盐酸小檗碱对照品(纯度≥98%,中国药品生物制品检定所)。
2 方法
2.1 测定波长的确定及标准曲线的建立
精密称取盐酸小檗碱适量,置于250 mL容量瓶中,用pH=6.8的磷酸盐缓冲液稀释至刻度,于200~600 nm的波长内进行光谱扫描。
UV标准曲线的制定如下:以盐酸小檗碱为对照品,配制浓度为0.103 4 mg/mL的溶液。依次移取上述溶液1.0、2.0、3.0、4.0、5.0 mL溶液于25 mL容量瓶中并定容,依次移取样液3 mL,测定溶液吸光度,绘制标准曲线。
2.2 薄膜法筛选载体
为了节省原料,利用薄膜法制备固体分散体:将原料药和载体共溶于有机溶剂,再挥干有机溶剂,使药物分散在载体中形成固体分散体,多用于热熔挤出前的处方筛选[17-18]。
固定载药量10%,分别称量原料药CE和6种高分子载体聚乙二醇6000、泊洛沙姆188、乙基纤维素、尤特奇E100、聚乙烯吡咯烷酮和共聚维酮VA64,混合均匀,得到不同载体的物理混合物。加入适量乙醇溶解,使均匀分散至澄清,于80℃干燥1 h,取出,研磨,得到不同载体的固体分散体。对原料药和制备好的固体分散体进行磷酸盐缓冲液溶出度检测。
2.3 热稳定性测试
采用热重分析法,分别取药物和载体适量,置于铝盘中,以氧化铝为参比物,在空气流中,从30℃到600℃,以10℃/min的速率升温。
2.4 热熔挤出法制备CE固体分散体(CE-SD)
选择尤特奇E100为高分子载体,聚乙二醇6000作为塑化剂,分别按照载药量为10%、15%、20%、25%、30%制备物理混合物,以热熔挤出工艺将CE制备成固体分散体,其制备工艺如下:称取CE、尤特奇E100及聚乙二醇6000共100 g,粉碎过100目筛,置于球磨机内充分混合,球磨频率设定为40 Hz,球磨20 min,共3次,每次间隔5 min,制成物理混合物,设定单螺杆挤出机的挤出温度为160℃,温度升到设定值后启动螺杆,螺杆转速为60 r/min,再将制得的物理混合物加入挤出机中,挤出物经冷却后,切成小段,粉碎后过100目筛,得到黄连提取物固体分散体(CE-SD)粉末。
2.5 CE-SD的评价
为探究所得的CE-SD粉末是否具有掩味效果,以pH=6.8磷酸盐缓冲液为溶出介质,模拟口腔溶液环境,根据其溶出度判断是否具有掩味效果;为确保所得CE-SD不会影响药物在胃部中的释放,以pH=1.2盐酸溶液为溶出介质,模拟胃部溶液环境,测试其溶出度,具体测试方法见“2.5.1”和“2.5.2”。按下式[19-20]计算各时间点的累积溶出度:
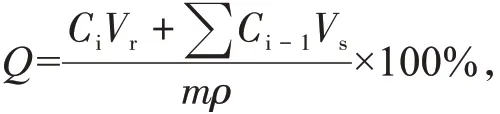
式中:Q为溶出度;Ci为各时间点取出的样品浓度;Vr为各时间点固定取样体积;Vs为溶出介质体积;m为CE或CE-SD粉末质量;ρ为药物质量分数。
2.5.1 磷酸盐缓冲液溶出度测定方法称取CE-SD粉末500 mg,按照2020年版《中国药典》通则第0931,以pH=6.8磷酸盐缓冲液500 mL为溶出介质,温度为(37±0.5)℃,转速为100 r/min。依法操作,分别在2、3、4、5、10、15、30、45、60、90 min时取滤液3 mL进行吸光度测试,按“2.1”项下紫外条件测定盐酸小檗碱吸光度,并代入标准曲线计算相应的药物浓度,并计算累积溶出百分比,绘制溶出度曲线,进行3次平行试验。
2.5.2 盐酸溶液溶出度测定方法以pH=1.2盐酸溶液500 mL为溶出介质,称取CE 100 mg或者CESD粉末500 mg,测试样品的溶出度。温度为(37±0.5)℃,转速为100 r/min。依法操作,分别在2、4、6、10、15、20、25、30 min时取滤液3 mL进行吸光度测试,进行3次平行试验。
2.5.3 掩味效果感官测试取原料药CE、不同载药量的CE-SD,每份含黄连提取物0.2 g,经8名健康志愿者品尝(口中停留10 s)[19],用0~4分来评价药物的味觉感官,不同分值代表不同的苦味强度。0到4分分别代表没有苦味、可察觉、轻微、中等和强烈。志愿者在品尝前后均用清水漱口30 s,每次试验间隔10 min。
2.5.4 傅里叶变换红外光谱(FTIR)分析采用傅立叶红外光谱仪,KBr压片法制备样品,扫描波数范围为400~4 000 cm-1,分别对原料药CE、尤特奇E100以及载药量为20%的物理混合物和CE-SD进行红外光谱分析。
2.5.5 粉末X线衍射(XRD)分析以铜-Kα射线为辐射源,辐射强度设置为40 kV和100 mA,扫描步长0.02°,扫描范围5~60°,扫描速度4°/min,对原料药CE、尤特奇E100以及载药量为20%的物理混合物和CE-SD进行X线衍射分析。
2.5.6 扫描电镜分析将原料药CE、尤特奇E100以及载药量为20%的物理混合物和CE-SD各组样品均匀撒于贴有导电胶带的样品座上,保持真空度10 Pa、电流20 mA,喷金约60 s,用洁净的镊子取出,置于电镜测试仪器内,保持高压15 kV进行测试。
3 结果与分析
3.1 标准曲线的建立
观察盐酸小檗碱在200~600 nm的紫外吸收光谱图如图1所示,可知在波长345 nm处有最大吸收峰,故选择345 nm作为检测波长。以吸光度(A)为纵坐标、样品质量浓度(C)为横坐标进行线性回归,得盐酸小檗碱回归方程A=0.064 34C-0.031 36(R2=0.999 37),线性范围为4~20 μg/mL。
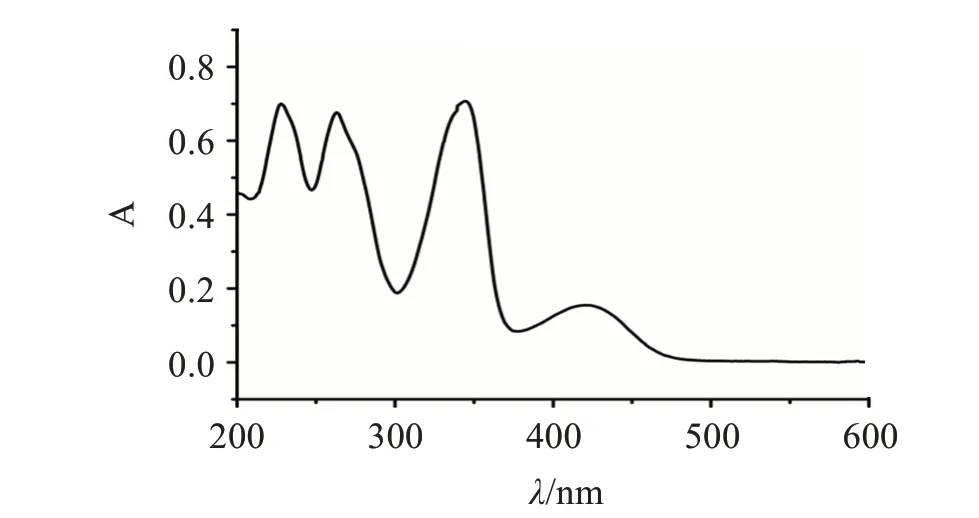
图1 盐酸小檗碱紫外吸收谱图Figure 1 Ultraviolet absorption spectrum of berberine hydrochloride
3.2 薄膜法筛选载体
薄膜法筛选载体的磷酸盐缓冲液溶出度的结果如图2所示。可见,CE在90 min溶出70%左右,共聚维酮VA64药物固体分散体对CE的溶出并无太大影响,聚乙二醇6000、泊洛沙姆188、聚乙烯吡咯烷酮3种药物固体分散体的溶出度都大幅增加,这是由于这些高分子载体都属于水溶性载体,对CE有促溶的作用,这不符合CE掩味的标准,会导致其在口腔中苦味愈加明显。尤特奇E100和乙基纤维素可以明显抑制CE的溶出,其中以尤特奇E100为载体的固体分散体在90 min时只溶出10%左右,故选择尤特奇E100作为高分子载体进行进一步研究。
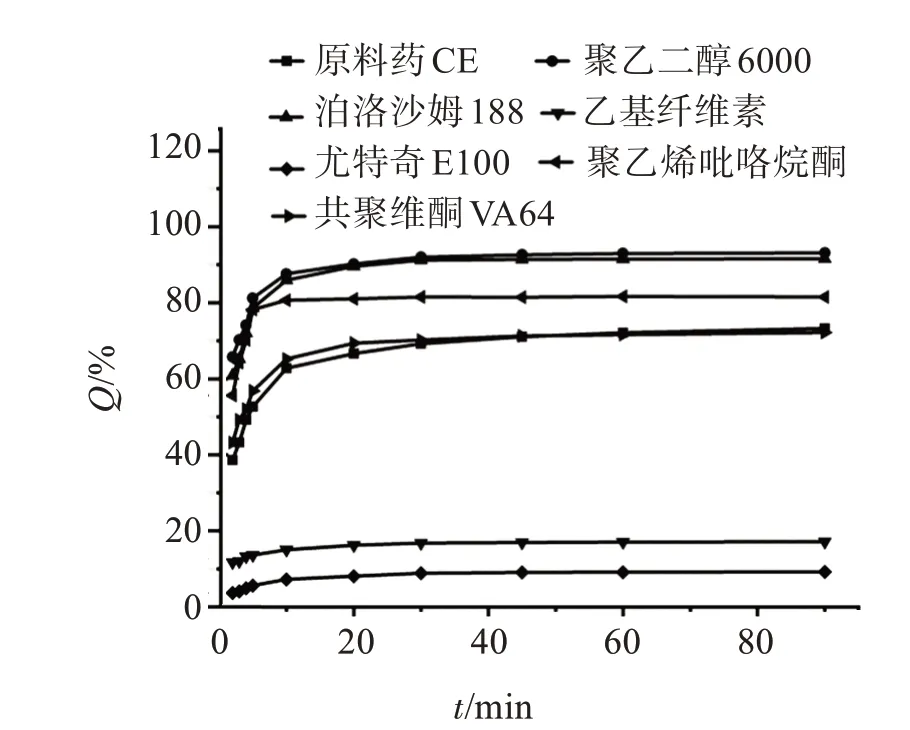
图2 薄膜法制备的固体分散体磷酸盐缓冲液溶出曲线Figure 2 Dissolution curves of solid dispersion phosphate buffers prepared by thin film method
3.3 热稳定性测试结果
药物和载体的热重曲线见图3。可见,170℃时CE质量分数为95.5%,此时CE失重的原因应为水分的失去,当温度继续上升时,CE继续失重,表示有物质开始分解,说明CE在170℃以下稳定。同理,尤特奇E100在270℃以下稳定。综上所述,热熔挤出操作温度以低于170℃为宜。

图3 原料药CE与载体的热重曲线Figure 3 Thermogravimetric curves of CE and carrier
3.4 磷酸盐缓冲液溶出度的测定结果
不同载药量的CE-SD的缓冲液溶出曲线见图4。结果显示,尤特奇E100作为载体时,可以明显抑制CE在缓冲液中的溶出度,且不同载药量的CE-SD在90 min的口腔溶出度的RSD均小于2%,分别为0.85%、1.01%、1.04%、1.32%、1.06%;载 药 量 在10%~20%之间,CE在90 min时溶出度基本在10%左右,尤其在5 min时,溶出度不超过6%,但当载药量大于20%之后,溶出率明显增加,抑味效果明显降低,可能是由于过量的原料药未形成固体分散体,导致部分原料药先行溶出。
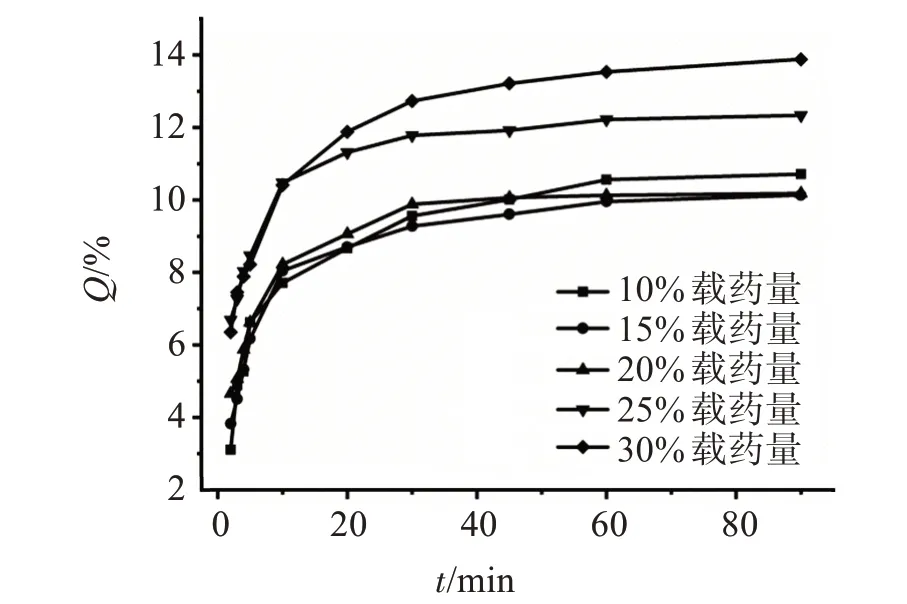
图4 不同载药量CE-SD的磷酸盐缓冲液溶出曲线Figure 4 The dissolution curves of CE-SD with different drug loading in phosphate buffers
3.5 盐酸溶液溶出度的测定结果
不同载药量的CE-SD的盐酸溶液溶出曲线见图5。结果显示,尤特奇E100作为载体时,可以增加CE在盐酸溶液中的溶出度,且不同载药量的CESD在30 min的溶出度的RSD均小于2%,分别为0.86%、1.84%、0.94%、1.13%、1.58%、0.64%;且一定程度下,随载体用量增加,CE的溶出度增加,但超过一定量时,溶出度又减少。载药量为20%时,CE的体外累计溶出度最大,2 min可以达到90%左右,而在载药量大于20%后,溶出度略下降,这可能是因为载药量为20%时CE已经完全呈分子形态或无定形状态分散,载药量再增大,反而抑制了CE的溶出速度。
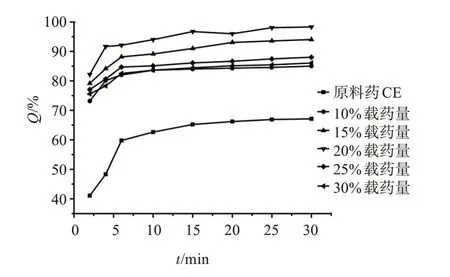
图5 不同载药量CE-SD的盐酸溶液溶出曲线Figure 5 Dissolution curves of hydrochloric acid solution of CE-SD with different drug loading
以上结果显示,CE-SD在磷酸盐缓冲液中溶出度低,在盐酸溶液中可以快速溶解,原因可能是载体尤特奇E100易溶于pH≤5.0的酸性溶液中,在近中性(pH5~7)环境中几乎不溶的特性;在磷酸盐缓冲液中,因为形成良好的固体分散体,所以并未释放大量的药物;而在盐酸溶液中,尤特奇E100快速溶解,同时造成药物的快速释放。
3.6 掩味效果分析结果
原料药CE、不同载药量的CE-SD的掩味效果评分见表1。可见,原料药CE表现出强烈的苦味,大多的志愿者都打出了最高的苦味,不同载药量的CE-SD的苦味得分都明显低于药物溶液的3.875分,表明用尤特奇E100作为载体,对CE有较为不错的掩味效果,其中载药量在20%及以下时,CE-SD的苦味评分均小于0.5分,掩味效果尤其突出。考虑到载药量过小,不利于药物利用,故选择20%载药量进行进一步表征和分析。
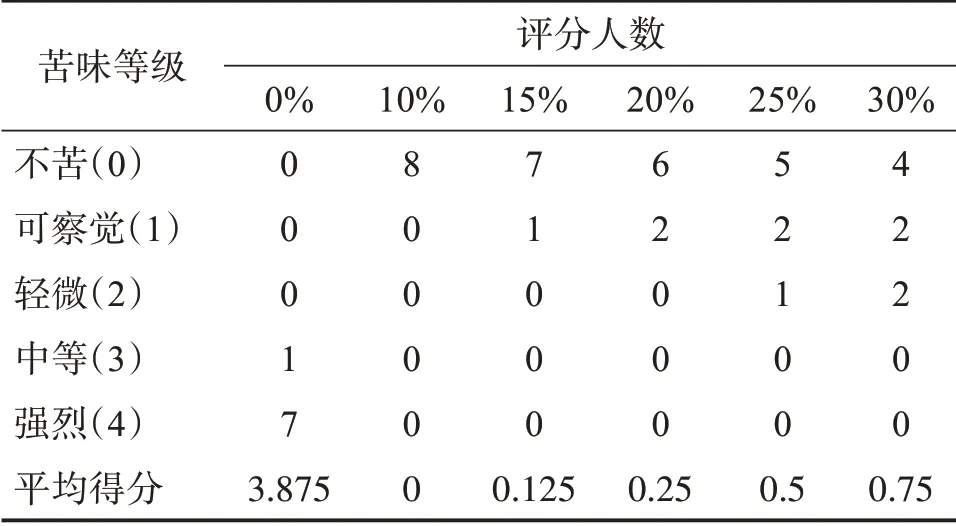
表1 不同载药量的CE-SD的掩味效果Table 1 Odor masking effect of CE-SD with different drug loading
3.7 FTIR分析结果
图6为原料药CE、尤特奇E100、物理混合物和CE-SD的红外光谱图。可见,物理混合物的红外光谱图为CE和尤特奇E100红外光谱图的叠加,CE的特征吸收峰仍然较明显存在,在固体分散体中,O-H振动发生红移,且明显钝化,1 140 cm-1处的C-O吸收峰未发生明显的迁移,但峰强有明显的增加,且属于原料药CE在1 506 cm-1的特征峰消失,表明药物与载体在固体分散体中通过C-H和C-O以氢键作用结合,以无定形状态分散于载体中。
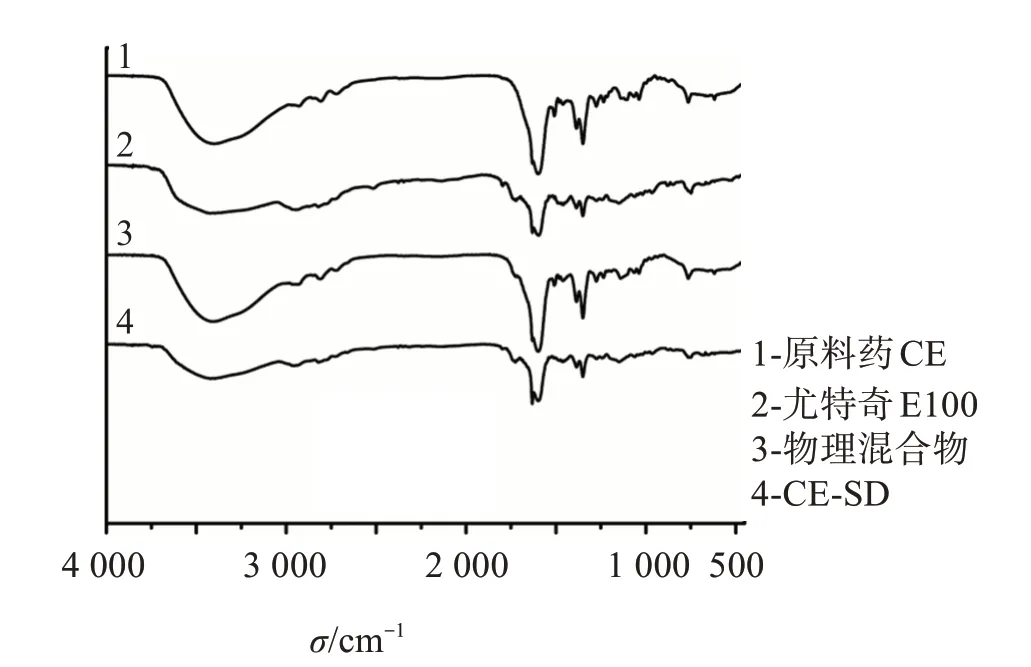
图6 原料药CE、尤特奇E100、物理混合物和CE-SD的红外光谱图Figure 6 FT-IR spectra of bulk drug CE,Eudragit E100,physical mixture and CE-SD
3.8 XRD分析结果
图7为原料药CE、尤特奇E100、物理混合物和CE-SD的XRD图谱。可见,原料药CE(A)在8.86°、9.26°、13.20°、14.74°、16.48°、21.08°、24.74°、25.54°和31.84°有明显结晶特征衍射峰。尤特奇E100为非结晶化合物,无明显的特征衍射峰。在物理混合物的谱图中,仍可以观察到部分原料药CE的特征衍射峰,说明原料药仍以结晶态存在于物理混合物中。而在CE-SD中,原料药CE的特征峰基本消失,说明尤特奇E100对原料药CE有明显的抑晶作用,药物在固体分散体中以无定形状态分散于载体中。
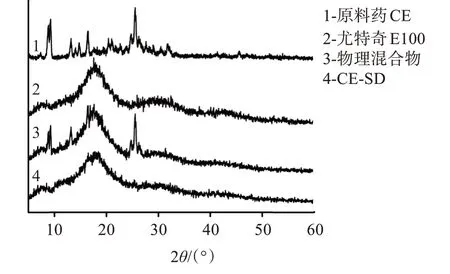
图7 原料药CE、尤特奇E100、物理混合物和CE-SD的XRD谱图Figure 7 XRD patterns of bulk drug CE,Eudragit E100,physical mixture and CE-SD
3.9 扫描电镜分析结果
图8为原料药CE、尤特奇E100、物理混合物和CE-SD扫描电镜图。可见,原料药CE(A)为颗粒较小的无规则晶体,载体尤特奇E100(B)载体则多为无规则晶块,物理混合物(C)中仍以大块状晶体形式存在为主,CE清晰可见附着在载体表面说明药物与载体分布不均匀,而CE-SD(D)中,几乎看不到CE晶体,成无规则形态,药物和辅料融成一个整体,这与XRD中药物结晶特征峰全部消失的结果是一致的,进一步说明药物在固体分散体中以无定形状态分散于载体中。

图8 原料药CE(A)、尤特奇E100(B)、物理混合物(C)和CE-SD(D)的扫描电镜图Figure 8 SEM images of bulk drug CE(A),Eudragit E100(B),physical mixture(C)and CE-SD(D)
4 结语
在本研究中,以尤特奇E100作为载体时,CE在缓冲液中90 min时只溶出10%左右,尤特奇E100是更为适宜的载体材料。当CE∶尤特奇E100∶聚乙二醇6000质量比等于2∶7∶1时,与CE在pH=6.8的磷酸盐介质中的溶出率相比,CE固体分散体在90 min时间内的溶出率可降低至10%,尤其在5 min时,溶出度不超过6%,其苦味评分小于0.5分,有着良好的掩味效果,且在0.1 mol/L盐酸介质中的溶出率在2 min时可达到80%,不影响其在盐酸溶液中的释放。FTIR、XRD和电镜测试结果表明,药物在固体分散体中以无定形状态分散于载体中。

